胃复春片对慢性萎缩性胃炎大鼠模型的防治作用研究
2019-11-19谢咚1,2,3*林玲4*韩涛陆璐叶冠张也青安泳潼孙明瑜
谢 咚1,2,3* 林 玲4* 韩涛 陆璐 叶冠 张也青 安泳潼 孙明瑜

[摘要] 目的 探討胃复春对慢性萎缩性胃炎大鼠模型的防治作用。 方法 将50只Wistar大鼠根据随机分层设计分为五组,每组10只,即正常组(N组)、模型组(M组)、胃复春高剂量组(WH组)、胃复春低剂量组(WL组)、维酶素对照组(VM组)。N组自由正常饮水饮食,其余各组给予100 mg/L甲基硝基亚硝基胍水溶液与0.3 g/L雷尼替丁饲料饲养,56℃ 150 g/L氯化钠溶液与30%乙醇按照10 mL/kg交替灌胃并联合饥饱失常法造模。造模4周后给予药物治疗,WH组和WL组分别灌胃给予胃复春1.44 g/kg与0.72 g/kg,VM组灌胃给予维酶素0.6 g/kg,N组灌胃给予生理盐水10 mL/kg,直至处死。观察大鼠一般情况、胃蛋白酶活力、胃组织病理变化和炎症及凋亡相关基因mRNA变化。 结果 与M组比较,给药组体重增长有不同程度改善,WH组与WL组改善明显;与M组比较,WH组和WL组胃蛋白酶活力有不同程度的升高(P < 0.05),WH组升高明显(P < 0.01);与M组比较,给药组腺体萎缩情况有不同程度减少,与WL组和VM组比较,WH组固有层内可见淋巴细胞、浆细胞、酸性细胞浸润减少;与M组比较,WH组和WL组核转录因子(NF-κB)、肿瘤坏死因子α(TNF-α)、白细胞介素-1(IL-1)、Bcl-2、环氧合酶-2(COX-2)、Caspase-3、Caspase-8的mRNA均显著下调(P < 0.05或P < 0.01),WH组Bax的mRNA显著上调(P < 0.01)。 结论 胃复春能够增强胃蛋白酶活力,治疗作用可能与其抑制促炎因子IL-1、TNF-α及COX-2,下调NF-κB表达,并调节细胞凋亡相关。
[关键词] 慢性萎缩性胃炎;胃复春片;抗炎;基因
[中图分类号] R573.3+2 [文献标识码] A [文章编号] 1673-7210(2019)09(c)-0013-06
Preventive and therapeutic effects of Weifuchun Tablets on chronic atrophic gastritis in model rats
XIE Dong1,2,3* LIN Ling4* HAN Tao4 LU Lu1,2,3 YE Guan5 ZHANG Yeqing5 AN Yongtong5 SUN Mingyu1,2,3▲
1.Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 2.Key Laboratory of Liver and Kidney Diseases, Ministry of Education, Institute of Liver Diseases, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China; 3.Shanghai University, Traditional Chinese Medicine, Shanghai 201203, China; 4.Prescription Teaching and Research Department, Basic Medical College, Shandong University of Traditional Chinese Medicine, Shandong Province, Ji′nan 250014, China; 5.Shanghai Pharmaceuticals Holding Co.,Ltd, Shanghai 201203, China
[Abstract] Objective To explore the preventive and therapeutic effects of Weifuchun on chronic atrophic gastritis in model rats. Methods According to random stratification design, 50 Wistar rats were divided into 5 groups, with 10 rats in each group, namely the normal group (N group), the model group (M group), the high-dose Weifuchun group (WH group), the low-dose Weifuchun group (WL group), and the Vatacoenayme control group (VM group). N group was free to eat and drink water normal, and the other groups were fed 100 mg/L N-methyl-N1- nitro-N- nitrosoguanidine Aqueous Solution and 0.3 g/L Ranitidine feed. The rest groups were constructed by feeding with 100 mg/L N-methyl-N1-nitro-nitrosoguanidine Aqueous Solution and 0.3 g/L Ranitidine, and alternating gavage with 150 g/L sodium chloride solution at 56℃ and 30% ethanol according to the method of 10 mL/kg and combined with starvation and satiation disorder. After 4 weeks of modeling, drug therapy was given, WH group and WL group were respectively given gavage of 1.44 g/kg and 0.72 g/kg of Weifuchun, VM group was given gavage of 0.6 g/kg of Vatacoenayme, and N group was given gavage of 10 mL/kg of normal saline until death. The general situation, pepsin activity, pathological changes of gastric tissue and the changes in mRNA of genes related to inflammation and apoptosis in rats were observed. Results Compared with the M group, the weight gain of the drug group was improved to different degrees, while the WH group and WL group showed significant improvement; compared with the M group, the activity of pepsin in WH group and WL group increased to different degree (P < 0.05), while the WH group increased significantly (P < 0.01). Compared with the M group, the glandular atrophy in the drug group was decreased to different degrees, and compared with the WL group and VM group, the infiltration of lymphocytes, plasma cells and acid cells was decreased in the lamina propria of WH group; compared with the M group, the mRNA levels of nuclear factor-κB (NF-κB), tumor necrosis factor-α (TNF-α), interleukin-1 (IL-1), Bcl-2, cyclooxygenase-2 (COX-2), Caspase-3 and Caspase-8 in WH group and WL group were significantly down-regulated (P < 0.05 or P < 0.01) and the mRNA level of Bax in WH group was significantly up-regulated (P < 0.01). Conclusion Weifuchun can enhance the activity of pepsin, and its therapeutic effect may be related to the inhibition of pro-inflammatory factors IL-1, TNF-α and COX-2, the down-regulation of the expression of NF-κB, and the regulation of cell apoptosis.
[Key words] Chronic atrophic gastritis; Weifuchun Tablets; Anti-inflammation; Genes
慢性萎缩性胃炎(CAG)是由多因素所致的慢性消化系统疾病,表现为胃黏膜上皮和腺体萎缩,数目减少。“正常胃黏膜—浅表性胃炎—萎缩性胃炎—小肠型肠上皮化生—大肠型肠上皮化生—异型增生(中重度)—胃癌(肠型)”是较认可的胃癌发生模式[1]。中国作为胃癌高发国家,CAG的发病率和死亡率在中国恶性肿瘤中占第2位,胃癌死亡人数占全球胃癌死亡人数的45%[2]。以胃黏膜病变程度作为危险因素,CAG进展为胃癌的发病率为4.41%[3],可见减缓此发病模式具有重要的意义。然而目前西药主要采用对症治疗,如抑酸、增强胃动力等,尚缺乏防治胃癌前状态的有效药物。
胃复春片由人参、香茶菜、炒枳壳三味药组成。《别录》中指人参“疗肠胃中冷……调中”,人参皂苷作为人参主要成分联合化疗药物的使用能延长胃癌患者生存时间,改善化疗药物耐药[4],抑制体外胃癌细胞增殖[5];在《日华子本草》中枳壳可“健脾开胃……止呕逆”,枳壳益胃汤可明显改善阴虚津亏所致的消化症状[6],枳壳中的柠檬烯和柚皮苷可增加胃排空功能,促进肠蠕动[7]。《宁夏中草药手册》载:“香茶菜清热解毒,健脾,活血。”研究证明胃复春片单独或与西药联合使用对胃相关疾病如CAG及胃癌癌前病变均有良好的治疗作用[8-10]。
本实验采用甲基硝基亚硝基胍(MNNG)联合饥饱失常造模法[11]诱导大鼠CAG模型,观察胃复春片对于CAG模型大鼠一般情况、胃组织病理、胃组织蛋白酶及相关基因的影响,以探索其可能的作用机制。
1 材料与方法
1.1 实验动物
SPF级雄性Wistar大鼠50只,7周龄,体重(171±10)g,来自上海中医药大学实验动物中心。动物许可证号:SYXK沪2014-008,伦理编号:PZSHUTCM1903 9006,上海中医药大学审查;在12 h明暗交替、湿温适宜恒定的环境中饲养并造模观察。
1.2 药物与试剂
胃复春片由杭州胡庆余堂药业有限公司提供,生产批号:Z2004003,规格0.359 g/片;维酶素片购自新乡恒久远药业有限公司,生产批号:H41024448;胃蛋白酶试剂盒购自南京建成生物工程研究所,生产批号:20181010。MNNG购自梯希爱上海化成工业发展有限公司,货号:M0527;盐酸雷尼替丁胶囊购自浙江康恩贝制药股份有限公司生产,生产批号:10845267484;TOYOBO RNA逆转录试剂盒(货号:766300)、TOYOBO扩增试剂盒(货号:762800)购自东洋纺(上海)生物科技有限公司。引物β-actin、核转录因子κB(NF-κB)、肿瘤坏死因子α(TNF-α)、Bax、Bcl-2、Caspase-3、Caspase-8、白细胞介素1(IL-1)、环氧合酶2(COX-2)由上海冠春生物科技有限公司(bioTNT)设计。不同基因的引物序列见表1。
1.3 方法
1.3.1 动物模型制备及给药
适应性饲养3 d后按体重分层随机设计分组,每组10只,分为正常组(N组)、模型组(M组)、胃复春高剂量组(WH组)、胃复春低剂量组(WL组)、维酶素对照组(VM组)。N组自由正常饮水饮食,其余各组大鼠进行模型制备,造模方法如下:每日自由饮用100 mg/L MNNG水溶液(避光);进食含0.3 g/L雷尼替丁的纯鼠饲料;以3 d为1个造模循环,第1天用56℃ 150 g/L的氯化钠液按照10 mL/kg灌胃;第2天撤饲料禁食不禁饮,模仿饥饱失常;第3天用30%乙醇按照10 mL/kg灌胃。进行动态观察,随机选取1~2只大鼠进行胃组织病理切片制作确认造模是否成功,并连续造模直至处死。第5周起各治疗组每天给予药物干预灌胃,WH组和WL组分别灌胃给予胃复春1.44 g/kg与0.72 g/kg,VM组灌胃给予维酶素0.6 g/kg,N组灌胃给予生理盐水10 mL/kg,第8周末禁食12 h后取材。
1.3.2 样本的采集及处理
3%戊巴比妥钠按照2 mL/kg腹腔注射麻醉。打开腹腔,距离幽门上和贲门下各1 cm处切开取全胃。沿胃大弯剪开,生理盐水清洗胃残留内容物,濾纸吸干,观察胃黏膜质地、颜色、形态等情况。后将全胃等分为四等分,同取左下部分1 cm×1 cm胃组织1块,10%中性甲醛充分固定,脱水石蜡包埋并切片,然后进行苏木精-伊红染色(HE染色),观察胃组织的病理学变化。剩余胃组织于-80℃保存备用。
1.3.3观察方法
1.3.3.1 一般情况 大鼠的毛色、体重、进食量、自主活动及粪便质地等。
1.3.3.2 生化指标 胃蛋白酶检测,按照南京建成生物工程研究所的试剂盒说明书进行测定。
1.3.3.3 组织病理 “1.3.2”取材所成切片用二甲苯脱蜡,高浓度至低浓度梯度的酒精清洗脱水,进行HE染色,中性树胶封片,100×高倍镜下观察胃黏膜上皮排列情况,有无炎症细胞浸润,有无溃疡形成,有无腺体萎缩减少,有无基地膜增厚,有无异型增生。
1.3.3.4 RT-PCR法对胃组织相关基因的影响 用Trizol一步法提取胃组织RNA,计算RNA浓度。以RNA为模板,按照ITOYOBO RNA逆转录试剂盒说明逆转录合成为cDNA。以cDNA为模板,使用SYBR Green qPCR按照TOYOBO扩增试剂盒的说明进行扩增。即MIX 10 μL体系(MIX 5 μL,上游引物1 μL,下游引物1 μL,样本含量1 μL,焦碳酸二乙酯2 μL)。RT-PCR以空白对照组样本的β-actin为对照,按照45个循环,50℃ 2 min→95℃ 1 min→95℃ 15 s→60℃ 1 min→95℃ 15 s→60℃ 1 min为反应条件。计算2-△△Ct检测待测样本基因相对N组基因的表达量。
1.4 统计学方法
采用SPSS 21.0统计学软件进行数据处理与分析。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 一般情况
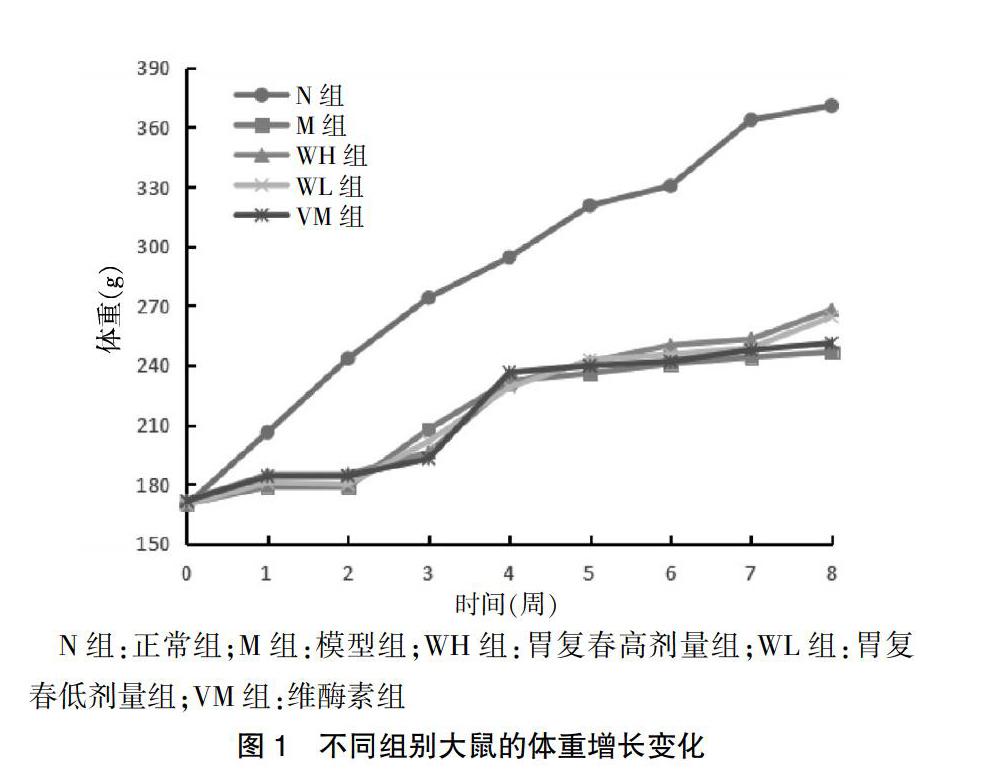
N组大鼠自主活动灵敏,饮食量正常,毛色均匀,无斑秃脱毛,粪便成型。M组大鼠精神激惹,饥饱失常,进食阶段食量增加,粪便不成形,毛色暗淡,出现脱毛,体重增长迟缓。与M组比较,给药后WH、WL、VM组大鼠精神毛色、粪便质地等情况有明显改善,与M组比较,给药组体重增长有不同程度改善,WH组与WL组改善明显。见图1。
2.2 胃蛋白酶检测结果
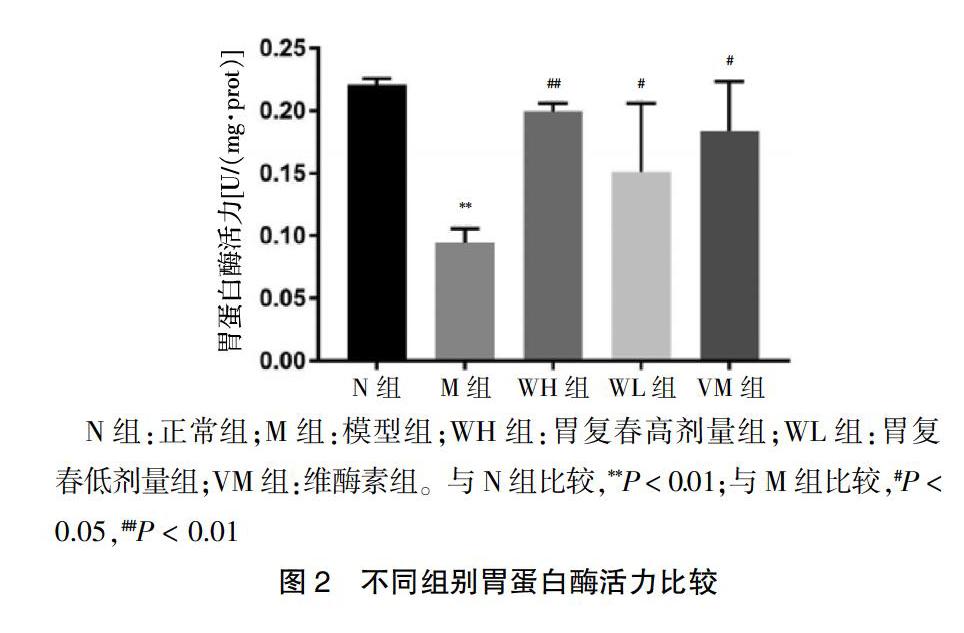
与N组比较,M组胃蛋白酶活力明显下降(P < 0.01)。与M组比较,给药组胃蛋白酶活力有不同程度升高(P < 0.05或P < 0.01),WH组增高明显(P < 0.01)。见图2。
2.3 胃组织病理结果
N组大鼠胃黏膜表面光滑,结构层次完整,上皮细胞排列紧密,无明显炎症细胞浸润。与N组比较,M组胃黏膜上皮固有腺体萎缩,数量减少,黏膜基底增厚,黏膜排列疏松紊乱,固有层内见淋巴细胞、浆细胞等炎症细胞聚集。与M组比较,给药组黏膜排列轻微紊乱,腺体萎缩情况有不同程度减少。与WL组和VM组比较,WH组腺体萎缩减少,固有层内可见淋巴细胞、浆细胞、酸性细胞浸润减少。见图3。
2.4 胃组织相关基因mRNA的表达
与N组比较,M组IL-1、TNF-α、COX-2、NF-κB、Caspase-3、Caspase-8和Bcl-2的mRNA表达均明显上调(P < 0.05或P < 0.01),Bax mRNA表达下调(P < 0.01)。与M组比较,WH组IL-1、TNF-α、COX-2、NK-κB、Caspase-3、Caspase-8、Bcl-2的mRNA表达均明显下调(P < 0.01),Bax mRNA表达上调(P < 0.01)。见图4。
3 讨论
CAG发生时,胃腺体的萎缩使得主细胞减少,分泌胃蛋白酶原能力下降,胃酸刺激后胃蛋白酶隨之活力下降。对于CAG伴或不伴肠化生的患者,胃蛋白酶原Ⅰ常降低[12]。本研究结果提示胃复春可以提高蛋白酶活力。
炎症与肿瘤密切相关[13],持久的炎性反应可以引起原癌基因活化和抑癌基因失活[14],最终导致肿瘤的发生。从CAG进展到胃癌,炎性因子如TNF-α、IL-1、COX-2等作用不容忽视。CAG患者中IL-1β和TNF-α水平高于慢性浅表性胃炎患者[15-16];COX-2在胃黏膜不典型增生和胃癌中均升高[17]。NF-κB作为一种细胞核转录因子,参与机体炎性反应、细胞凋亡和肿瘤增殖等多种过程。近年来,有关在CAG中NF-κB转导途径的角色也引起研究者的重视[18]。炎性因子能够刺激NF-κB活化,启动某些基因的转录,从而上调某些靶基因的表达。本研究发现胃复春可能通过NF-κB通路抑制TNF-α、IL-1、COX-2等基因表达。
此外,Caspase依赖的细胞凋亡途径可能是胃癌疾病发生的中心环节之一。正常细胞凋亡受到抑制,异常增生不能清除而积聚,使得CAG进展到胃癌。Casepase相关蛋白作为参与细胞凋亡的主要因子[19],可通过Casepase级联反应参与细胞凋亡。Caspase-8启动凋亡发生,Caspase-3选择性裂解底物执行细胞凋亡程序[20]。Bcl-2阻断上游Caspase的激活而抑制凋亡,Bax使细胞色素C通过线粒体膜激活Caspase-9蛋白,进而进一步激活Caspase-3引起细胞凋亡[21]。Bcl-2家族在细胞凋亡线粒体途径扮演着重要角色。Bax作为促凋亡基因,Bcl-2作为抑凋亡基因,两者形成二聚体。胃癌细胞的抑制可能与Bcl-2表达下调及Bax表达上调有关[22]。CAG的发生可能与Bax和Bcl-2的调节有关[23-26]。CAG模型中Caspase-3、Caspase-8和Bcl-2表达升高,Bax表达下降。胃复春可能通过抑制Caspase-3、Caspase-8和Bcl-2表达,并升高Bax表达阻止病情进展。胃复春可能通过增强胃蛋白酶活力,抑制促炎因子IL-1、TNF-α及COX-2的表达,下调NF-κB的表达和调节细胞凋亡来治疗CAG。
[参考文献]
[1] Correa P. A human model of gastric carcinogenesis [J]. Cancer Res,1988,48(13):3554-3560.
[2] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China [J]. CA Cancer J Clin,2016,66(2):115-132.
[3] 张华颖,黄鑫宇,薛会光,等.慢性萎缩性胃炎发生胃癌的危险因素:一项长期随访研究[J].世界华人消化杂志,2018,26(31):1812-1817.
[4] Deng H,Zhen H,Fu Z,et al. The antagonistic effect between STAT1 and Survivin and its clinical significance in gastric cancer [J],Oncol Lett,2012,3(1):193-199.
[5] Park EH,Kim YJ,Yamabe N,et al. Stereospecific anticancer effects of ginsenoside Rg3 epimers isolated from heat-processed American ginseng on human gastric cancer cell [J]. J Ginseng Res,2014,38(1):22-27.
[6] 段李桃,党民卿,张星华,等.王道坤教授枳壳益胃汤异病同治举隅[J].陕西中医药大学学报,2017,40(2):21-23,29.
[7] 滕建业.枳壳促进胃动力化学物质组的筛选及作用机理研究[D].沈阳:辽宁中医药大学,2011.
[8] 陈曦,赵亚红,张也青,等.胃复春的临床应用和现代研究进展[J].江西中医药,2016,47(9):77-80.
[9] 徐明星,彭波,张昌欨,等.胃复春治疗慢性萎缩性胃炎临床研究[J].中医学报,2018,33(8):1537-1541
[10] 曾东.胃复春联合麦滋林-S对幽门螺杆菌阴性的萎缩性胃炎126例疗效观察[J].中国中西医结合消化杂志,2015,23(8):576-577.
[11] 林玲,韩涛,陆璐,等.慢性萎缩性胃炎及胃癌前病变动物模型的总结应用与评述[J].中国实验方剂学杂志,2019, 25(2):220-227.
[12] Terasawa T,Nishida H,Kato K,et al. Prediction of gastric cancer development by serum pepsinogen test and helicobacter pylori seropositivity in eastern asians:a systematic reviewnd meta-analysis [J]. PLoS One,2014,9(10):e109783.
[13] Janssen WJ,Henson PM. Cellular regulation of the inflammatory response [J]. Toxicol Pathol,2012,40(2):166-173.
[14] 陳曦,孙明瑜,刘宁宁,等.胃癌癌前病变分子遗传学改变研究进展[J].中国医刊,2018,53(5):477-481.
[15] 乔文,李娜,李长顺,等.IL-1β与人慢性胃炎的相关性研究[J].胃肠病学和肝病学杂志,2010,19(1):47-48.
[16] 梁聚民,钱春花,权兰秋,等.胃癌、慢性萎缩性胃炎患者血清IL-6和TNF-α含量测定[J].第四军医大学学报,2007,28(23):2204.
[17] 罗玉琴,吴开春,孙安华,等.浅表性胃炎、胃粘膜不典型增生及胃癌组织中COX-1、COX-2、iNOS表达的意义[J].中华消化杂志,2000,20(4):223-226.
[18] 钟国新.针刺对慢性萎缩性胃炎模型大鼠NF-κB转导系统影响的研究[D].广州:广州中医药大学,2014.
[19] Yang LQ,Fang DC,Wang RQ,et al. Effect of NF-κB,survivin,Bcl-2 and Caspase3 on apoptosis of gastric cancer cells induced by tumor necrosis factor related apoptosis inducing ligand [J]. World J Gastroenterol,2004,10(1):22-25.
[20] An FF,Liu YC,Zhang WW. Dihydroartemisinine enha-nces dictamnine-induced apoptosis via a caspase dependent pathway in human lung adenocarcinoma A549 cells [J]. Asian Pac J Cancer Prew,2013,14(10):5895-5900.
[21] 李永乐,钱占红,郭志娟,等.中医药调控慢性萎缩性胃炎胃黏膜细胞凋亡的研究现状[J].世界科学技术-中医药现代化,2018,20(6):1004-1009.
[22] 朱玉侠,赵明星,姜登鸽,等.抑癌基因p53、凋亡抑制基因Bcl-2、促凋亡基因Bax在胃癌及癌前病变中的表达[J].胃肠病学和肝病学杂志,2016,25(9):1040-1043.
[23] 李铁军,魏书堂,李惠,等.安胃汤对慢性萎缩性胃炎模型大鼠细胞凋亡因子表达的影响[J].陕西中医,2018, 39(8):987-990,994.
[24] 谭韡,周巍,罗和生,等.深在性囊性胃炎7例临床特点分析[J].疑难病杂志,2017,16(6):627-629.
[25] 马立华,蔡柏.柴芍六君加味方抑制慢性萎缩性胃炎患者胃黏膜腺体萎缩及机制研究[J].西部中医药,2019, 32(7):80-82.
[26] 韦玉娜,张静,王文杰,等.胃炎Ⅰ号对慢性萎缩性胃炎PCNA、Bcl-2和Bax表达的影响[J].世界华人消化杂志,2015,23(6):944-948.
(收稿日期:2019-2-28 本文编辑:张瑜杰)
