胸腺黏液表皮样癌1例
2019-11-16王黎彬戚维波刘海涛谢文华王娟牛牛
王黎彬 戚维波 刘海涛 谢文华 王娟 牛牛
患者女,56岁。因“体检发现纵隔占位9d余”于2017年2月2日入院。既往体健。入院时无胸痛、呼吸困难及肌无力,体格检查:胸部无压痛,四肢肌力正常。胸部CT检查(图1)示前上纵隔见团块状软组织密度影,大小约3.9cm×2.5cm,边界尚清,增强CT扫描(图2)示前上纵隔团块状不均匀软组织密度影,纵隔内未见明显肿大淋巴结。实验室检查肿瘤系列指标正常,初步诊断:前上纵隔占位,胸腺瘤可能。2017年2月8日患者在全身麻醉下行胸腔镜下纵隔肿瘤切除术,术中见胸腺区可见肿块,质中,囊状,边界不清,约4.0cm×3.0cm,将胸腺及肿块完整切除。术中快速冷冻切片病理检查提示上皮性恶性肿瘤,遂将前纵隔及心膈角脂肪一并完整切除。术后病理检查示:纵隔肿瘤由表皮样细胞、中间型细胞和黏液细胞组成(图3);黏液细胞呈杯状,散在分布,体积较大,界限较清楚,胞质空亮,呈泡沫状,胞浆透明,核位于细胞边缘;表皮样细胞呈巢状,部分形成囊腔,细胞界限清楚,细胞之间可见细胞间桥,无明显角化;中间型细胞呈多边形,体积较小,细胞胞质嗜酸性,胞浆少,核圆形或卵圆形,居中。肿块直径约4cm,脉管内未见癌栓,神经未见癌浸润,肿瘤紧贴外膜。心膈角脂肪未见肿瘤浸润。免疫组化检查示:CK(+),CK5/6(+),p40(+),CK20(部 分 +),CDla(-),CD5(-),CD20(-),CD3(-),Ki-67(+,<5%),CEA(部分 +),S-100(-)。病理诊断:胸腺黏液表皮样癌Ⅰ期。术后1周痊愈出院,6个月后复查胸部CT无见明显复发及转移征象。
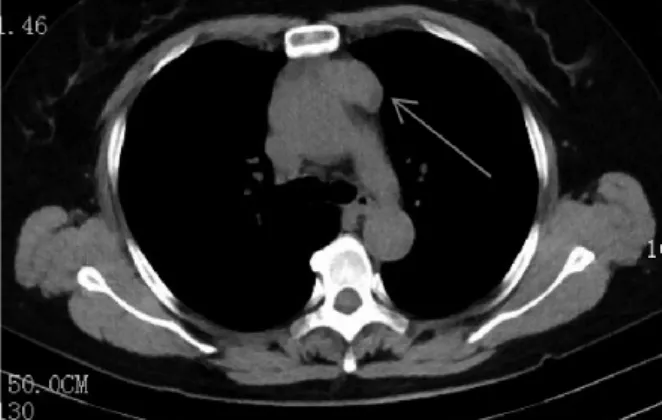
图1 胸部CT检查示前上纵隔占位
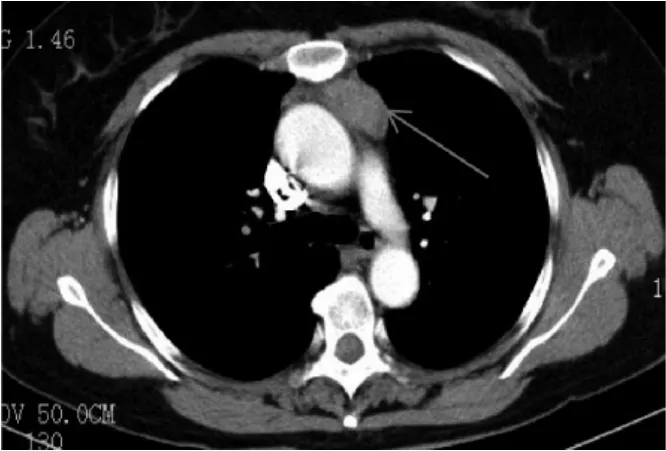
图2 胸部增强CT检查示前上纵隔占位
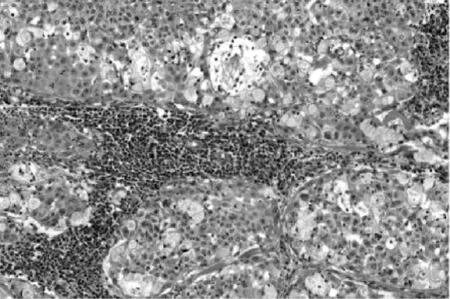
图3 病理检查示肿瘤由表皮样细胞、中间型细胞和黏液细胞组成(HE染色,×100)
讨论黏液表皮样癌主要以黏液样细胞、中间型细胞和表皮样细胞为特征的肿瘤,是一种较少见的恶性肿瘤,其多发于唾液腺、肺等,发生在胸腺十分罕见。胸腺黏液表皮样癌于1982年Snover等[1]首次报道。目前普遍认为,胸腺黏液表皮样癌起源于胸腺的上皮细胞,但是最新研究发现本病可能与胸腺囊肿、MAML2基因重排有关[2-3]。本病可发生任何年龄,好发于17~66岁,平均35岁,男女比例约1∶2。本病临床表现上缺乏特异性症状,大多数患者无任何症状。部分出现胸部不适,包括胸痛、气短、呼吸困难,多与肿瘤大小及临床分期有关。包括本例患者,大多数患者并非因胸部症状就诊,而是因体检或因其他疾病行影像学检查时意外发现纵隔占位。
黏液表皮样癌好发于唾液腺、肺等组织,故诊断胸腺黏液表皮样癌时需排除唾液腺及肺等处黏液表皮样癌的转移。影像学上无特征性征象,CT平扫以前上纵隔见囊状软组织密度影,呈圆形或椭圆形,增强CT扫描见不均匀明显强化多见。易发生纵隔转移,可侵入邻近纵隔脂肪,随后扩散到胸膜、心包、肺或纵隔血管,形成软组织高密度影,边界模糊。MRI成像在明确肿瘤的性质上明显优于CT检查。MRI上主要表现为前上纵隔中信号强度略高于肌肉的T1加权图像和高信号强度的T2加权图像,肿瘤上的多样化强度可反映坏死、囊性区域或出血。应用化学位移图像和扩散加权成像可发现具体的纵隔疾病,使定性诊断更为精确[4]。本病需要与多种疾病相鉴别,包括胸腺增生、胸腺上皮肿瘤、生殖细胞瘤、恶性肿瘤淋巴瘤和囊性肿块[4-6]。该病确诊应依靠病理检查。
目前本病是以手术治疗为主的综合治疗,手术治疗为首选的治疗方法。手术时应最大化地完整切除,最大程度的清除转移组织和彻底清除领近的脂肪组织。手术治疗的关键因素是Masaoka分期和手术切除的完整性[7]。对于中晚期患者,为达到最大化的完全切除可能,术前应行化疗和放疗,术后再行放疗和化疗以提高无病生存期[8]。本病预后较差,但很多研究表明,临床分期和组织学分级是最重要的预后因素[9-10]。因此,准确的组织学分级和临床分期能很高的预测预后。由于本例患者为胸腺黏液表皮样癌Ⅰ期,完整手术切除后至今未发现肿瘤局部复发及远处转移,长期疗效有待进一步随访。
