心功能不全合并冠状动脉慢性完全闭塞病变患者行经皮冠状动脉介入治疗的进展
2019-11-15余智祥刘毅易甫陶凌尹涛
余智祥 刘毅 易甫 陶凌 尹涛
近些年,随着介入技术、器械和术者操作经验的提高,慢性完全闭塞(chronic total occlusion,CTO)病变行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的成功率不断提升,一些有经验的术者成功率更是高达90%以上,已有越来越多的CTO患者接受PCI.EURO-CTO研究[1]显示CTO-PCI可以明显改善患者症状及生活质量.IRCTO研究[2]也证实CTO-PCI可以降低主要不良心血管事件(major adverse cardiovascular events,MACE)发生率.正是基于这些现有的循证医学证据,国内外PCI指南已将CTO-PCI列为Ⅱa类推荐[3-5].然而,冠状动脉完全闭塞后长期缺血会导致部分心肌坏死或处于冬眠状态,导致心功能下降.CTO病变合并严重心功能不全,即左心室射血分数(left ventricular ejection fraction,LVEF)<40%的患者约占CTO病变患者的20%.该类患者手术难度大、手术风险高[6].哪些患者更适合行CTO-PCI以及如何进行CTO-PCI是冠状动脉介入领域亟待探讨及解决的问题.
1 心功能不全合并CTO病变患者是否要行PCI?
对心功能不全合并CTO病变患者行PCI旨在通过血运重建达到改善患者心功能的目的,然而CTO病变成功开通后是否能实现这点尚存在争议.一个纳入34项观察性研究的荟萃分析显示,成功的CTO-PCI可以使LVEF、左心室收缩末期容积(left ventricular end systolic volume,LVSDV)得到明显改善,且LVEF<50%的患者获益更大[7].而EXPLORE研究[8]及REVACS研究[9]均给出了阴性结论.因此,CTO-PCI对心功能的改善尚缺乏随机对照研究证据.最新发表于N Engl J Med的STICHES研究[10]发现,血运重建能够改善缺血性心肌病患者的生活质量及长期生存率,虽然该试验是利用冠状动脉旁路移植术(coronary artery bypass grafting,CABG)进行血运重建,但至少说明对CTO病变血管进行血运重建(CABG或PCI)是有必要的,如果因心力衰竭、其他脏器功能等个体因素不耐受CABG,可通过PCI来实现血运重建.EXPLORE及REVACS研究可能存在一定设计缺陷,比如EXPLORE研究[8]入选的均为ST段抬高型心肌梗死患者,在急诊PCI后1周之内进行CTO血管的PCI,而CTO的成功率并不高(73%),且术前并未利用影像学检查评估CTO供血区是否有存活心肌,另外,亚组分析发现,左前降支的CTO-PCI还是可以显著改善LVEF的.
CTO-PCI对心功能的改善程度可能与以下因素有关:(1)术前缺血程度.多支血管CTO病变或是多支病变合并单支血管CTO病变的缺血性心肌病患者,如果想最大程度地恢复心功能,需要尽可能行完全血运重建.(2)术前缺血时间.心肌细胞缺血时间越长,恢复需要的时间也越长,功能恢复的可能性越小.(3)存活心肌的数量.有明确ST段抬高型心肌梗死病史的患者存活心肌数量较少,会限制心功能的恢复程度.(4)术后CTO血管的长期通畅性.为避免发生二次闭塞,需要尽可能地将分支保留、保证CTO血管的开通质量,这有助于心功能的恢复及维持.(5)CTO血管的解剖位置.左前降支CTO病变开通的价值往往更大.
2 评估或筛选出获益程度较大的心功能不全合并CTO病变患者
对于心功能不全合并CTO病变患者,临床上会更注重行PCI能带来的心功能改善程度.前述影响心功能恢复程度的因素主要取决于CTO血管支配区域存活心肌的数量,存活心肌数量越多,面积越大,术后心功能的改善程度才可能越大,越值得进行PCI,术前特定的检查手段可能会提供一些信息.
存活心肌是指冠状动脉血管闭塞以后,血管支配区域的细胞由于缺血、缺氧而出现收缩功能障碍,但心肌细胞结构完整且具有代谢活动和收缩潜力,当冠状动脉血流恢复后都能够全部或部分恢复收缩功能,是心肌细胞在缺血、缺氧等病理情况下的一种自我保护机制.根据血流灌注情况将存活心肌分为顿抑心肌和冬眠心肌.顿抑心肌是指发生急性短暂缺血时,心肌细胞出现收缩功能障碍,但在冠状动脉再灌注后的数周内功能恢复正常.冬眠心肌是指长期慢性缺血或反复心肌顿抑后,细胞失去收缩功能,但没有坏死的状态,在血运重建后需要较长时间功能才能恢复[11].存活心肌功能的恢复,有可能改善局部室壁运动及整体的心脏功能,是决定CTO血管开通后心功能改善程度的基础.目前评估存活心肌的检查方法主要包括下述几种.
2. 1 单光子发射计算机断层成像术(single photon emission computed tomography,SPECT)
SPECT使用放射性同位素标记示踪剂,通过测量心肌对同位素的富集程度来判断心肌活力.常用的同位素示踪剂是⁹⁹m锝-甲氧基异丁基异腈(⁹⁹mTcmethoxyisobutylisonitrile,⁹mTc-MIBI)与²⁰⅟Tl.⁹mTc-MIBI的优点在于成像时间较短,在使用示踪剂后大约1 h就可以成像;而²⁰⅟Tl成像因为要依赖于其再分布能力,需要在4 h、24 h成像.SPECT中的心肌活力往往会以"全或无"的方式显现出来,往往使用50%的示踪剂活性作为截断值,缺点是并不能评估心肌坏死的透壁程度[12].如果静息成像时显示心肌活力良好,往往不需要进一步成像,但当心肌活力靠近截断值而无法准确判断时,可以进行负荷显像来判断心肌活力.
2. 2 正电子发射断层成像术(positron emission tomography,PET)
PET主要是通过心肌代谢显像和心肌灌注显像来评价是否有存活心肌.方法是利用18F标记的氟代脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)对心肌糖代谢和心肌血流灌注匹配状态进行比较:当心肌灌注节段性降低时,如果FDG摄取相对增加或正常,即心肌灌注与心肌代谢不匹配,说明心肌细胞虽处于缺血状态但仍然存活;反之,若FDG摄取减低,则心肌灌注与心肌代谢匹配,说明该节段无存活心肌.PARR-2研究[13]旨在评估能否利用PET检测判断缺血性心肌病患者血运重建后是否获益,共入选了430例严重心功能不全患者,随机分为两组:PET组首先进行PET检测,如果存在存活心肌则推荐进行血运重建;对照组则依据造影检查结果决定是否进行血运重建.虽然最终结果心原性死亡、心肌梗死、再次住院率的复合终点两组未达到统计学差异,但进一步分析发现,PET组有24.6%患者因为各种原因没有根据PET的检测结果进行血运重建,而其余遵循检测结果进行血运重建的患者终点事件发生率明显低于对照组(HR 0.62, 95%CI 0.42~0.93, P=0.019),因此,若严格按照PET检测决定患者的后续治疗策略可以使患者获益.另外,该研究亚组分析显示,对于术前近6个月未接受过造影检查的患者,终点事件发生率明显低于术前6个月内曾接受过造影检查的患者,而6个月内未曾接受过造影检查的患者病情则更重,多合并陈旧性心肌梗死、CABG、肾功能不全等,对于该亚组是否应该接受血运重建的决策更需慎重,PET检测也更有价值.Ling等[14]对缺血、冬眠、坏死心肌范围进行量化分析,发现PET检测存活心肌范围超过10%的患者,早期接受血运重建治疗生存率要优于药物治疗(P=0.0014),且存活心肌比例越高,带来的获益越大.
冠状动脉CT可检查冠状动脉狭窄程度及病变位置.PETCT则是PET与冠状动脉CT的融合,它的作用是可评估病变血管供血区域的心肌存活情况,具有很好的敏感性和特异性,但是PET-CT最大的缺点则是检查费用昂贵,且只有一些大的医疗中心配备,应用受到极大的限制.
2. 3 超声心动图
超声心动图是目前临床上比较常用的心脏检查方法,经济方便,可以快捷地完成对心脏结构和室壁运动功能的评估,而评估存活心肌主要依靠负荷超声心动图和心肌声学造影.
2. 3. 1 负荷超声心动图 在药物、运动或者电生理负荷条件下,运用超声心动图观察室壁运动的变化,通过对心肌收缩储备能力和室壁运动的评估检测存活心肌.多巴酚丁胺、平板运动试验均可作为负荷方法.多巴酚丁胺是儿茶酚胺正性肌力药,对β1受体有激动作用,可使心肌收缩力增强,心肌氧耗增加.在给予多巴酚丁胺时,缺血心肌可能出现四种表现:双向、恶化、改善、无反应.双向反应是指给予低剂量多巴胺时心肌开始收缩,但大剂量时反而因为缺血加重而停止收缩.恶化反应是指随着多巴酚丁胺量加量心肌收缩功能恶化.双向反应与恶化反应都预示着血运重建后心肌功能有可能恢复.顿抑心肌通常表现为改善反应,即随着多巴酚丁胺加量心肌收缩功能持续改善.如果心肌对多巴酚丁胺完全无反应,则代表着这个区域主要是瘢痕组织,血运重建后功能恢复的可能性较小.
2. 3. 2 心肌声学造影 通过观察心肌细胞毛细血管床的对比剂微泡分布情况来评估心肌微循环灌注,而微循环灌注是心肌存活的先决条件.对比剂微泡的大小与红细胞相似,可以随血流通过毛细血管分布在心肌组织中,通过特殊的成像技术选择性地接收微泡产生的背向散射信号就能检测到代表微循环的信息,从而间接判断心肌细胞的活性.当心肌的微循环没有受损时,对比剂微泡可以均匀地分布于心肌内,心肌呈云雾状影像增强,提示心肌存活;当微循环受损时,则表现为局部心肌影像增强不均、延迟或缺损,提示心肌坏死.Swinburn等[15]对接受血运重建的急性心肌梗死患者进行心肌声学造影检查,结果发现通过心肌声学造影的结果可以很好地预测梗死区室壁运动的恢复情况.
2. 4 核磁共振成像(magnetic resonance imaging,MRI)
心血管MRI(cardiovascular magnetic resonance,CMR)近些年发展迅速,目前可实现对心脏的结构和功能的完整评估,包括室壁运动、冠状动脉显影、冠状动脉血流灌注、心肌存活定量等[16].CMR的优点是检查过程无创且不接触电离辐射,图像具有较高的时间及空间分辨率,可以评估梗死透壁程度,缺点是部分起搏器术后患者无法做该检查,且检查费用高.CMR对于冠状动脉成像的分辨率要明显低于造影或冠状动脉CT成像(computed tomographic angiography,CTA),主要用来识别冠状动脉解剖异常或动脉瘤,而延迟钆增强技术是目前应用较广的评估急性/陈旧性心肌梗死患者存活心肌的方法[17-18].
钆螯合物主要分布在血管内及组织间隙内,一般无法进入存活的细胞内,而坏死的心肌细胞则无法阻挡钆螯合物的进入,在CMR上会显示出增强信号或亮色,这样就可以根据影像评估心肌坏死的范围和程度.有研究发现,这种延迟增强显像的结果与组织病理学有很高的相关性,能较好地评估存活心肌[19].对于严重收缩功能障碍的节段,负荷超声心动图应用受限时,CMR可以很好地发挥作用.如果收缩功能障碍的节段内没有明显的增强信号,说明缺血区的心肌是存活的,功能障但显示有存活心肌的患者PCI术后收缩末期容积指数和LVEF得以明显改善.kirschbaum等[22]发现,CTO患者进行血运重建3年后,左心室重塑及LVEF均得以改善,CTO血管供血区室壁运动也得以改善,而这些参数的改善程度与术前CMR检测到的梗死透壁程度(transmural extent of infarction,TEI)密切相关.后续有研究发现,舒张末期室壁厚度>6 mm、TEI<25%或心外膜非增强区域厚度>3 mm,预示着CTO供血区血运重建后室壁运动改善效果明显[23].一项对比研究发现,如果将TEI的截断值界定为50%,延迟钆增强技术显示出了较高的敏感度及阴性预测值,但特异度低,而利用小剂量多巴胺进行负荷CMR检测具有很高的特异度和阳性预测值,但敏感度和阴性预测值偏低[24].
3 心功能不全合并CTO病变患者行PCI的手术策略
心功能不全合并CTO病变患者具体的手术策略选择可以参照图1中的流程[25].这类患者如果已经达到了病情高危、手术复杂但又急需进行血运重建(complex high-risk procedures for indicated patients,CHIP)的标准,可能不管SYNTAX评分多少都无法进行CABG,只能接受PCI,图中的CABG部分就可以忽略.CHIP的标准[26-27]具体包括:(1)患者病情重、风险高,可能不能耐受外科手术,如患者心功能严重受损或血流动力学不稳定、LVEF≤30%、肺动脉压>50 mmHg(1 mmHg=0.133 kPa)、心脏指数<2.2 L/(min . m2)、肺毛细血管楔压>15 mmHg或是伴有肝肾功能不全、慢性肺部疾病等多脏器功能受损;(2)患者多支病变,合并左主干、分叉、钙化、CTO等一种或多种情况,心肌缺血严重,虽已接受规范的药物治疗,但缺血症状明显,如能通过PCI迅速缓解患者心绞痛症状,改善病情,有血运重建的必要性.CHIP患者手术复杂、病情重、风险高,在CTO基础上如合并多支病变有时可以先处理非CTO血管.
4 心功能不全合并CTO病变患者行PCI的技术
心功能不全合并CTO病变患者行PCI的技术与其他患者没有太大差异,只是患者的心功能状况可能不能耐受较长时间的手术及大量对比剂的应用,因此高效开通CTO血管对于心功能不全患者尤为重要,较早采用正向内膜下重入真腔技术或逆向内膜下重入真腔技术可能会有一定帮助.
5 心功能不全合并CTO病变患者PCI围术期管理
对心功能不全合并CTO病变患者行PCI,如何保证围术期血流动力学的稳定、预防急性心力衰竭的发作是手术成功与否及影响预后的关键.虽然目前仍缺乏足够的循证医学证据表明哪些患者需要进行循环支持,但是心脏团队可以根据患者心功能、冠状动脉解剖特点、手术时间来预判,具体选用哪种循环支持手段则需要根据患者血流动力学水平、循环支持装置置入及护理经验、导管室器械的配备以及患者能承担的费用来选择.目前循环支持的手段包括主动脉内球囊反搏(intra-aortic ballon pump,IABP)、Impella、Tandem Heart以及体外膜肺氧合(extracorporeal membrane oxygenation,ECMO).四种装置的对比见表1[28].
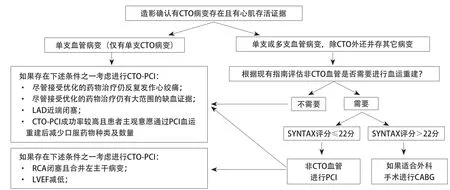
图1 心功能不全患者CTO-PCI手术策略选择流程图

表1 四种循环支持手段对比
BCIS-1研究[29]纳入301例LVEF<30%伴有严重冠状动脉病变且准备行PCI术的患者,半年随访未发现IABP辅助带来的获益,但长期(平均51个月)随访发现,IABP辅助能降低34%全因死亡率[30].对Protect Ⅱ研究[31]中纳入的325例三支血管病变且LVEF<30%的严重冠心病患者进行亚组分析,术后90 d随访结果显示,Impella组MACE发生率(39.5%比51.0%,P=0.039)显著低于IABP组,差异有统计学意义.ECMO作为心肺功能的替代装置可以在PCI术中短期使用,但由于ECMO可能会增加心脏的负荷,可与IABP联用,术后再逐渐过渡为单用IABP辅助.ECMO由于鞘管体积较大,外周血管并发症、肾功能不全以及下肢缺血的发生率相对较高.本中心已进行多例ECMO+IABP辅助下的高危PCI并进行多次手术直播演示,使部分因心功能不全不能耐受PCI的患者最终完成手术,患者术中情况稳定,接受完全性血运重建的可能性大大增加.随着循证医学证据的进一步增加以及围术期护理、管理经验的进一步丰富,ECMO有望成为很有前景的高危PCI辅助器械,但目前仍处于缺乏循证医学证据阶段.
总之,基于现有的循证医学证据及手术器械,对心功能不全合并CTO病变患者行PCI是可行的,可以最大限度地挽救冬眠心肌及顿抑心肌,防止心肌坏死导致的心室重构进一步发展.术前进行相关的影像学检查,选择合适的患者及合理的血运重建策略,术中配以必要的辅助器械,高效地干预供血优势血管,才有望实现缓解症状、提高生活质量、改善心功能、降低死亡率的最终获益.
