儿童急性髓系白血病中血清生长分化因子15的表达水平与预后关系的研究*
2019-11-14单新洁祁晓婷
单新洁,祁晓婷
(1.新疆维吾尔自治区儿童医院检验科,新疆乌鲁木齐 830001;2.新疆维吾尔自治区人民医院临检中心,新疆乌鲁木齐 830001)
急性髓系白血病(AML)在儿童恶性疾病中较为常见,约占所有儿童白血病的30%[1],其本质是髓系造血干细胞/祖细胞的恶性增殖,临床检查以骨髓及外周血中原始和幼稚细胞异常增生为主[2]。目前,儿童AML的治疗主要手段包括化疗及造血干细胞移植[3],其中针对化疗耐药性的研究已成为近年来AML研究热点[4]。血清生长分化因子15(GDF15)是人体内一种重要的信号转导分子,其在炎性反应、风湿类疾病中具有较高表达,近来有报道发现[5],GDF15参与了AML患者骨髓微环境的改变,且在不同化疗反应的患者中具有不同表达水平,这可能与AML细胞的化疗抵抗性有关,但其对于AML患儿的远期预后价值尚不十分明确。为此,对新疆维吾尔自治区人民医院94例AML患儿进行了一项前瞻性研究,报道如下。
1 资料与方法
1.1一般资料 研究对象为2012年1月至2014年8月在新疆维吾尔自治区人民医院诊断及治疗的AML患儿。纳入标准:(1)符合《NCCN临床实践指南:急性髓系白血病》[6]中的诊断标准;(2)于新疆维吾尔自治区人民医院完成全部诊断及治疗过程;(3)确诊时为新发患儿,且年龄<14周岁;(4)未接受造血干细胞移植。排除标准:(1)无法耐受相关治疗而终止治疗者;(2)治疗依从性差,随访不配合者;(3)既往存在血液及骨髓其他疾病者。共纳入94例AML患儿,归为AML组,AML组男48例,女性46例,平均年龄(7.21±3.31)岁;另取同时段、同年龄段的体检健康者100例作为对照组,对照男52例,女48例,平均年龄(7.75±2.81)岁。2组一般资料比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准,2组的儿童及其家属对研究知情并签署知情同意书。
1.2仪器与试剂 低速离心机(购自中国北京时代北利,型号LD5-2A),低温医用冰箱(购自日本三洋,型号MDF-C8V),全自动酶标仪(购自美国 Bio-Rad,型号450),人GDF15酶联免疫吸附测定试剂盒(购自美国 R&D 公司,批号EH150)等。
1.3方法
1.3.1治疗方案 对于诱导缓解治疗依据AML-XH-99危险度分类进行分层治疗[7]:中低危患儿使用DAE(柔红霉素、阿糖胞苷、足叶乙甙)、HAD(高三尖杉酯碱、阿糖胞苷、柔红霉素)、HAE(高三尖杉酯碱、阿糖胞苷、足叶乙甙)中任一方案,急性早幼粒细胞性白血病(M3)患儿使用ATRA(全反式维甲酸)联合DA(柔红霉素、阿糖胞苷)方案,高危患儿使用IA(去甲氧柔红霉素、阿糖胞苷)方案。
1.3.2观察指标 (1)血清GDF15的表达水平:AML组于诱导缓解治疗前后,对照组于正常体检抽取清晨空腹静脉血3 mL,2 500 r/min离心分离血清,置于-70 ℃保存,使用人GDF15酶联免疫吸附法试剂盒检测GDF15水平。比较AML组治疗前后及对照组血清GDF15水平。(2)AML患儿预后情况及临床资料:根据病案信息每2个月对患儿进行1次随访,终点事件为全因死亡。随访时间为48个月,随访截止于2018年8月31日,统计AML患儿的生存和死亡情况。统计生存和死亡组患儿治疗前后的血清GDF15水平,治疗首次疗程达到完全缓解(CR)和发生中枢神经白血病(CNSL)的例数,及以骨髓细胞形态按FAB分类的M0~M7亚型例数,并分析不同预后患儿临床资料间的差异。(3)AML患儿预后的影响因素:应用多因素Cox回归模型分析影响AML患儿预后的独立危险因素,并应用受试者工作特征曲线(ROC曲线)评估不同指标对预后的预测价值。

2 结 果
2.1对照组及AML组治疗前后血清GDF15的表达水平 AML患儿治疗前后血清GDF15水平均显著高于对照组(P<0.05),治疗后AML患儿血清GDF15水平明显低于治疗前(P<0.05)。见表1。
2.2不同预后情况AML患儿临床资料间的对比 在为期48个月的随访中,共发生全因死亡33例,死亡组治疗后血清GDF15水平、CNSL发生率明显高于生存组(均P<0.05),首疗程CR率显著低于生存组(P<0.05)。见表2。
表1 2组治疗前后血清GDF15的表达水平
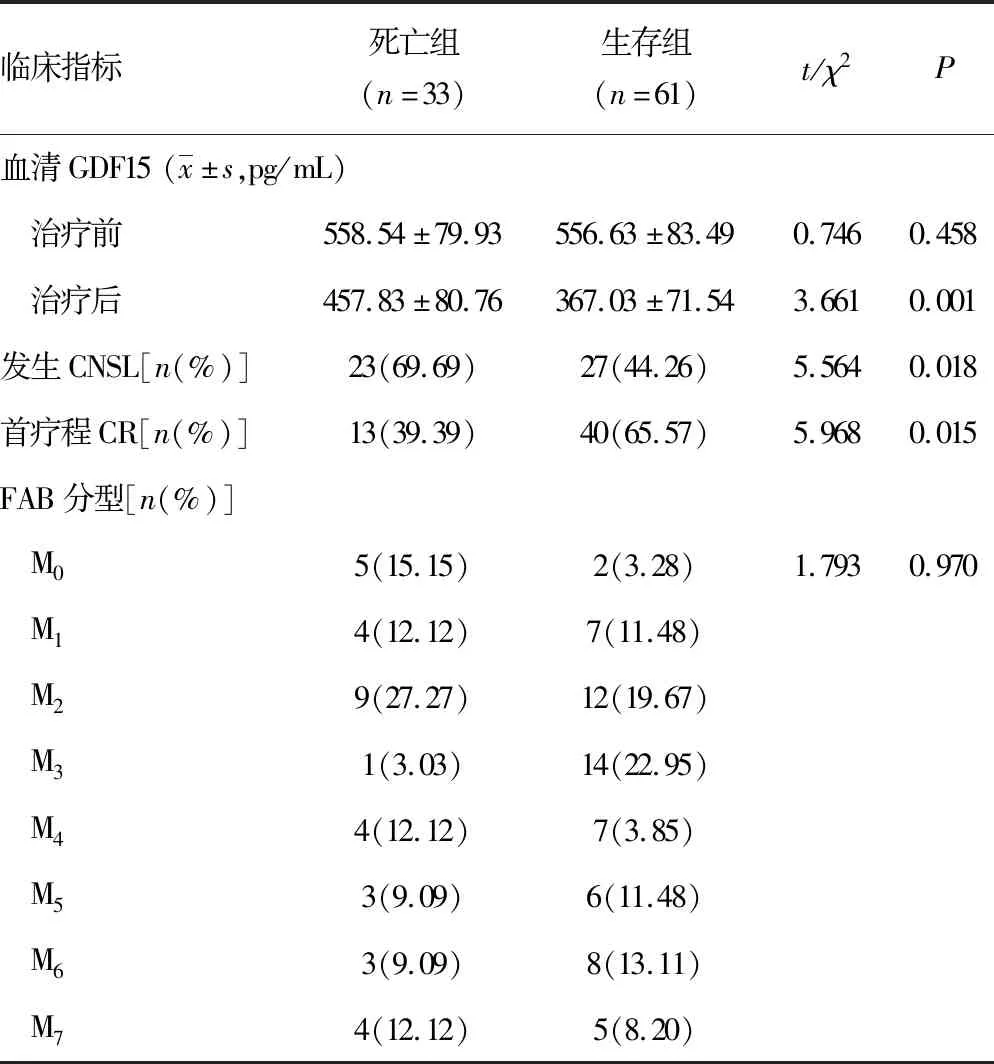
表2 不同预后情况AML患儿临床资料间的对比
2.3影响AML患儿预后的Cox回归分析 治疗后血清GDF15、发生CNSL是AML患儿预后的独立危险因素,首疗程CR是AML患儿预后的独立保护因素。见表3。
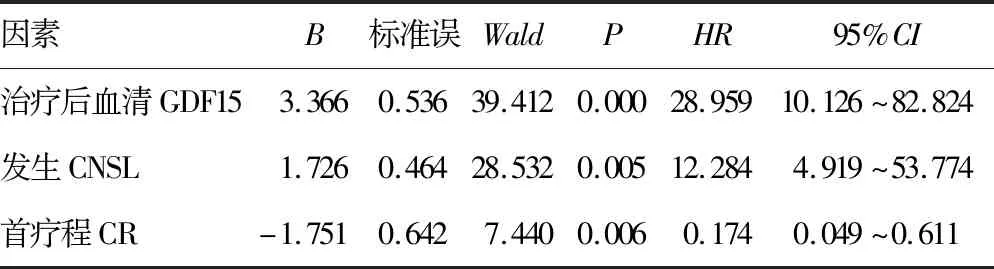
表3 影响AML患儿预后的多因素Cox回归分析
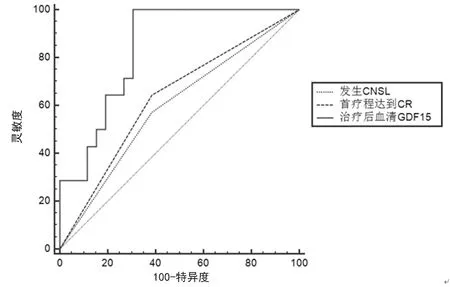
图1 不同指标预测AML患儿预后的ROC曲线
2.4不同指标预测AML患儿预后的ROC曲线 治疗后血清GDF15预测儿童AML预后的ROC曲线下面积(AUC)显著高于发生CNSL及首疗程CR(Z=2.179、2.031,P=0.029、0.042),其最佳截点为≥406.351 ng/mL,灵敏度和特异度分别为97.88%和69.23%。见图1。
3 讨 论
儿童AML的发病机制尚不完全明确,目前较为认同的观点为包括遗传易感性及外界环境暴露在内的二次打击是AML发生的关键[8]。目前,针对儿童AML的治疗已有了显著进步,这主要得益于治疗前危险度分级、针对性的治疗方案、疾病活动监测、适时的造血干细胞移植等[9],但AML患儿的诱导缓解阶段的治疗效果仍不够理想,这严重影响了患儿预后,目前针对白血病对化疗药物的耐受已成为研究热点并取得了一些成功,且有可能成为新的治疗AML的靶点。
GDF15为转化生长因子β中的一员,属于外分泌型蛋白,其功能包括胚胎发育、伤口愈合、细胞趋化等多方面,主要通过细胞表面的受体信号转导途径发挥作用[10]。GDF15在实体瘤中高表达较为常见,可促进肿瘤的发生和发展。血清GDF15水平在肿瘤中也显示了潜在的临床应用价值,相关研究表明血清GDF15水平与结肠癌和子宫内膜癌的进展和预后有关[11-12],有望成为独立预测指标。但目前关于儿童AML血清GDF15的研究较少,鉴于此,本研究分析了AML儿童诱导缓解治疗前后血清GDF15表达水平及其与临床预后的关系。
本研究通过对94例AML患儿及100例健康同龄儿童血清GDF15进行分析,结果显示,AML患儿治疗前后的血清GDF15均显著高于对照组,表明AML患儿白血病细胞会分泌大量GDF15。有研究显示,AML患儿骨髓中存在癌相关成纤维细胞,其分泌的成纤维细胞特异蛋白、平滑肌肌动蛋白使得AML患儿骨髓发生过度网状纤维化[13],这种改变与治疗中较高的复发率及病死率有关,同时体外试管实验表明上述网状纤维化能够从化疗中保护白血病细胞(THP-1/K56系),且上述效应可以被GDF15抗体或GDF15基因敲除所抑制[14],证明白血病细胞确实能够分泌GDF15,且与白血病骨髓过度纤维化及化疗的抗药性有关。本研究还显示,AML患儿的血清GDF15在治疗后有显著下降,但仍高于对照组,可见通过化疗能够显著降低患儿GDF15的表达,但有患儿治疗后仍存在一定程度的高表达,这可能是远期转移及预后不良的重要因素。
通过对94例儿童AML患儿进行为期48个月的随访,共发生死亡事件33例,对比死亡患儿与生存患儿的临床资料结果显示,死亡组具有更高的治疗后血清GDF15水平及更高的CNSL发生率,同时在首次疗程达到CR的人数更少。多因素Cox回归分析显示,治疗后血清GDF15及发生CNSL是AML患儿预后不佳的独立危险因素,首次疗程达到CR是其独立保护因素。LERNER等[15]的研究表明,白血病细胞不止表达高水平的GDF15相关RNA,同时也分泌大量GDF15因子。通过化疗能一定程度抑制白血病细胞生成GDF15,减缓骨髓中正常脂肪细胞的转化,LU等[16]研究也证明了体外培养中的白血病细胞在与添加了GDF15的小骨髓脂肪细胞共同培养时的增殖及扩散的速度更快,这可能是诱导缓解治疗后血清GDF15水平较高及患儿预后较差的原因。通过ROC曲线对比不同指标预测AML患儿预后的差异,结果显示,治疗后血清GDF15预测AML患儿预后的AUC明显高于发生CNSL及首次疗程达到CR的AUC,以最佳临界值(406.351 ng/mL)预测患儿4年生存的灵敏度为97.88%,具有较好的预测价值。CHEN等[17]研究表明AML患儿对化疗药物的反应性与其预后存在直接相关性。治疗后较高的血清GDF15可以通过激活相关信号转导通路加快骨髓组织的过度网状纤维化,同时促进恶性细胞的增殖、扩散及转移,这与LI等[18]的体外研究结果显示GDF15能促进宫颈癌细胞增殖的结果相似。
4 结 论
综上所述,AML患儿具有较高的血清GDF15水平,治疗后血清GDF15是影响其预后的独立危险因素,并对患儿预后判断具有较高的价值。
