MALDI-TOF MS直接鉴定阳性厌氧血培养瓶中细菌的研究*
2019-11-14曹敬荣陈典典段园园刘云屹王培昌
曹敬荣,王 岩,陈典典,段园园,闵 嵘,刘云屹,谢 威,王培昌
(首都医科大学宣武医院检验科,北京 100053)
血流感染是临床上重症感染性疾病之一,具有较高的发病率和病死率[1-2]。研究报道血培养阳性病原菌中绝大部分为兼性厌氧菌,专性厌氧菌的构成比为1%~17%[3]。由于厌氧血培养瓶内营养成分比需氧瓶好,资料显示在血培养双瓶报阳时厌氧瓶报阳时间(TTP)常早于需氧瓶,而且部分兼性厌氧菌只在厌氧血瓶内生长[3]。因此,早期、准确地鉴定阳性厌氧血培养瓶中细菌,提高兼性及专性厌氧菌的阳性检出率,对临床正确采取诊疗措施、降低治疗费用、挽救患者生命等非常重要。基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)已被报道用于直接鉴定血培养标本中的病原菌,为临床微生物检验提供了一种省时、有效的手段,因而成为研究热点[4-10]。本研究应用分离胶促凝管和0.5%十二烷基硫酸钠(SDS)法联合MALDI-TOF MS直接鉴定阳性厌氧血培养瓶中细菌,并与传统阳性血培养鉴定方法比较,分析MALDI-TOF MS直接鉴定临床厌氧血培养阳性菌的可行性和准确性,评价不同前处理方法用于质谱快速鉴定的临床应用价值,为临床早期、快速、准确诊治血流感染提供依据。
1 材料和方法
1.1标本收集 收集2017年8月至2018年8月首都医科大学宣武医院微生物室非重复的阳性厌氧血培养瓶240瓶,经革兰染色镜检有菌生长。剔除标准为血培养报警阳性后涂片镜检未见到可疑菌(假阳性)。
1.2试剂与仪器 全自动血培养系统及其配套的含溶血素厌氧血培养瓶,分离胶促凝管购自美国BD公司,型号FX400;甲酸、乙腈、三氟乙酸购自美国Sigma Aldrich公司;IVD细菌测试标准品、基质(HCCA)、96孔金属靶板和Biotyper3.1鉴定分析软件及质谱仪均购自德国Bruker公司;血琼脂平板和厌氧血平板购自英国OXOID公司;SDS购自美国Sigma公司;厌氧产气袋购自法国Biomerieux公司。
1.3方法
1.3.1阳性血培养涂片镜检及转种后MALDI-TOF MS鉴定 血培养报阳后查看生长曲线和TTP,即刻完成对阳性培养液的染色镜检,初步确定血培养瓶中待测菌种类。同时转种普通血平板和厌氧血平板(厌氧袋培养),分别在需氧和厌氧环境37 ℃培养24~48 h至生长单个菌落。以1 μL加样枪头挑取单个菌落点靶,室温干燥后加入70%甲酸1 μL,室温干燥后加入1 μL基质溶液覆盖,室温晾干后将靶板放到质谱仪,应用Biotyper3.1软件鉴定。质谱鉴定参数为线性、正离子、蛋白峰峰谱范围2 000~20 000 m/z,激光解吸每孔240次。
1.3.2分离胶促凝管法和0.5% SDS法MALDI-TOF MS直接鉴定 将涂片镜检阳性的血培养瓶混匀后,根据文献[7-10]中分离胶法和SDS法处理流程,富集获得阳性厌氧血培养瓶中的细菌沉淀。分离胶法和SDS法前处理流程:用无菌注射器抽取阳性厌氧血培养瓶内溶液4 mL至分离胶促凝管或4 mL含0.5%SDS的离心管,室温下4 000 r/min离心5 min弃上清。分离胶上层边缘的灰白色沉淀或SDS离心后的沉淀中加入无菌水1 mL混匀后移至1.5 mL小型离心管,12 000 r/min离心2 min,弃上清,重复洗涤2次至清亮。沉淀加入300 μL无菌生理盐水和900 μL无水乙醇混匀,12 000 r/min离心2 min后弃上清。加入50 μL 70%甲酸和50 μL乙腈混匀后13 000 r/min离心2 min,取上清(菌体蛋白)1 μL点靶,进行质谱鉴定。每1标本涂抹2个靶位,鉴定结果不一致时重复1次记录结果。
1.3.3质谱鉴定评分标准 鉴定结果包括鉴定到种或属、鉴定出两种或两种以上菌、频谱错误、无鉴定结果、谱峰不足等情况。本研究参考文献自建了MALDI-TOF MS鉴定结果判读标准[10]:分值>2.0或1.7~2.0且均为同种菌记录为种水平;分值1.7~2.0或≥1.6且有两种以上菌记录为属水平;分值<1.6或存在多种不同菌记录为无法准确鉴定。

2 结 果
2.1厌氧血培养的TTP 共收集阳性厌氧血培养瓶240瓶,患者年龄17~95岁,平均(60.11±17.93)岁,男性138例,女性102例;主要分布在急诊科(24.17%,58/240)、普外ICU(16.67%,40/240)、普外科(7.92%,19/240)、神经内科(6.25%,15/240)和骨科病房(5.42%,13/240)。240瓶阳性厌氧血培养瓶包括单一菌阳性234瓶,混合菌生长6瓶,TTP为3.34~114.40 h,平均TTP为(16.87±13.12)h,其中革兰阳性菌和革兰阴性菌的平均TTP分别为(22.05±14.11)h和(14.00±11.43)h,混合菌的平均TTP为(12.42±1.69)h。
2.2分离胶促凝管法和0.5% SDS法MALDI-TOF MS鉴定结果 218瓶(90.83%)厌氧血培养瓶中细菌可用MALDI-TOF MS直接鉴定,4瓶(1.67%)混合菌生长无可靠鉴定结果。SDS法前处理鉴定的准确率(94.17%,226/240)高于分离胶法(90.83%,218/240),两种前处理方法对革兰阴性菌的鉴定准确率(94.81%,146/154和94.16%,145/154)显著高于革兰阳性菌(87.5%,70/80和81.25%,65/80),差异有统计学意义(χ2=3.96、9.53,P<0.05);SDS法和分离胶法单一菌质谱鉴定与菌落鉴定结果的一致率分别为92.31%(216/234)和89.74%(210/234)。分离胶法和SDS法直接鉴定革兰阴性杆菌和革兰阳性菌的准确率差异无统计学意义(P>0.05);分离胶法和SDS法均可鉴定厌氧菌(脆弱/多形拟杆菌,产气荚膜梭菌等)。见表1。
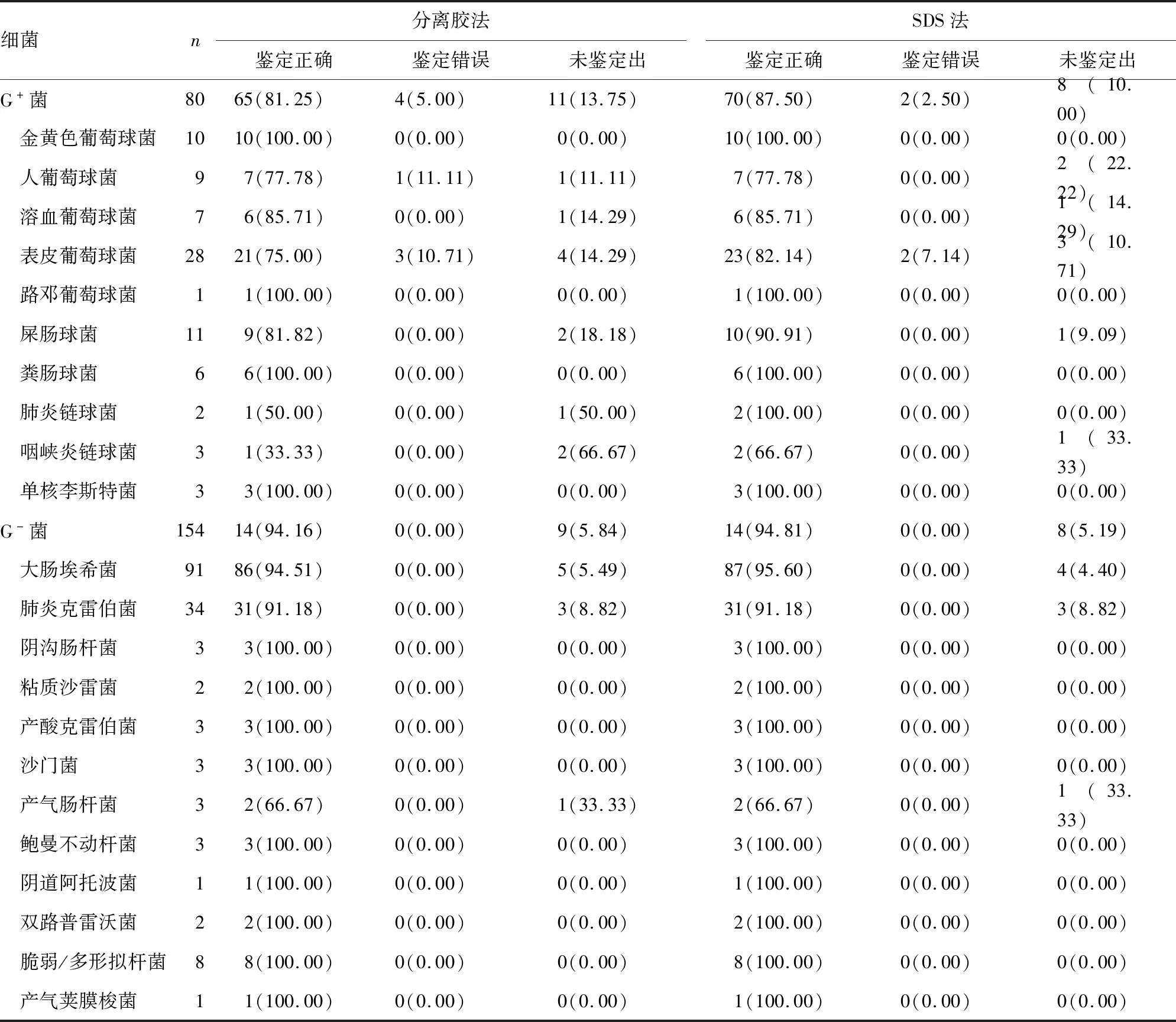
表1 分离胶促凝管法和0.5% SDS法单一菌MALDI-TOF MS鉴定结果[n(%)]
2.3两种前处理方法的鉴定分值 分离胶法和SDS法鉴定分值>2.0分者分别占65.81%和69.23%,1.6~2.0分者分别占23.93%和23.08%,<1.6分及错误鉴定者分别占10.26%和7.69%。SDS法鉴定革兰阳性菌、革兰阴性菌和厌氧菌得分>2.0的比率均高于分离胶法(62.50%,71.83%,83.33%;60.00%,69.72%,58.33%);1.6~2.0分时分离胶法鉴定革兰阴性菌和厌氧菌高于SDS法(23.94%,41.67%;22.54%,16.67%)。见表2。
2.4混合菌的鉴定 本研究共有6瓶阳性瓶为复合菌,分别为金黄色葡萄球菌+屎肠球菌、大肠埃希菌+屎肠球菌、弗劳地枸橼酸杆菌+屎肠球菌、肺炎克雷伯菌+阴沟肠杆菌、肺炎克雷伯菌+粪肠球菌、肺炎克雷伯菌+乳酸乳球菌。其中,分离胶法鉴定出2瓶混合菌,3瓶仅检出了其中一种菌,1瓶无可靠鉴定结果;SDS法鉴定出3瓶复数菌,3瓶仅鉴定出其中一种菌。见表3。
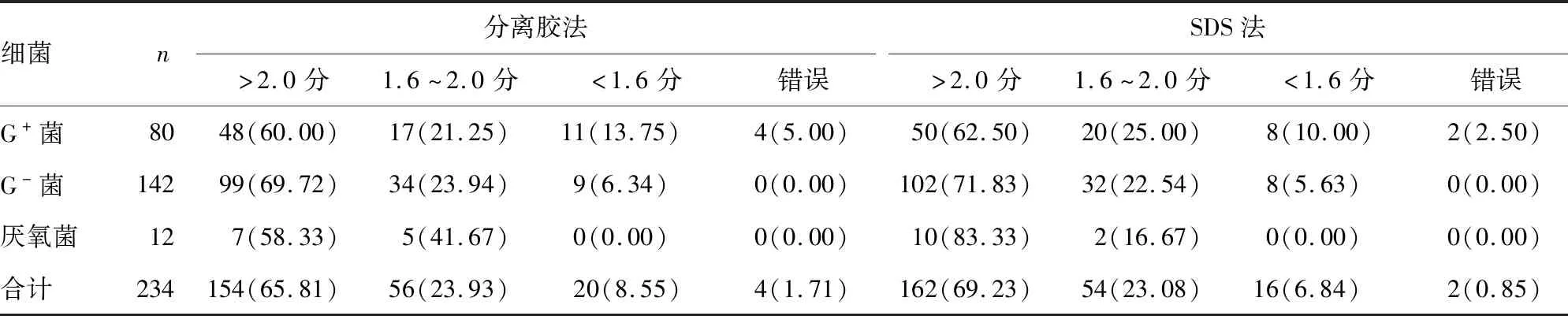
表2 分离胶促凝管法和0.5% SDS法单一菌MALDI-TOF MS鉴定分值[n(%)]

表3 分离胶促凝管法和0.5% SDS法MALDI-TOF MS鉴定混合菌结果
3 讨 论
目前,国内外已有较多报道利用MALDI-TOF MS直接鉴定阳性血培养瓶中微生物的方法,富集菌的前处理方法包括分离胶促凝管法、皂素法、SDS法、预培养后鉴定商品化方法,各种方法均有各自特点和较好的鉴定结果[4-15]。亦有利用质谱技术进行厌氧菌鉴定的文献报道和评估MALDI-TOF MS鉴定灵敏度的报道(可检测100 CFU/mL)[16-18]。血流感染诊治的关键是早期准确的病原学诊断,文献报道厌氧血培养瓶的TTP多早于需氧瓶,且大部分血流感染病原菌为兼性厌氧菌,且厌氧菌引起血流感染有增加趋势,但由于厌氧菌生长缓慢且生长条件苛刻,传统的生化鉴定易出错或鉴定率低,鉴定时间长,结果不可靠[3]。因此,快速鉴定阳性厌氧血瓶中微生物,对临床早期的抗菌药物治疗有较大意义。而MALDI-TOF MS在快速鉴定病原菌方面体现了很大的优势,能显著缩短鉴定时间,本研究在涂片镜检确定有菌基础上应用分离胶法和0.5%SDS前处理方法进行质谱的直接鉴定,并参照之前报道自建了质谱鉴定评分,分析MALDI-TOF MS直接鉴定临床厌氧血培养阳性菌的可行性和准确性,为临床对症治疗提供依据。
本研究共收集阳性厌氧血培养瓶240瓶,通过分析TTP可见,厌氧血培养瓶的TTP最短为3.34 h,最长为114.40 h,平均TTP为(16.87±13.12) h;革兰阴性菌(14.00±11.43) h和混合菌(12.42±1.69)h的平均TTP明显短于革兰阳性菌(22.05±14.11)h,与文献报道一致[1,3]。由此可见,利用质谱直接鉴定可显著缩短报告时间,在报阳后2 h左右即可为临床提供初步鉴定结果,为临床及时抗感染治疗争取宝贵时间。本研究通过两种不同预处理方法结合MALDI-TOF MS直接鉴定结果显示分离胶法和SDS法与纯培养鉴定的符合率差异无统计学意义,均可用于阳性厌氧瓶中微生物的直接鉴定。分离胶法和SDS法在鉴定革兰阴性杆菌显示了较高的准确率(>94%),且对临床常见革兰阴性细菌可准确鉴定到种,显示该两种方法对于革兰阴性菌引起的败血症有更高的可信度,临床可根据血培养直接鉴定结果,结合本机构的耐药性监测数据,及时给予患者针对性治疗可大大减少危重患者的病死率。对厌氧菌的鉴定,两种前处理方法均可鉴定,且SDS法的鉴定准确率(>2.0分)明显高于分离胶法,提示采用0.5% SDS法对标本进行预处理,可达到更高的检出率和更佳的鉴定结果,与文献报道一致[7,10]。革兰阳性菌的鉴定中SDS法(87.50%)前处理的检出率略高于分离胶法(81.25%),二者均可用于阳性血培养瓶的直接鉴定,对金黄色葡萄球菌的鉴定有较好结果(100.00%),而鉴定其他葡萄球菌属(表皮葡萄球菌、人葡萄球菌和溶血葡萄球菌等)的准确率相对较低,可能与其细胞壁中肽聚糖含量多而厚难以裂解出蛋白、以及某些残留的血液蛋白可能干扰质谱峰有关;鉴定链球菌的准确率,SDS法较分离胶法鉴定率明显增高(P<0.05),但两种前处理方法均未得到较好的鉴定结果(33%~66%),可能与链球菌各菌种之间表型及蛋白相似性较高及质谱数据库图谱相对不足有关,与之前文献报道相似,用纯菌落鉴定有时亦难以区分(如肺炎链球菌、缓症链球菌、口腔链球菌等),需加做试验进行确认[1,8,10]。另外,研究显示质谱对混合感染样本的直接检测,有2瓶分别经SDS法和分离胶法处理后质谱直接鉴定(金黄色葡萄球菌+屎肠球菌和肺炎克雷伯菌+粪肠球菌),分离胶法有3瓶仅检出了其中一种菌,1瓶无确切鉴定结果,SDS法亦有3瓶仅检出一种菌,与以往文献的报道类似,可能与两种菌在血培养瓶中的不同比例混合有关[7,19]。文献认为多种菌不同比例混合时质谱能同时检测到两种菌(1∶1或1∶2)或只有优势菌被检出(1∶9比例混合)或无法准确鉴定(同一数量级的多种细菌可互相干扰质谱峰图)[19]。本研究中复数菌的例数和混合菌种类型较少(6例),还需更多的研究数据来证明或使用模拟标本来验证。
4 结 论
本研究利用分离胶促凝管法和0.5% SDS前处理方法联合MALDI-TOF MS鉴定阳性厌氧血培养瓶中的常见菌和厌氧菌,具有快速准确、成本低廉、可行性高的特点,是实验室鉴定阳性血培养中病原菌的一个早期可行的检测手段,SDS前处理法较分离胶法对厌氧菌的鉴定有更高的准确率,适合临床微生物实验室作为难鉴定或重症患者快速鉴定的应用。
