益气解毒方药干预致病菌入侵后肠上皮细胞自噬基因miR130a/ATG16L1的表达
2019-11-14樊冬梅索娜刘洁明任宝琦
樊冬梅, 索娜, 刘洁明, 任宝琦
(1.广州中医药大学第一附属医院,广东广州510405;2.广州市番禺区何贤纪念医院消化科,广东广州510006;3.广州中医药大学2018级硕士研究生,广东广州510006;4.广东省中医院,广东广州510021)
炎症性肠病(inflammatory bowel disease,IBD)是原因不明的慢性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)。IBD病程迁延,反复发作,严重影响患者的生活质量,被世界卫生组织列为现代难治病之一[1,2]。近年来,某些致病菌尤其是侵袭性大肠杆菌(adherent-invasive E.coli,AIEC)的入侵导致的肠上皮细胞(EICs)自噬功能障碍致胞内细菌清除不足,进而引起启动炎症反应通路激活,是肠道黏膜受损、炎症反复发作的关键机制[3-7]。研究表明Atg16L1、Atg5等与IBD的发病密切相关,是控制自噬介导的炎症反应的重要自噬基因,其介导的肠上皮细胞自噬功能异常是IBD肠道炎症启动及复燃的关键[7,8]。感染AIEC后IECs通过上调miR-30c/130a表达、下调自噬基因Atg5、Atg16L1的表达引起细胞自噬功能下降而致胞内致病菌清除不足[3-6]。因此,如何能维持适度的EICs自噬功能从而有效清除IBD相关致病菌对于IBD的预防、治疗和转归极为重要。目前国内许多学者主张益气解毒法用于防治IBD的复发[9,10]。广东省名中医劳绍贤教授就是将本法成功用于IBD防治,临床疗效确切[11-13]。我们前期研究证实以此法为主的复方干预治疗IBD可有效预防复发[11],肠炎灵片作为医院的院内制剂应用于防治IBD的临床中取得了较好的疗效,有着广阔的应用前景。本研究进一步从干预致病菌入侵后肠上皮细胞自噬基因miR130a/ATG16L1表达的角度,探讨益气解毒方药防治IBD的新途径,为其进一步的临床推广提供理论依据,现将研究结果报道如下。
1 材料与方法
1.1 细胞与细菌HCT116细胞株,来自中国科学院细胞库。福氏志贺菌GIM1.539标准菌株购自广州微生物研究所。
1.2 动物SPF级SD大鼠及SPF级鼠料,均购自广东省实验动物中心,动物质量合格证号:0602237。
1.3 药物及制备 益气解毒方组成:党参15 g,白术15 g,茯苓15 g,黄连10 g,救必应30 g,白花蛇舌草30 g,乌药30 g,炙甘草5 g。上述药材饮片由广州中医药大学第一附属医院实验中心药理研究室鉴定并制成3 g·mL-1的中药汤剂。
1.4 试剂与仪器DMEM高糖、双抗、体积分数10%胎牛血清、胰酶(上海立菲生物技术有限公司);ATG16L1抗体、二抗(美国Sigma公司);总蛋白提取试剂盒(广州市杏海生物科技有限公司);Trizol、PCRMix Taq、溴乙锭(北京艾德莱公司);miR130a模拟物及反义模拟物(美国Sigma公司);荧光素酶检测试剂盒(美国Promega公司);琼脂糖、PrimeScriptTMRT reagent Kit(Perfect Real Time)、SYBR®Premix Ex TaqTMII(Tli RNaseH Plus)、RNAiso Plus(日本TAKARA公司);GAPDH引物序列上游5’-GAAGGTGAAGGTCGGAGTC-3’,下游5’-GAAGATGGTGATGGGATTTC-3’;ATG16L1上游5’-GAGCTGCTCCCGTGATGACT-3’,下游5’-CGCCACGTAACTGCCATCAG-3’;miR130a上游5’-AGGCCGCAGTGCAATGTT-3’,下游5’-GTGCAG GGTCCGAGGT-3’;引物合成,于上海生工生物工程有限公司完成。3K30型台式高速冷冻离心机(美国Sigma公司);D1008低速离心机梯度(美国Scilogex公司);D-8721PCR仪(杭州晶格公司);NanoDrop2000超微量核酸蛋白检测仪(美国Thermo Scientific公司);CFX96荧光定量PCR仪、imark酶标仪、2211BR Trans-Blot(SD Cell转印系统、ChemiDocTMXRS+成像仪(美国Bio-Rad公司);TS-1脱色摇床(海门市麒麟医用仪器厂)。
1.5 实验方法
1.5.1 HCT116细胞株的培养和传代 以1∶9比例(体积分数)配制的含胎牛血清的高糖DMEM培养基作为完全培养基,培养基中加入双抗(青霉素100 U/mL,链霉素100 U/mL)。获得细胞后,弃上清液,加入磷酸盐缓冲液(PBS)冲洗后弃上清液。加入2.5 g/L胰酶消化3min,轻轻吹打细胞致完全脱落,立即加入含血清的培养液形成细胞悬液。1 000 r/min离心5min后弃上清液,加入新鲜完全培养基轻轻吹打混匀细胞,后转移至培养皿,做好标记。于37℃、体积分数5%CO2的培养箱中培养细胞2 d。待HCT116细胞贴壁生长至80%以上弃掉培养基进行传代,根据细胞状态可1传2。
1.5.2 中药含药血清制备 按照3 g·mL-1生药浓度制取中药汤剂原液,置于4℃冰箱保存备用。大鼠饲养1周后开始灌胃,每只大鼠每天早9点、晚4点各灌胃1次,每次1.5mL,对照组灌服等量生理盐水。自由进食水,及时补充鼠料。连续给药7 d,第7天灌药前禁食12 h。末次给药2 h后,无菌环境下乙醚麻醉大鼠,采用腹主动脉采血法收集大鼠全血,静置30min,血液以3 000 r/min(离心半径13.5 cm)离心15min,用0.22μm微孔滤膜无菌分离血清,56℃水浴,30min灭活,-20℃冰箱保存备用。
1.5.3 miR130a转染及沉默转染 使用含体积分数10%胎牛血清的DMEM高糖培养基培养细胞,将细胞铺在24孔板中,使用脂质体2000将荧光素酶报告载体同50 nmol/LmiR130a模拟物或相应的阴性对照物共转染至细胞中。转染6 h后,按照荧光强度与阴性对照组对照判断转染是否有效。以上述步骤中合成的目的片段为目的基因的反义基因作为miR130a反义模拟物进行沉默转染。转染都使用脂质体2000,含体积分数10%胎牛血清的DMEM培养基培养细胞,将细胞铺在24孔板中,使用脂质体2000将荧光素酶报告载体同50 nmol/L miR130a反义模拟物或相应的阴性对照物共转染至细胞中。转染6 h后,按照荧光强度与阴性对照组对照判断转染是否有效。
1.5.4 福氏志贺菌GIM1.539标准菌株感染HCT116细胞模型的建立 福氏志贺菌GIM1.539标准菌株液体培养至对数生长期,离心收集细菌,用无抗生素DMEM高糖培养基制备细菌悬液,通过测定吸光度[D(600 nm)]值调整细菌浓度[1D(600 nm)=1×108CFU/mL]。以含体积分数10%小牛血清的DMEM高糖(青霉素100 U/mL,链霉素100 U/mL)为完全培养基,培养HCT116细胞株培养2 d。待HCT116细胞贴壁生长至80%时,弃掉培养基。按照感染复数(multiplicity of infection,MOI,MOI=细菌数∶细胞数)为100∶1加入GIM1.539悬液,37℃、体积分数5%CO2的条件下共培养。入侵分析方法为在没有抗生素的培养基孵化3 h,PBS冲洗细胞,含有100μg/mL庆大霉素在指定时间被加入培养基中,细胞被用1%Triton X-100溶解在脱离子水中,样品持续稀释并固定在琼胶上,细菌的数量通过计数菌落形成单位(CFU)来确定。
1.5.5 蛋白免疫印迹(Western Blot)法检测HCT116细胞中ATG16L1、LC3的蛋白表达 将细胞及培养液移至离心管中,1 000 r/min离心10min,再用预冷PBS,1 000 r/min离心5min洗2次去除培养液。在每毫升冷裂解缓冲液中加入5μL磷酸酶抑制剂,1μL蛋白酶抑制剂和5μL PMSF(浓度200 mmol/L,溶于异丙醇),混匀。冰上保存数分钟待用。在离心管的细胞中加入上述配制好的冷裂解缓冲液,5×106个细胞,加入量约为0.4mL,冰上操作,细胞与冷裂解缓冲液一同转移至新的预冷的离心管中,置于4℃摇床平台上;温和振荡15min,14 000 r/min,4℃离心15min,取上清为全蛋白提取物,蛋白定量后,分装保存于-70℃,避免反复冻融。按照试剂盒说明绘制标准曲线测定蛋白质浓度。经十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)分离、转膜,20 g/L白蛋白4℃封闭过夜后,依次加入一抗,4℃过夜,弃去一抗加入相对应的二抗,ECL显色,曝光、显影、定影、拍照、扫描后通过BandScan软件进行条带灰度半定量分析,以GAPDH为内参。
1.5.6 荧光定量聚合酶联反应(PCR)法检测HCT116细胞中miR130a、ATG16L1的RNA表达 以6×105/孔接种至6孔板中的细胞处理6 h后,以PBS漂洗细胞3次。每孔加入1mL Trizol,按照Trizol说明书提取总RNA。从-80℃冰箱中取出样品RNA,于4℃解冻,然后在0.2mL PCR管中配制反应溶液,37℃、42℃15min(反转录反应)进行cDNA的合成,SYBRGreen PCR,将PCR管置于定量PCR仪中进行反应。
1.5.7 实验分组 体外GIM1.539感染HCT116细胞模型建立后,根据添加的血清不同、干扰方案的不同分组,每次实验每组设6个复孔。具体分组见表1。

表1 细胞实验分组Table 1 The grouping in the cell test
1.6 统计方法 使用SPSS 19.0统计软件,计量资料以均数±标准差()表示,首先对每组数据进行正态分布和方差齐性分析。样本例数较小(n=6),对于组内差异比较,若服从正态分布且方差齐性,则选用单因素方差分析;对于组间差异比较,若服从正态分布且方差齐性,采用独立样本t检验,否则选用秩和检验。检验结果以P<0.05表示差异具有统计学意义。
2 结果
2.1 Western Blot法检测HCT116细胞中ATG16L1、LC3的蛋白含量 各组细胞转染成功并接受干预完成后,用Western Blot法检测各组细胞内的ATG16L1、LC3蛋白含量水平,电泳结果见图1、2,其灰度值结果见表2、表3。结果显示:含药血清干预方式与无药血清干预方式miR130a模拟物组ATG16L1、LC3蛋白含量均较空白转染组明显减少(P<0.05);含药血清干预方式与无药血清干预方式miR130a反义模拟物组ATG16L1、LC3蛋白含量较空白转染组均明显增多(P<0.05);含药血清干预方式miR130a模拟物组、反义模拟物组和空白转染组的ATG16L1、LC3蛋白含量均较同组无药血清干预方式的含量多(P<0.05)。除此之外,无论何种干预方式,miR130a模拟物或反义模拟物的阴性对照物组的ATG16L1、LC3蛋白含量均与空白转染组无明显差异。
2.2 荧光定量PCR法检测HCT116细胞中miR130a、ATG16L1的基因表达2组细胞转染成功并接受干预完成后,用荧光定量PCR法检测各组细胞中的miR130a、ATG16L1的基因表达水平,结果见表4、5。结果显示:含药血清与无药血清干预方式miR130a模拟物组分别与本组空白转染组比较,miR130a模拟物组miR130a的基因表达明显上升(P<0.05),而ATG16L1的基因表达明显下降(P<0.05);含药血清与无药血清干预方式miR130a反义模拟物分别与本组空白转染组比较,miR130a反义模拟物组miR130a的基因表达明显下降(P<0.05),ATG16L1的基因表达明显上升(P<0.05);而含药血清干预方式miR130a模拟物组、反义模拟物组和空白转染组的miR130a基因表达均较同组无药血清干预方式的下降(P<0.05),而ATG16L1基因表达均较同组无药血清干预方式的上升(P<0.05)。
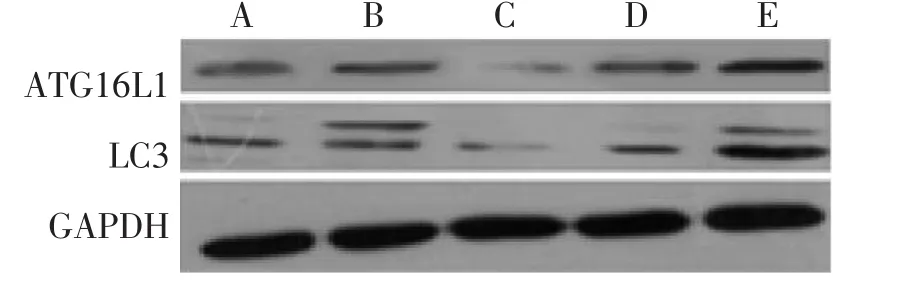
图1 含药血清干预的HCT116细胞中ATG16L1、LC3蛋白表达Figure 1 The protein expression of ATG16L1 and LC3 in HCT116 cells intervened by drug-containing serum
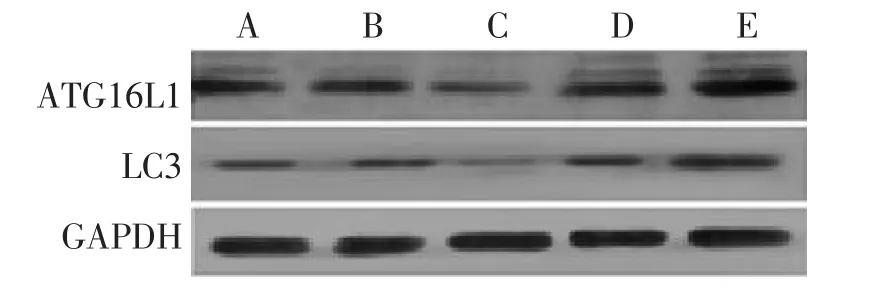
图2 无药血清干预的HCT116细胞中ATG16L1、LC3蛋白表达Figure 2 The protein expression of ATG16L1 and LC3 in HCT116 cells intervened by drug-free serum
表2 2种不同干预方式下各组HCT116细胞ATG16L1蛋白含量比较Table 2 Comparison of the protein content of ATG16L1 in HCT116 cells of various groups after2 types of intervention(,n=6)
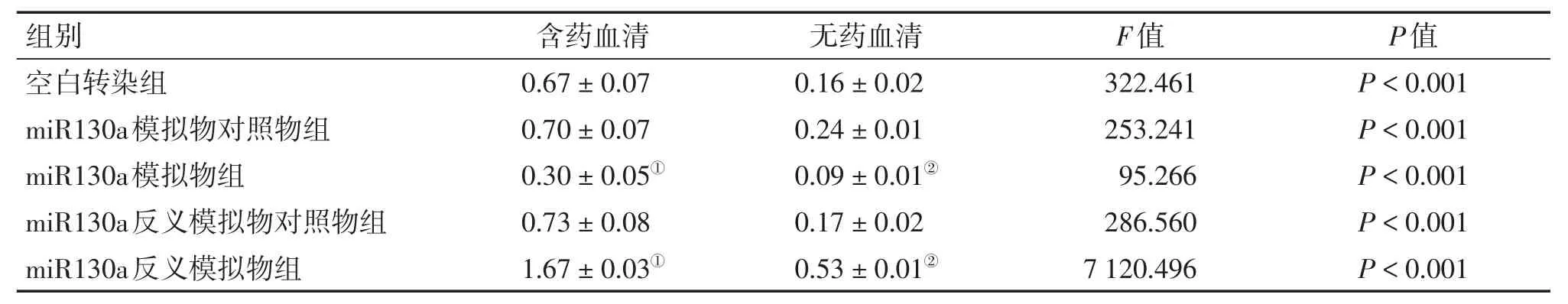
表2 2种不同干预方式下各组HCT116细胞ATG16L1蛋白含量比较Table 2 Comparison of the protein content of ATG16L1 in HCT116 cells of various groups after2 types of intervention(,n=6)
①P<0.05,含药血清干预方式中与空白转染组比较;②P<0.05,无药血清干预方式中与空白转染组比较
组别 含药血清 无药血清F值P值空白转染组miR130a模拟物对照物组miR130a模拟物组miR130a反义模拟物对照物组miR130a反义模拟物组0.67±0.07 0.70±0.07 0.30±0.05①0.73±0.08 1.67±0.03①0.16±0.02 0.24±0.01 0.09±0.01②0.17±0.02 0.53±0.01②322.461 253.241 95.266 286.560 7 120.496 P<0.001 P<0.001 P<0.001 P<0.001 P<0.001
表3 2种干预方式下各组HCT116细胞LC3蛋白含量比较Table 3 Com parison of the protein contentof LC3 in HCT116 cells ofvarious groups after2 types of intervention(,n=6)
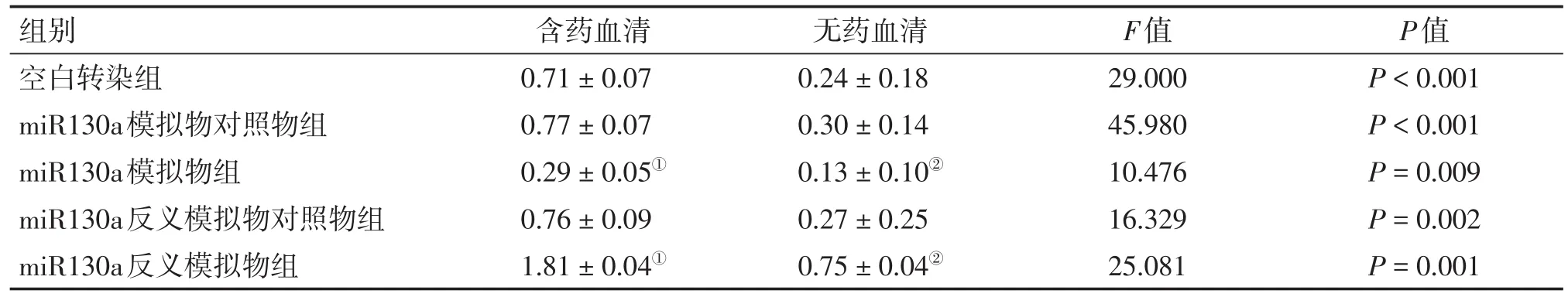
表3 2种干预方式下各组HCT116细胞LC3蛋白含量比较Table 3 Com parison of the protein contentof LC3 in HCT116 cells ofvarious groups after2 types of intervention(,n=6)
①P<0.05,含药血清干预方式中与空白转染组比较;②P<0.05,无药血清干预方式中与空白转染组比较
组别空白转染组miR130a模拟物对照物组miR130a模拟物组miR130a反义模拟物对照物组miR130a反义模拟物组含药血清0.71±0.07 0.77±0.07 0.29±0.05①0.76±0.09 1.81±0.04①无药血清0.24±0.18 0.30±0.14 0.13±0.10②0.27±0.25 0.75±0.04②F值29.000 45.980 10.476 16.329 25.081 P值P<0.001 P<0.001 P=0.009 P=0.002 P=0.001
表4 2种干预方式下各组HCT116细胞m iR130a的基因表达比较Table 4 Com parison of the gene expression ofm iR130a in HCT116 cells ofvarious groups after2 types of intervention(,n=6)
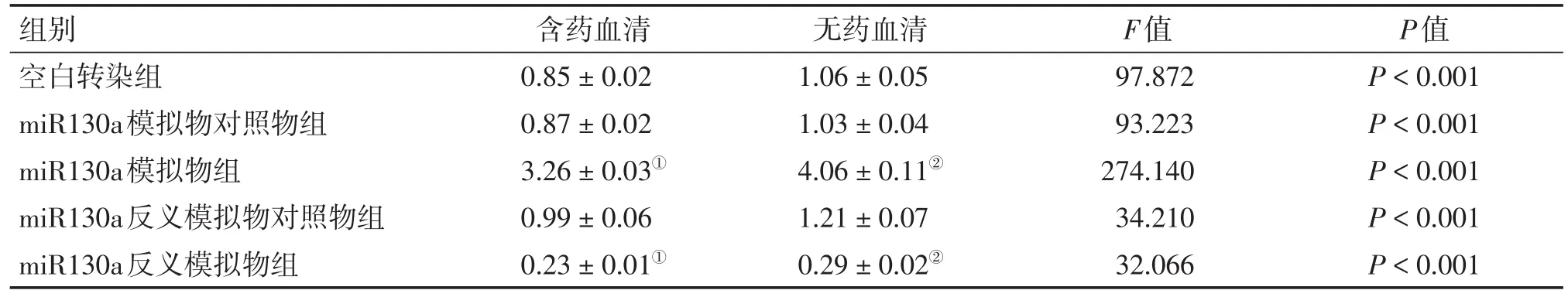
表4 2种干预方式下各组HCT116细胞m iR130a的基因表达比较Table 4 Com parison of the gene expression ofm iR130a in HCT116 cells ofvarious groups after2 types of intervention(,n=6)
①P<0.05,含药血清干预方式中与空白转染组比较;②P<0.05,无药血清干预方式中与空白转染组比较
组别空白转染组miR130a模拟物对照物组miR130a模拟物组miR130a反义模拟物对照物组miR130a反义模拟物组含药血清0.85±0.02 0.87±0.02 3.26±0.03①0.99±0.06 0.23±0.01①无药血清1.06±0.05 1.03±0.04 4.06±0.11②1.21±0.07 0.29±0.02②F值97.872 93.223 274.140 34.210 32.066 P值P<0.001 P<0.001 P<0.001 P<0.001 P<0.001
表5 2种干预方式下各组HCT116细胞ATG16L1的基因表达比较Table 5 Com parison of the gene expression of ATG16L1 in HCT116 cells ofvarious groups after 2 types of intervention(,n=6)
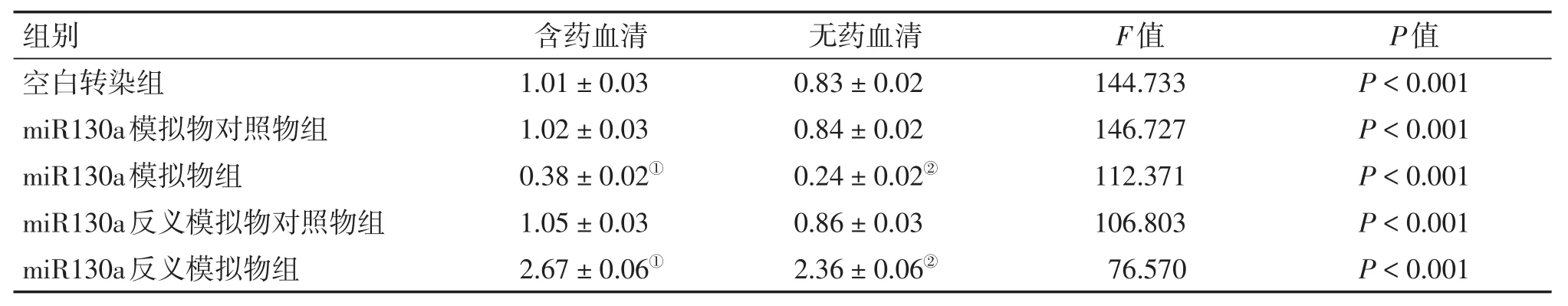
表5 2种干预方式下各组HCT116细胞ATG16L1的基因表达比较Table 5 Com parison of the gene expression of ATG16L1 in HCT116 cells ofvarious groups after 2 types of intervention(,n=6)
①P<0.05,含药血清干预方式中与空白转染组比较;②P<0.05,无药血清干预方式中与空白转染组比较
组别 含药血清 无药血清F值P值空白转染组miR130a模拟物对照物组miR130a模拟物组miR130a反义模拟物对照物组miR130a反义模拟物组1.01±0.03 1.02±0.03 0.38±0.02①1.05±0.03 2.67±0.06①0.83±0.02 0.84±0.02 0.24±0.02②0.86±0.03 2.36±0.06②144.733 146.727 112.371 106.803 76.570 P<0.001 P<0.001 P<0.001 P<0.001 P<0.001
3 讨论
某些致病菌尤其是AIEC入侵导致的肠道稳态及免疫系统平衡被打破是肠道黏膜受损、炎症反复发作的关键机制[2]。充分的证据显示IBD患者肠道微生态紊乱,表现为潜在的有益菌如双歧杆菌、乳酸杆菌、厚壁菌数量的下降以及假定的致病菌如拟杆菌属、大肠埃希杆菌数量的上升,并证实了在IBD患者回肠末端黏膜附着大量AIEC,能接近及入侵人IECs,导致IECs自噬能力下降,细菌复制,促使炎症激活,不仅在IBD急性期,也是缓解期导致炎症复发的主要因素。因此,IBD致病菌感染相关性细胞自噬功能障碍与IBD发病密切相关[3-6]。志贺菌属又称痢疾杆菌,是重要的侵袭性大肠杆菌之一[14]。目前国际上有采用志贺菌作为入侵菌进行入侵IECs探讨IBD发生机制的研究[5,6,8],因此,本研究采用志贺菌作为入侵菌进行研究。
自噬是真核生物普遍存在的自稳机制,在胚胎发育、细胞自我保护和生存等过程中发挥关键作用。自噬参与胞内微生物感染具有双重作用:一方面,自噬能够降解入侵的微生物,即以异源吞噬的方式清除胞内的病原体;另一方面,有些微生物如IBD某些致病微生物能够抑制细胞自噬而利于自身存活导致炎症反应。人类全基因组关联研究揭示,ATG和其他已知影响自噬过程的基因中的微小单核苷酸多态性位点,与克隆氏病的易感性有相关性[7]。ATG16L1在自噬小体形成中发挥关键作用,遗传删除ATG16L1能损害自噬小体的形成以及蛋白通过自噬途径的清除,而且还导致TLR激动剂诱导的巨噬细胞促炎因子分泌的增强[15],葡聚糖硫酸钠诱导的结肠炎加重[16],ATG16L1基因表达在EICs和潘氏细胞,其基因突变诱导亦导致不能有效清除肠道细菌感染,引起肠黏膜炎症启动[17,18]。LC3是酵母自噬相关蛋白ATG8的哺乳动物同源基因,LC3翻译后经修饰形成主要位于胞浆中的LC3-Ⅰ,自噬发生时,LC3-Ⅰ与磷脂酰乙醇胺(PE)结合,定位于自噬体膜上,即LC3-Ⅱ。它在自噬小体的延伸和闭合过程中均发挥重要功能,其作为自噬体膜的重要组分,对于自噬的产生和检测起着不可替代的作用。对于LC3调控的研究主要集中在转录翻译后的修饰水平,有研究发现IBD致病菌所致IECs自噬障碍通路可检测到LC3的表达调控异常[4]。因此,也作为本研究评价细胞自噬功能指标之一。目前细胞自噬对IBD炎症启动的潜在作用已经越来越明朗,细胞自噬与抗感染免疫密切相关,病原体导致的细胞自噬障碍是诱发炎症反应和炎症性疾病的一个重要因素。新的研究已经证明IBD相关病原体介导的自噬缺陷、病原体清除障碍和IBD发病机制之间存在相关性[4,5]。ATG介导的细胞自噬可清除降解细胞内受损伤的细胞结构以及细胞内细菌感染等,是重要的自噬蛋白。许多研究表明致病菌感染相关IBD自噬异常可能与自噬蛋白调控缺陷有关,但其深入的机制可能与调控自噬的相关miRNAs有关[4,5,19]。最新研究[4,5,19]显示,IBD相关致病菌AIEC感染后可通过上调miR130a表达下调自噬基因ATG16L1的表达,引起细胞自噬功能下降。靶基因预测发现ATG16L1基因存在miR130a的靶点。即miR130a可与靶ATG16L1基因的3’端非翻译区结合,引起其降解或抑制其蛋白翻译,推测miR130a可能通过该机制下调ATG16L1基因表达从而影响细胞自噬。
本研究通过对福氏志贺菌GIM1.539入侵HCT116人结肠癌上皮细胞模型进行miR130a模拟物、miR130a反义模拟物转染,即miR130a过表达和沉默转染,检测细胞ATG16L1的蛋白含量以及基因表达,并与空白转染组对照,同时分别对应进行miR130a模拟物阴性对照物和miR130a反义模拟物阴性对照物转染作为参照,证实自噬基因ATG16L1表达受miR130a调控。当细胞内miR130a模拟物含量增多时,抑制ATG16L1基因表达,生产该蛋白的量减少,称为过表达;而当细胞内miR130a反义模拟物增多时,竞争性地与胞内miR130a结合,从而使ATG16L1得到更多表达,称为沉默。同样原理,通过同时检测细胞内LC3自噬蛋白含量,结果显示miR130a过表达时,LC3蛋白含量亦随之减少;miR130a沉默时,LC3蛋白含量随之增加。虽然LC3蛋白调控机制在本课题中未作深入研究,但是当miR130a过表达时,ATG16L1、LC3含量均减少,足以证实自噬小体的形成必然受阻,从而表明miRNAs/ATG网络调控是影响细胞自噬的重要机制。
IBD病因复杂,被世界卫生组织列为难治性疾病。2006年中医消化病诊疗指南将本病划归中医“痢疾”“肠澼”“腹痛”“便血”范畴。多数医家[9,10]认为,IBD是在脾胃虚弱的基础上感受寒、热、湿毒之邪,伤于饮食劳倦或情志,致热、湿、痰等邪客于肠道,阻滞气血,肠络失和,脂膜受损而发病。脾胃虚弱、运化失常是IBD发病过程中的内在共性。鉴于此,国内许多学者提出气虚毒邪内伏是IBD病情反复及复发的病机关键,并指出气虚尤其脾气虚是毒邪内伏难以去除的主要原因,而毒邪多由风寒暑湿燥火侵犯人体后,深伏其中,缠绵不去,导致毒邪稽留,暗耗正气,每于正气虚弱或其他诱因触发,屡发屡重,缠绵难愈,因此在治疗上主张“益气解毒为主”是IBD的防治大法[9,10]。中医毒邪类似于致病菌,但IBD致病菌入侵后单纯用清热解毒方法治疗效果却不明显,因此类致病菌可导致细胞自噬功能障碍,细菌清除不足,毒邪反复侵袭留存于体内促使炎症启动及复发。那么,益气解毒防治IBD复发的有效机制可能是干预细胞自噬障碍维持适度的细胞自噬功能促使毒邪(致病菌)外出,与中医益气促使毒邪外出理论不谋而合。自噬的自我调控功能与中医“气”相通。自噬的自我调控是有一定条件的,当细胞受到不良环境的刺激,通过激发一系列信号因子(目前科学界认为与miRNAs/Atg调控网络有关)对自噬进行调控,这与中医气的推动和调控功能相似。中医认为气虚则动力不足、功能低下,气盛则易生邪毒,而气具有自我调节功能,若气的调控作用正常,自噬既无太过,也无不及,细胞内部各种功能活动则取得协调平衡,内环境得到稳定[20]。当正气不足,气的防御功能异常,细胞抗邪能力下降,自噬不足,外邪(致病菌)首先攻破人体免疫的第一道防线(入侵肠上皮细胞),继而因正气虚弱无法有效激活自噬网络调控,自噬相关基因低表达,无法清除胞内菌和有害物质,为炎症的进一步发展提供了机会。故认为自噬障碍是中医气虚的表现。因此,推测益气解毒法防治IBD复发的有效机制可能是通过干预细胞自噬障碍以扶正,助肠EICs促使毒邪(致病菌)清除而发挥作用。基于此,构建AIEC感染EICs体外模型,检测益气解毒方药干预后胞内自噬基因表达,从而探讨miRNA/ATG调控通路,一方面可为阐明IBD通过自噬障碍引起炎症复发的病理机制以及益气解毒方药干预途径,另一方面可为揭示IBD中医气虚毒邪内伏理论的科学内涵提供新思路。
本院劳绍贤教授最早提出气虚毒邪内伏是IBD反复发作的病理机制,并以益气解毒法为主制成了院内制剂肠炎灵片在临床推广应用40余年,取得了满意疗效。益气解毒方(肠炎灵片)主要由党参、白术、救必应等药物组成,其中:救必应为冬青科植物铁冬青的干燥树皮或根皮,味苦、性寒,异名为白木香,始载于《岭南采药录》,称“白木香,味苦,清热毒”,为我国南方地区民间惯用草药,具有清热解毒、消肿止痛、利湿、祛风解毒等功效;党参温补中焦、益气补虚,具有健脾功效。在此基础上加入黄连、白花蛇舌草、乌药、木香,黄连配以白花蛇舌草擅清胃肠湿热,加强清热燥湿、涩肠止痢、泻火解毒的功效;木香、乌药辛散温通,使方中有升有降,亦可健脾益气,行气止痛。本研究通过对体外福氏志贺菌GIM1.539感染HCT116细胞模型进行miR130a过表达和沉默转染后,分别予以大鼠益气解毒方含药血清和大鼠无药血清进行干预,检测细胞LC3的蛋白含量、ATG16L1的蛋白含量和基因表达以及miR130a的表达进行对照。结果显示,含药血清干预方式miR130a模拟物组、反义模拟物组和空白转染组的LC3蛋白、ATG16L1蛋白和基因表达均较同组无药血清干预方式的表达增多。含药血清干预方式miR130a模拟物组、反义模拟物组和空白转染组的miR130a基因表达均较同组无药血清干预方式下降。表明益气解毒方药可能是通过干预miR130a的基因表达使ATG16L1蛋白得到调控。研究结果同时证实了LC3自噬蛋白的含量有所提升。
综上所述,益气解毒方药可能是通过抑制miRNAs的基因表达、上调ATG自噬基因的表达来维持肠上皮细胞自噬功能,从而有效清除胞内菌控制IBD炎症复发。但仍需进一步从自噬小体观察、胞内菌清除、炎症因子、体内实验等方面证实。
