开郁清热方通过调节胰岛细胞凋亡保护胰岛功能的机制研究
2019-11-14宋军甄仲邓岚仝小林
宋军, 甄仲, 邓岚, 仝小林
(中国中医科学院广安门医院,北京 100053)
糖尿病的发生是由于胰岛细胞不能产生足够胰岛素和/或胰岛素抵抗所致,其整个病程都伴随着胰岛功能的衰竭。1型糖尿病和2型糖尿病胰岛功能衰竭产生的机制是不同的。1型糖尿病主要是胰岛β细胞因自身免疫而凋亡,致胰岛素生成缺失,炎症在这个过程中起着很重要的作用。2型糖尿病胰岛功能衰竭与细胞因子、游离脂肪酸和持续的高糖环境密切相关,在这些因素的长期影响下,胰岛素分泌被抑制,胰岛β细胞凋亡增加[1]。胰岛素瘤细胞株(INS-1)源自X射线照射的移植胰岛瘤的大鼠,胰岛素阳性,可合成胰岛素原Ⅰ和Ⅱ,是比较公认的一种用于胰岛β细胞功能研究的细胞模型[2],故本研究选取INS-1细胞构建胰岛功能衰竭模型。本研究围绕INS-1凋亡,探讨肥胖型2型糖尿病胰岛β细胞病变与中药开郁清热方的干预作用及机理,现将研究结果报道如下。
1 材料与方法
1.1细胞来源及培养大鼠INS-1细胞由解放军307医院赠送。以RPMI-1640培养基加入体积分数10%胎牛血清(FBS)、100 IU/mL青链霉素,在37℃、体积分数为5%CO2的条件下无菌培养INS-1细胞,每24 h更换培养基1次,待细胞密度达到70%~80%后细胞传代、冻存。
1.2主要药物与试剂开郁清热方(主要由黄连、大黄、白芍、柴胡、天花粉等组成)由天士力集团提供;马来酸罗格列酮片[葛兰素史克(天津)有限公司,批号:09060108]。软脂酸、牛血清白蛋白BSA(美国Sigma公司);RPMI 1640培养基(美国Gibco公司);Trizol(美国Invitrogen公司);RevertAidTM First Strand cDNA Synthesis Kit(Fermentas公司);SYBR Green PCR Master Mix(美国Thermo Fisher Scientific公司);引物采用primer premier 5.0软件设计,由上海赛百盛公司合成;兔抗大鼠多克隆抗体p53、Bax、Bcl-2(武汉博士德有限公司,稀释度为1∶100)。
1.3主要仪器GeneAmp 5700 TaqMAN PCR仪(美国Applied Biosystems公司);ImageMaster VDS凝胶图像分析仪(美国Pharmacia Biotech公司);Allagra.21R高速冷冻离心机、紫外线分光光度计(德国Backman公司);DU640型核酸蛋白分析仪(美国Backman公司);OYY-Ⅲ-5型电泳仪(北京六一仪器厂);Image Pro Plus图像分析软件。
1.4含药血清的制备SD大鼠30只,雄性,8周龄,体质量180~220 g,平均体质量(200±21)g,购自北京维通利华实验动物中心,动物质量合格证号:SCXK(京)2012-0001。以开郁清热方水煎剂按体表面积折算的等效剂量给SD大鼠灌胃[3],每日2次,连续3 d。血清对照组大鼠给予同体积的生理盐水灌胃。末次灌胃前禁食12 h,末次灌胃后1 h,腹主动脉采血,静置2 h,3 000 r/min离心15 min,分离血清,经56℃30 min灭活处理后,用0.45μm(或0.22μm)微孔滤膜过滤除菌,置-20℃保存备用。
1.5模型的建立及分组将INS-1细胞分为正常组、高糖诱导组、血清对照组、中药小剂量组、中药大剂量组、罗格列酮组共6组。每组5个复孔。
1.5.1 正常组 取同代INS-1细胞置于含完全RPMI-1640培养基培养5 d,后以完全RPMI-1640培养基换液继续培养12 h。
1.5.2 高糖诱导组 取同代INS-1细胞置于含高浓度葡萄糖20 mmol/L的培养液内培养5 d,后以完全RPMI-1640培养基换液继续培养12 h。
1.5.3 血清对照组 取同代INS-1细胞置于含高浓度葡萄糖20 mmol/L的培养液内培养5 d,后以正常大鼠血清的完全RPMI-1640培养基继续培养12 h。
1.5.4 中药小剂量组 取同代INS-1细胞置于含高浓度葡萄糖20 mmol/L内培养5 d,后以5%含药血清的完全RPMI-1640培养基继续培养12 h。
1.5.5 中药大剂量组 取同代INS-1细胞置于含高浓度葡萄糖20 mmol/L内培养5 d,后以10%含药血清的完全RPMI-1640培养基继续培养12 h。
1.5.6 罗格列酮组 取同代INS-1细胞置于含高浓度葡萄糖20 mmol/L内培养5 d,后以含1 mol/L罗格列酮钠片的完全RPMI-1640培养基继续培养12 h。
1.6指标检测与方法
1.6.1 流式细胞术检测细胞凋亡 收集数目(1~5)×106个/mL细胞,500~1 000 r/min离心5 min,弃去培养液。3 mL PBS洗涤1次。离心去PBS,加入冰预冷的体积分数70%的乙醇4℃固定1~2 h。离心弃去固定液,3 mL PBS重悬5 min。400目的筛网过滤1次,500~1 000 r/min离心5 min,弃去PBS。用1 mol/L碘化丙啶(PI)染液染色,4℃避光30 min后,应用流式细胞仪检测细胞凋亡。
1.6.2 逆转录聚合酶链反应(RT-PCR)法检测Sirt1、叉头状转录因子O1(FOXO1)mRNA表达 选用β-actin作为内参照以进行RT-PCR半定量分析。设计引物如下:①r-Sirt1-F:5’-TTGGCACC GATCCTCGAA C-3’;r-Sirt1-R:5’-CCCAGCTC CAGTCAGAACTAT-3’。②r-FOXO1-F:5’-ATC CGCTGCCTGCAGTGGACC-3’;r-FOXO1-R:5’-C CTTGTCCAGCATGAGGTTCTCC-3’。③β-actin-A:5’-GAGACCTTCAACACCCCAGCC-3’;β-actin-S:5’-AATGTCACGCACGATTTCCC-3’。RT-PCR反应体系按试剂盒说明书进行制备。扩增反应条件:95℃5 min;95℃25 s,55℃25 s,72℃50 s,40个循环;72℃5 min。反应结束计算CT值,为避免假阳性信号,使用熔解曲线来检查非特异性产物的构成。以β-actin基因为内标参照,使用比较法(△△CT)来计算基因的相对定量(p)。
1.6.3 免疫组化法检测凋亡相关基因Bcl-2、Bax、p53蛋白表达 将做好的细胞爬片在室温自然干燥后置于体积分数95%乙醇中固定20 min,于室温下在3%H2O2室温孵育10 min,以消除内源性过氧化物酶的活性,蒸馏水洗2次。微波热修复抗原,然后室温冷却。PBS清洗,擦干,加山羊血清封闭20 min,倾去血清,直接加兔抗大鼠多克隆抗体p53/Bax/Bcl-2(稀释度均为1∶100),4℃湿盒过夜。PBS清洗,加山羊抗兔IgG,37℃20 min,PBS清洗,加链酶亲和素—过氧化物酶抗体(SABC)试剂,37℃20 min,PBS清洗,DAB显色,最后苏木素轻度复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。阳性结果以高倍镜(×400)下随机选取5个视野,以细胞或细胞核中出现棕黄色为阳性反应,计数阳性细胞数的百分率。阴性对照以PBS代替一抗,其余同。
1.7统计方法采用SPSS 17.0软件进行统计处理,所有数据以均数±标准差(s)表示,多组比较采用单因素方差分析,进而用最小显著差异法(LSD)进行两两比较。以P<0.05为差异有统计学意义。
表1 各组INS-1细胞凋亡率比较Table 1 Comparison of the apoptosis rate in INS-1 cells of various groups (s,p/%)
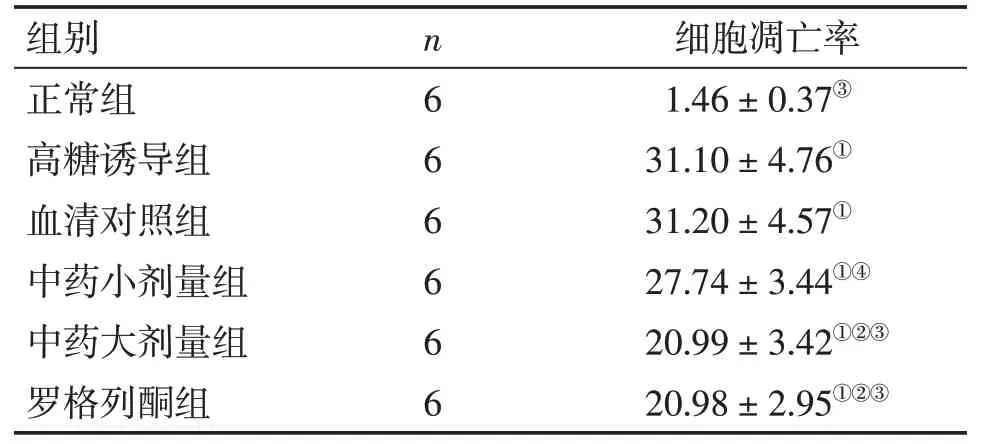
表1 各组INS-1细胞凋亡率比较Table 1 Comparison of the apoptosis rate in INS-1 cells of various groups (s,p/%)
①P<0.05,与正常组比较;②P<0.05,与高糖诱导组比较;③P<0.05,与血清对照组比较;④P<0.05,与罗格列酮组比较
细胞凋亡率1.46±0.37③31.10±4.76①31.20±4.57①27.74±3.44①④20.99±3.42①②③20.98±2.95①②③组别正常组高糖诱导组血清对照组中药小剂量组中药大剂量组罗格列酮组n6 6 6 6 6 6
2 结果
2.1各组INS-1细胞凋亡率比较表1、图1结果显示:与正常组比较,高糖诱导组,血清对照组,中药大、小剂量组及罗格列酮组INS-1细胞凋亡率均显著升高(P<0.05);与高糖诱导组和血清对照组比较,中药大剂量组、罗格列酮组INS-1细胞凋亡率显著降低(P<0.05),且2组作用效果近似。表明大剂量开郁清热方可有效保护胰岛β细胞,减低胰岛β细胞凋亡。
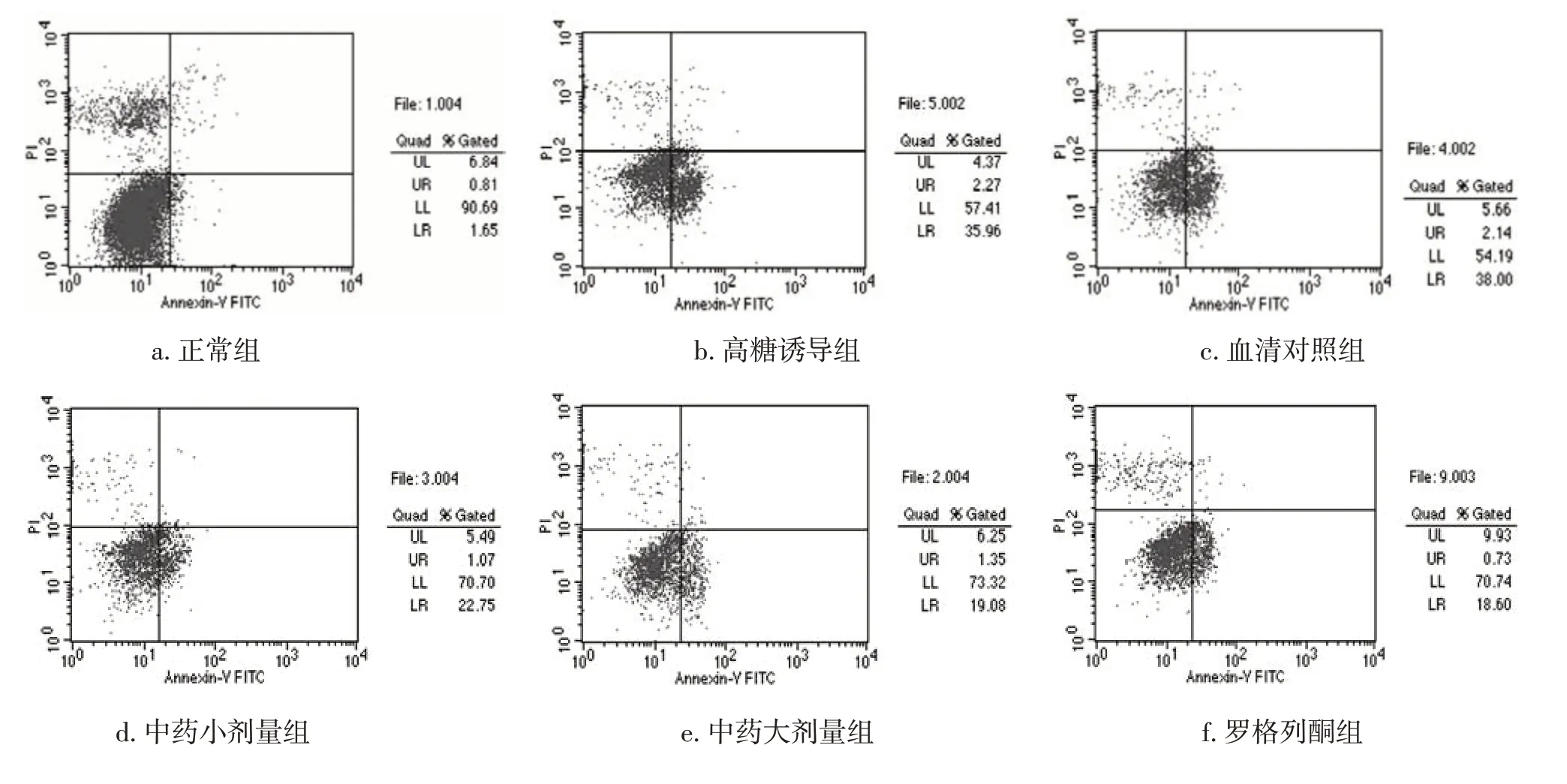
图1 各组INS-1细胞凋亡的流式细胞图Figure 1 The flow cytometry plot for the apoptosis of INS-1 cells in various groups
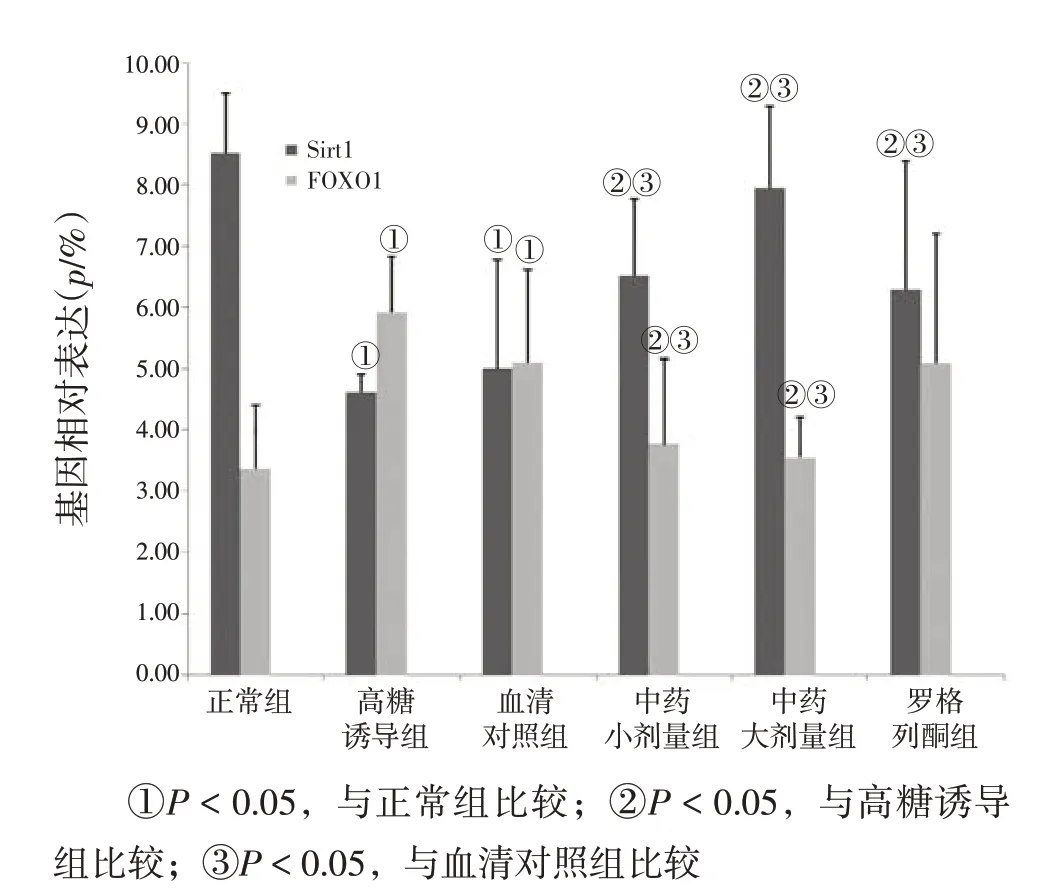
图2 各组INS-1细胞Sirt1、FOXO1 mRNA表达的比较Figure 2 Comparison of the mRNA expression levels of Sirt1 and FOXO1 in various groups(s,n=3)
2.2各组INS-1细胞Sirt1、FOXO1 mRNA表达的比较图2结果显示:与正常组比较,高糖诱导组和血清对照组INS-1细胞Sirt1 mRNA表达水平显著降低(P<0.05),FOXO1 mRNA表达水平显著升高(P<0.05);与高糖诱导组和血清对照组比较,中药大、小剂量组INS-1细胞Sirt1 mRNA表达水平显著升高(P<0.05),FOXO1 mRNA表达水平显著降低(P<0.05),罗格列酮组INS-1细胞仅Sirt1 mRNA表达水平显著升高(P<0.05)。提示开郁清热方可抑制胰岛β细胞凋亡,其机制可能与升高胰岛β细胞Sirt1 mRNA表达,降低FOXO1 mRNA表达有关。
2.3各组INS-1细胞Bax、Bcl-2、p53蛋白表达的比较表2、图3~5结果显示:与正常组比较,高糖诱导组和血清对照组INS-1细胞Bax、p53蛋白表达水平显著升高(P<0.05),Bcl-2蛋白表达水平显著降低(P<0.05);与高糖诱导组和血清对照组比较,中药大剂量组、罗格列酮组INS-1细胞Bax蛋白表达水平显著降低(P<0.05),Bcl-2蛋白表达水平显著升高(P<0.05)。虽然与高糖诱导组比较,中药大剂量组及罗格列酮组p53蛋白表达水平无明显差异(P>0.05),但这2组p53较血清对照组显著降低(P<0.05)。表明大鼠血清可影响INS-1细胞p53的表达,大剂量开郁清热方及罗格列酮对p53有一定的降低作用。提示开郁清热方可抑制INS-1细胞凋亡,其机制可能与升高INS-1细胞Bcl-2蛋白表达,降低Bax、p53蛋白表达有关。
表2 各组INS-1细胞Bax、Bcl-2、p53蛋白表达的比较Table 2 Comparison of the protein expression levels of Bax,Bcl-2 and p53 in various groups(s,n=3)
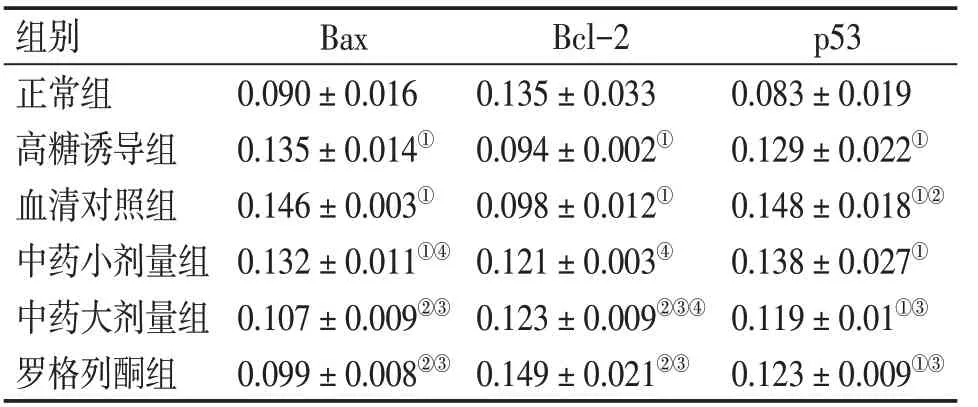
表2 各组INS-1细胞Bax、Bcl-2、p53蛋白表达的比较Table 2 Comparison of the protein expression levels of Bax,Bcl-2 and p53 in various groups(s,n=3)
①P<0.05,与正常组比较;②P<0.05,与高糖诱导组比较;③P<0.05,与血清对照组比较;④P<0.05,与罗格列酮组比较
p53 0.083±0.019 0.129±0.022①0.148±0.018①②0.138±0.027①0.119±0.01①③0.123±0.009①③组别正常组高糖诱导组血清对照组中药小剂量组中药大剂量组罗格列酮组Bax 0.090±0.016 0.135±0.014①0.146±0.003①0.132±0.011①④0.107±0.009②③0.099±0.008②③Bcl-2 0.135±0.033 0.094±0.002①0.098±0.012①0.121±0.003④0.123±0.009②③④0.149±0.021②③

图3 各组INS-1细胞Bax蛋白表达的比较(免疫组化法,×400)Figure 3 Comparison of the protein expression of Bax in INS-1 cells of various groups(by immunohistochemistry,×400)

图4 各组INS-1细胞Bcl-2蛋白表达的比较(免疫组化法,×400)Figure 4 Comparison of the protein expression of Bcl-2 in INS-1 cells of various groups(by immunohistochemistry,×400)

图5 各组INS-1细胞p53蛋白表达的比较(免疫组化法,×400)Figure 5 Comparison of the protein expression of p53 in INS-1 cells of various groups(by immunohistochemistry,×400)
3 讨论
3.1开郁清热方对胰岛β细胞凋亡的作用近年来,糖尿病患者日趋增多,且随着糖尿病患者病程的持续,其胰岛β细胞数量逐渐减少,胰岛β细胞功能呈进行性下降。细胞凋亡是胰岛β细胞数量减少的最终形式,而胰岛β细胞衰竭所致的胰岛素分泌不足是血糖升高的主要原因。目前,针对胰岛β细胞凋亡的防治手段非常有限,因此有必要开发对胰岛β细胞具有保护作用的药物[4]。开郁清热方是仝小林教授在“脾疸”理论指导下研发的治疗2型糖尿病(肝胃郁热证)的中药方剂,有开郁清胃、滋阴降火、通腑泻浊的功效。课题组前期研究结果表明,开郁清热方(糖敏灵)可有效地控制初治、超体质量2型糖尿病患者的糖化血红蛋白,达标率大于50.0%,明显高于安慰剂组。开郁清热方(糖敏灵)可明显降低空腹血糖、餐后2 h血糖,血糖实测值、达标率均明显高于安慰剂[5]。
本研究选取被广泛用于研究β细胞生长及存活因子的胰岛β细胞系,进行高糖培养以诱导胰岛细胞功能损伤模型[6,7],通过含药血清干预进一步探讨开郁清热方对INS-1细胞凋亡的防治作用。结果显示,开郁清热方大剂量组及罗格列酮组均能有效降低高糖诱导的INS-1细胞凋亡率,且2组作用效果近似。表明经大剂量开郁清热方处理后可有效保护胰岛β细胞细胞,减低胰岛β细胞凋亡。
3.2开郁清热方对INS-1细胞Sirt1、FOXO1的调节作用Sirt基因家族主要通过参与染色质沉默以及能量代谢而调节细胞的衰老过程。其中Sirt1编码的蛋白为核蛋白,是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD)的脱乙酰酶,有研究证实在不同组织中Sirt1发挥着促进脂肪动员[8]、降低转化生长因子β诱导的凋亡[9]、抑制增殖[10]、增加胰岛素分泌[11]等作用。FOXO1是叉头转录因子O家族成员之一,受Sirt1调节。Yang等[12]研究揭示,在细胞核内Sirt1蛋白可结合并去乙酰化FOXO1。在哺乳动物细胞中,Sirt1通过在叉头DNA结合区内将3个赖氨酸残基脱乙酰化来调节FOXO1的活性[13]。活化的FOXO1进一步影响Bax、Bcl-2、p53等,从而影响INS-1细胞的凋亡。
本研究结果表明,开郁清热方可能通过有效升高INS-1细胞Sirt1 mRNA表达,降低FOXO1 mRNA表达,从而调控相关信号通路影响胰岛β细胞的凋亡。
3.3开郁清热方对INS-1细胞Bcl-2、Bax、p53的调节作用Bcl-2与Bax共属于一个家族,通过控制线粒体膜的通透性来调节凋亡激活物如细胞色素C的释放来影响细胞的状态。Bax二聚体在膜上打开通道,增加通透性;Bcl-2与Bax形成异聚体,降低通透性。故Bcl-2水平的升高和Bax的降低表明细胞对凋亡的抵抗性增强,可看作是保护药物起作用的标志;而反之则相反[14]。有研究表明,Bcl-2可阻止凋亡形成因子如细胞色素C等从线粒体释放出来,具有抗凋亡作用,而Bax可与线粒体上的电压依赖性离子通道相互作用,介导细胞色素C的释放,具有促凋亡作用,p53可上调Bax的表达以及下调Bcl-2的表达共同完成促进细胞凋亡的作用[15]。
本研究结果表明,大剂量开郁清热方可有效升高Bcl-2蛋白表达,降低Bax、p53蛋白表达,从而抑制胰岛β细胞的凋亡过程,增加细胞数量,促进胰岛素的分泌。另外,在研究过程中,因Sirt1和Akt蛋白表达较低未能测出,故仅提供PCR研究结果。
