基于传统分离培养和高通量测序分析市售咸鳓鱼中微生物多样性
2019-11-14毛海萍袁开金仁耀冯俊丽戴志远吴佳佳
毛海萍,袁开,金仁耀,3,冯俊丽,3,戴志远,3,吴佳佳,3,*
(1.浙江工商大学海洋食品研究院,浙江杭州310012;2.中国计量大学生命科学学院,浙江杭州310018;3.浙江省水产品加工技术研究联合重点实验室,浙江杭州310012)
咸鳓鱼是浙东地区的传统腌鱼制品,因其肉质鲜美且具独特的“霉”香味而备受当地居民的喜爱。其加工是以新鲜鳓鱼为原料,不去除鱼鳞、鱼鳃及内脏,经3 次加盐腌制而成,加盐量通常在30%~50%。腌鱼生产过程实质上是一个复杂微生态体系在人为控制盐度、发酵温度、湿度条件下,使微生物群落结构及功能趋于人们期望的方向演化的过程。来自鱼体的内源酶加之微生物分泌的各类外源蛋白酶、脂肪酶等将鱼体内大分子逐级降解,形成了腌鱼产品独特的风味[1-2]。与此同时,腌制水产品中的生物胺的积累也主要是由微生物引起的游离氨基酸脱羧而产生[3]。复杂的微生物活动与生化反应既决定了产品的风味品质,同时也直接影响着产品的安全[4]。明确咸鳓鱼产品中微生物群落构成对揭示其风味形成机理和评价产品安全性都有重要意义。
研究人员基于传统分离培养方法发现,乳酸菌是许多低盐腌制发酵水产品中的优势菌;葡萄球菌则在高盐腌制水产品中是优势菌;在添加大米等淀粉质原料或其他辅料的发酵鱼生产中,芽孢杆菌、酵母菌或霉菌也可能成为数量较多的优势菌[5-6]。例如,Dai 等[7]从臭鳜鱼中分离到61 株乳酸菌,其中清酒乳杆菌(Lactobacillus sakei)是优势菌株。Guan 等[8]发现韩国传统发酵水产品Saeu-jeot 中葡萄球菌是优势菌。Zhang等[9]对高盐腌制大黄鱼中微生物进行分离鉴定发现,葡萄球菌是其发酵过程中的优势菌。酸鱼发酵过程中,植物乳杆菌、戊糖片球菌、木糖葡萄球菌、酿酒酵母是重要的优势菌[10]。
然而,基于分离培养的研究技术对不可培养菌及苛求菌的探究存在较大的局限性,免培养的高通量测序技术恰能弥补这一缺陷、更加全面地揭示腌制水产品中微生物的群落结构。Roh 等[11]借助条形码焦磷酸测序技术发现海产品腌制过程中,微生物多样性和复杂性远远超出预期,嗜盐古生菌和泉古门细菌等古细菌,魏斯氏菌、乳杆菌等厚壁菌门细菌、γ-变形菌纲及-变形菌纲细菌是高盐腌制海洋发酵水产品中的优势微生物。Song[12]基于16S rDNA V1/V2 可变区测序,对不同原料生产的韩国腌制水产品jeotgal 中的微生物群落结构分析发现,厚壁菌门细菌占据比例高达67.7%,其余则以变形菌门细菌为主。在以鳀鱼为原料腌制的 jeotgal 中嗜盐四链球菌(Tetragenococcus halophilus)和盐水四联球菌(T.muriaticus)是优势微生物;弯曲乳杆菌(Lactobacillus sakei)和高丽魏斯氏菌(Weissella koreensis)则是以海鞘为原料腌制jeotgal 中的优势菌。随着测序技术成本降低,高通量测序已在干酪、泡菜、豆酱等多种传统发酵食品微生物群落研究中得到应用。
本研究基于分离培养技术,对市售咸鳓鱼中可培养微生物进行分离鉴定,并评估可培养微生物产生物胺基因及抗生素抗性基因携带情况。同时,采用Illu mina MiSeq 平台对不同来源市售咸鳓鱼细菌16S rDNA V4 可变区进行高通量测序,以期更加全面地揭示咸鳓鱼产品中微生物多样性及菌相结构。研究结果将对科学评价自然发酵咸鳓鱼发酵微生物安全性、进一步揭示发酵微生物对产品风味形成的贡献有重要意义。
1 材料与方法
1.1 材料与试剂
咸鳓鱼:购于舟山、宁波、杭州萧山水产品批发市场,各采集2 种样品,依次编号为A(腌制 90 d,25 ℃开放腌制)、B(-18 ℃冻藏)、C(室温 22 ℃摊放)、D(室温22 ℃摊放)、E(室温 22 ℃摊放)、F(室温 22 ℃摊放)。除舟山市场采集的A 样品为商贩自制咸鳓鱼外,其余产品均为东南亚进口咸鳓鱼。
2216E 培养基:青岛海博生物技术有限公司;DNA提取试剂盒:北京庄盟生物科技有限公司;E.Z.N.A.Stool DNA Kit、Taq DNA 聚合酶、DL2000 Marker:TaKaRa宝成试剂有限公司。
1.2 主要仪器
超净工作台SW-CJ-1CU、蒸汽压力灭菌锅YXQSG46-280SA:上海博讯实业有限公司;高速冷冻离心机5810R:英国艾本德公司;超微量分光光度计MN-913、高速聚合酶链式反应(polymerase chain reaction,PCR)仪A24811:美国赛默飞世尔公司;凝胶电泳系统Tanon EPS600、凝胶成像系统Tanon 4200:上海天能科技有限公司。
1.3 方法
1.3.1 微生物的计数、分离与鉴定
采集鳓鱼鳃后部、背部及腹部肉,剪碎混匀。同种样品挑选体态大小一致、个体完整的3 尾鱼,将其鱼肉混匀,称取25 g 鱼肉样品至含225 mL 生理盐水的锥形瓶中,震荡混匀后制备梯度稀释液,并涂布于2216E培养基。选择适宜的稀释度进行菌落计数,并随机挑取40 个菌落,纯化2 次~3 次后,接种于相应的液体培养基中,静置培养24 h~48 h,制备30 %的甘油菌液,-80 ℃冻藏备用。
取2216E 肉汤活化好的菌液2 mL,按照试剂盒说明书操作,提取菌株基因组DNA。参考袁开等[13]方法,对分离菌株16S rDNA 序列进行扩增,扩增产物测序工作由南京金斯瑞生物科技有限公司完成,基因序列于GenBank 中进行BLAST 比对分析,部分序列结果提交至NCBI Genebank 数据库。
1.3.2 氨基酸脱羧酶基因扩增
以分离菌株基因组DNA 为模板,对组氨酸脱羧酶(hdc)基因、鸟氨酸脱羧酶(odc)基因及赖氨酸脱羧酶基因(ldc)进行扩增,引物序列如表1 所示。
扩增体系及条件参考Jaw[14]、De[15]。1%琼脂糖凝胶凝胶电泳检测PCR扩增产物。
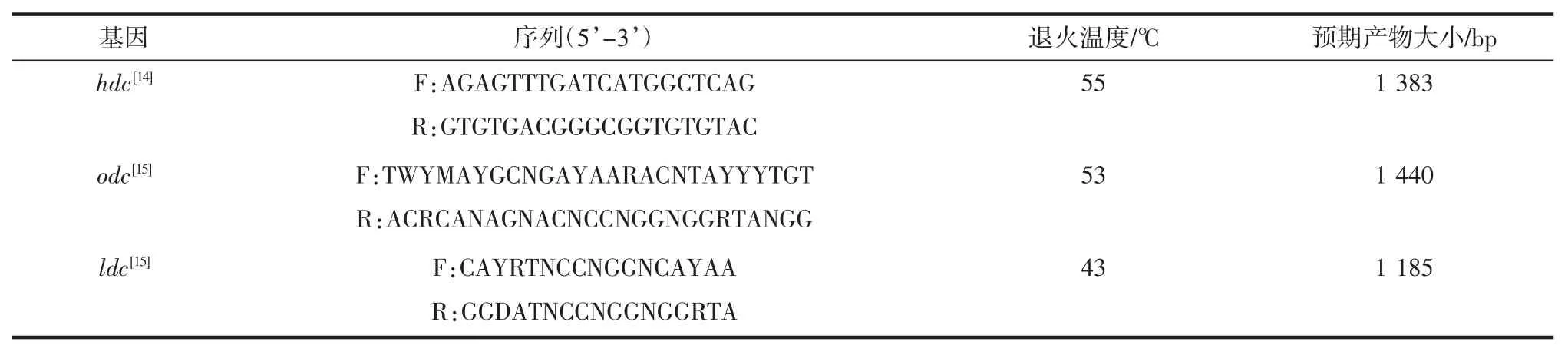
表1 氨基酸脱羧酶基因扩增引物Table 1 Primers of amino acid decarboxylase gene
1.3.3 耐药基因扩增
以分离菌株基因组DNA 为模板,对耐药基因sul1、gryA、tetA 及 int1 进行扩增,引物序列见表2。
扩增体系及条件参考袁开等[13]。1%琼脂糖凝胶凝胶电泳检测PCR扩增产物。
1.3.4 16S rDNAV4 区PCR扩增及高通量测序
称取10 g 混匀的鱼肉样品,加入90 mL 无菌生理盐水,充分震荡均匀后,2 000 r/min,离心10 min,收集上清;10 000 r/min,离心10 min 收集菌体沉淀。

表2 耐药基因扩增引物Table 1 Primers of antibiotic resistance gene
根据barcode 信息对测序获得的双端数据进行拆分;根据双端序列的overlap 关系,将序列拼接(merge)成长的tag,去除barcode 和引物序列,过滤嵌合体,获得clean data。通过操作分类单元(operational taxonomic units,OTU)聚类分析,获得不同样品中OTU 丰度,评估每个样品中微生物的多样性,包括对样品中含有OTU 数目(丰富度)和群落结构的稳定性(均匀度)计算和评估。根据每个OTU 代表序列与16S rRNA数据库(RDP 和NT-16S)比对结果,对OTU 进行物种分类统计,获得不同分类水平物种丰度,讨论市售咸鳓鱼中微生物多样性。
1.4 数据统计与分析
PCR 试验均重复3 次。使用Origin 8.5 软件绘制咸鳓鱼样品中优势菌门水平及属水平柱状图,并用R 语言依据属水平差异对不同样品进行聚类。
2 结果与分析
2.1 咸鳓鱼样品微生物分离及分离菌株16S rDNA测序鉴定
采用2216E 培养基对各样品中可培养微生物进行了计数与分离,咸鳓鱼样品在2216E 培养基上的菌落数量集中分布于4.9 log CFU/100 g~5.2 log CFU/100 g。每组样品随机挑取40 个菌落,经两次纯化后,从A、C、D、E、F 组样品中共分离到151 株可培养菌(B 组样品微生物传代后均未生长)。分离菌株经过提取基因组、扩增获得16S rDNA 序列,测序结果经与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库比对分析,将其鉴定至种、属水平,具体结果见表3。将部分序列提交至Genebank数据库,获取序列编号为MK205156~MK205178。
本研究从咸鳓鱼分离到的微生物,包括14 个属和23 个种,根据NCBI 比对的结果,19 株被鉴定至属水平,其余132 株均被鉴定至种水平,其中150 株为细菌,1 株为放线菌。分离菌株中数量最多的3 种属分别是:芽孢杆菌属,98 株,占比64.90%;其次为葡萄球菌属,20 株,占比 13.25%;嗜冷杆菌属细菌,13 株,占比8.61%。A、D、E、F 组样品中可培养菌群均以芽孢杆菌属菌为主,其中A 组和F 组的芽胞杆菌属占绝对优势,分别占其分离菌株总数的96.30%和97.14%,微生物多样性较之其他组单一;D 组以芽孢杆菌分离菌株为主共18 株,占66.67%,葡萄球菌共5 株,占18.52%;E 组样品中除11 株属于芽孢杆菌外,其余15 株菌隶属于8 个不同的属,微生物种类多样性丰富。C 组样品分离菌株以葡萄球菌属和嗜冷杆菌属细菌为主,两者分别为14 株和12 株,共占该组分离菌株总数的72.22%。
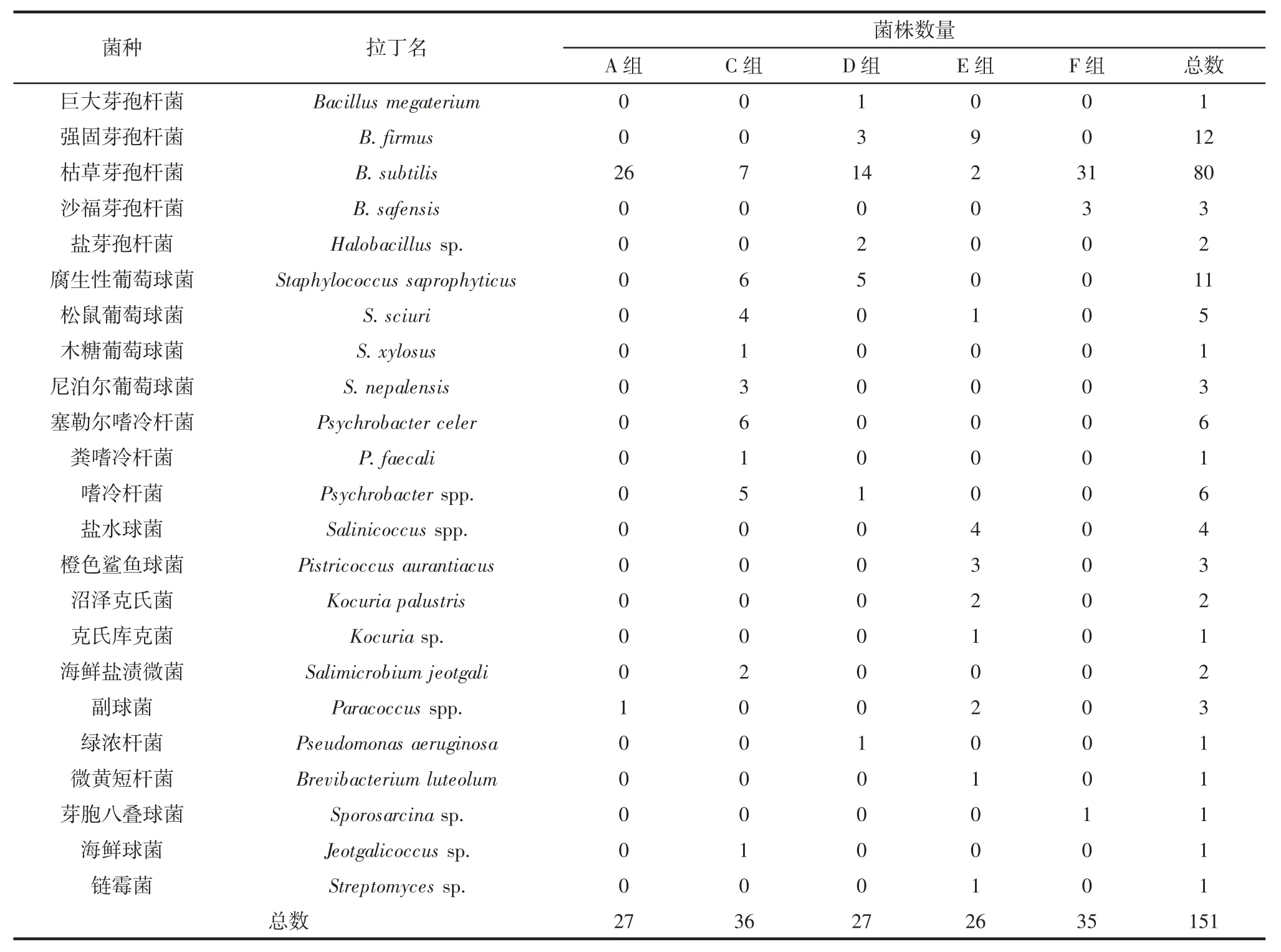
表3 咸鳓鱼可培养细菌分布情况Table 3 Distribution of culturable bacteria in salted Chinese herring
芽孢杆菌属是一类广泛分布在土壤和水圈中的细菌,在海洋环境中有大量分布。市售咸鳓鱼中的芽孢杆菌属细菌,可能来源于鳓鱼自身的生存环境,也可能在加工或保藏中混入。通常情况下,添加米饭等淀粉质原料的发酵鱼制品生产中,芽孢杆菌属细菌会成为优势菌,并且具有较为丰富的多样性[10,19]。在高盐腌制海产品中,枯草芽孢杆菌仅可能少量存在于产品中[8]。A、D、E、F 组样品中,枯草芽孢杆菌数量占据绝对优势。咸鳓鱼加工原料中未加入淀粉质原料,且加盐量达鱼体重的30%~50%,因此,大量的芽孢杆菌可能来源于生产后的贮藏或运输中。
通常情况下,鱼体携带的葡萄球菌数量非常有限,但在腌鱼生产过程中,高盐环境和优质的蛋白质底物成为了葡萄球菌良好的栖息地。本研究从市售咸鳓鱼中共分离出11 株腐生葡萄球菌、1 株木糖葡萄球菌、5 株松鼠葡萄球菌和3 株尼泊尔葡萄球菌。这些凝固酶阴性(coagulase-negative staphylococci,CNS)的葡萄球菌属成员能够代谢产生大量的蛋白酶和脂肪酶,在肉品发酵过程中对产品风味形成起重要作用。其中,马胃葡萄球菌(S.equorum)、木糖葡萄球菌和腐生性葡萄球菌是地中海地区自然发酵香肠中常见优势凝固酶阴性葡萄球菌[20-21]。木糖葡萄球菌也是酸鱼发酵过程中的优势葡萄球菌,许多菌株具备工业化发酵肉制品生产发酵剂的许多特性[19]。
除上述数量较多的种属外,嗜冷菌属、盐水球菌属、橙色鲨鱼球菌、副球菌、微黄短杆菌等栖息于水体环境中的微生物也存在于市售咸鳓鱼中。此外,咸鳓鱼体内还分布有少量的机会致病菌,如克氏库克菌属细菌,以及致病力较低但耐药性强的绿脓杆菌。
2.2 氨基酸脱羧酶基因扩增结果分析
为了更好的评价咸鳓鱼携带微生物的安全性,研究小组分析了分离微生物对与组胺、腐胺和尸胺3 种常见生物胺产生相关的氨基酸脱羧酶基因——组氨酸脱羧酶基因(hdc),鸟氨酸脱羧酶基因(odc)和赖氨酸脱羧酶基因(ldc)的携带情况。
分别对151 株菌进行氨基酸脱羧酶基因扩增,其中,132 株携带组氨酸脱羧酶基因(hdc),70 株菌携带鸟氨酸脱羧酶基因(odc)、68 株携带赖氨酸脱羧酶基因(ldc)。3 种氨基酸脱羧酶基因均获得单一并且与目标条带大小相符的条带,部分结果见图1。5 种咸鳓鱼分离微生物的氨基酸脱羧酶基因分布情况见表4。
图1 部分菌株氨基酸脱羧酶基因扩增结果Fig.1 Amino acid decarboxylase gene amplicons
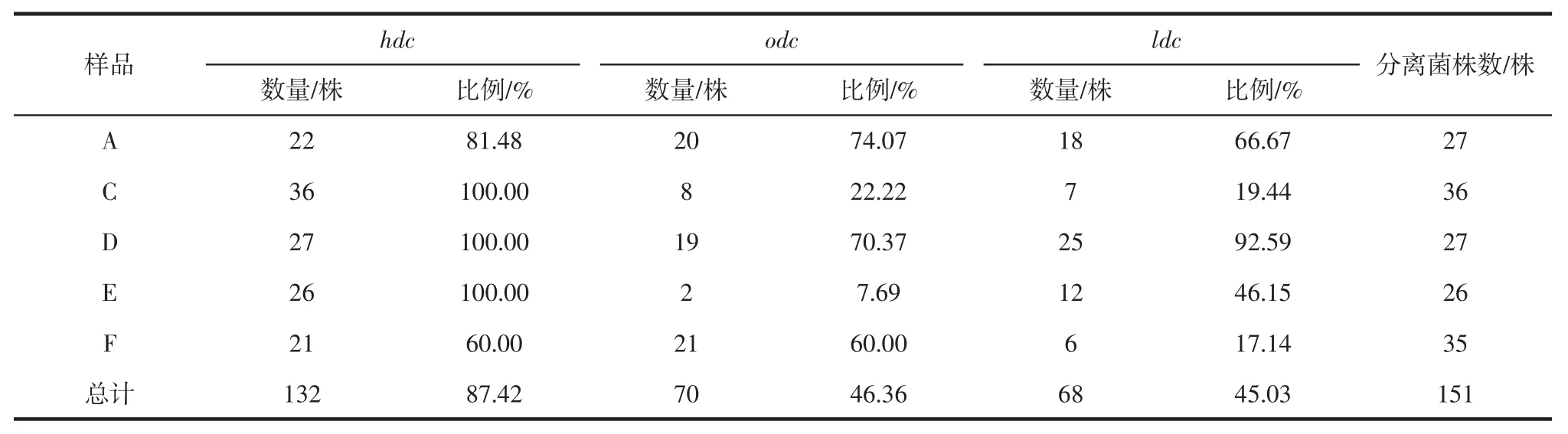
表4 分离菌株氨基酸脱羧酶基因分布情况Table 4 Distribution of amino acid decarboxylase gene in the isolates
咸鳓鱼中132 株分离菌株携带组氨酸脱羧酶基因,占比高达87.42%;鸟氨酸脱羧酶基因和赖氨酸脱羧酶基因的携带菌株量基本一致,占比分别为46.36%和45.03%。氨基酸脱羧酶催化脱去其对应氨基酸上的羧基,生成相应的生物胺。组胺、尸胺和腐胺分别是组氨酸、赖氨酸和鸟氨酸在其相应脱羧酶作用下生成的生物胺,是鱼类腐败过程中常见的几种生物胺,也是发酵鱼制品中容易超标的几种生物胺。其中,组胺是常见生物胺当中毒性最强的一种,当机体摄入组胺超过100 mg/kg 时,即可引起过敏性食物中毒[22]。尽管腐胺,精胺,亚精胺和尸胺对人体健康没有严重的不良影响,但它们可与亚硝酸盐反应形成致癌物亚硝胺;同时,腐胺和尸胺能够通过抑制组胺代谢酶如单胺或二胺氧化酶和组胺甲基转移酶来增强组胺毒性[21]。
尽管细菌基因组中携带氨基酸脱羧酶基因与其表达没有直接的联系,但市售咸鳓鱼分离菌株中较高比例氨基酸脱羧酶基因的存在是其生产或贮藏过程中的一种潜在风险。本研究小组前期对腌制咸鳓鱼过程中产组胺菌进行了分析,发现71.88%发酵菌株具有产生物胺的能力,其携带组氨酸脱羧酶的基因型和产组胺代谢表型基本一致[23]。
2.3 耐药基因扩增结果分析
对分离菌株基因组进行耐药基因(sul1、gryA、tetA及int1)进行扩增,结果显示有18 株菌含有磺胺类耐药基因sul1,16 株菌含有诺氟沙星类耐药基因gryA,未检测到含有四环素类耐药基因tetA 或整合子基因int1 的菌株。咸鳓鱼中可培养微生物的耐药基因分布处于较低的水平。
2.4 16S rDNA V4高通量测序的咸鳓鱼细菌菌群分析
按照97%序列相似度将测序序列聚类成为OTUs,得到每个cluster 的序列百分比及其代表序列(即为OTU),去冗余后,用于统计每个OTU 序列和丰度进行下游分析。根据物种丰度表和物种注释表,选取丰度最高的20 个物种分类进行相对丰度计算,获得相对丰度文件,绘制样品丰度比较的堆叠柱状图。本研究中样品的物种在门和属水平(含量前20)的分类见图2及图3。
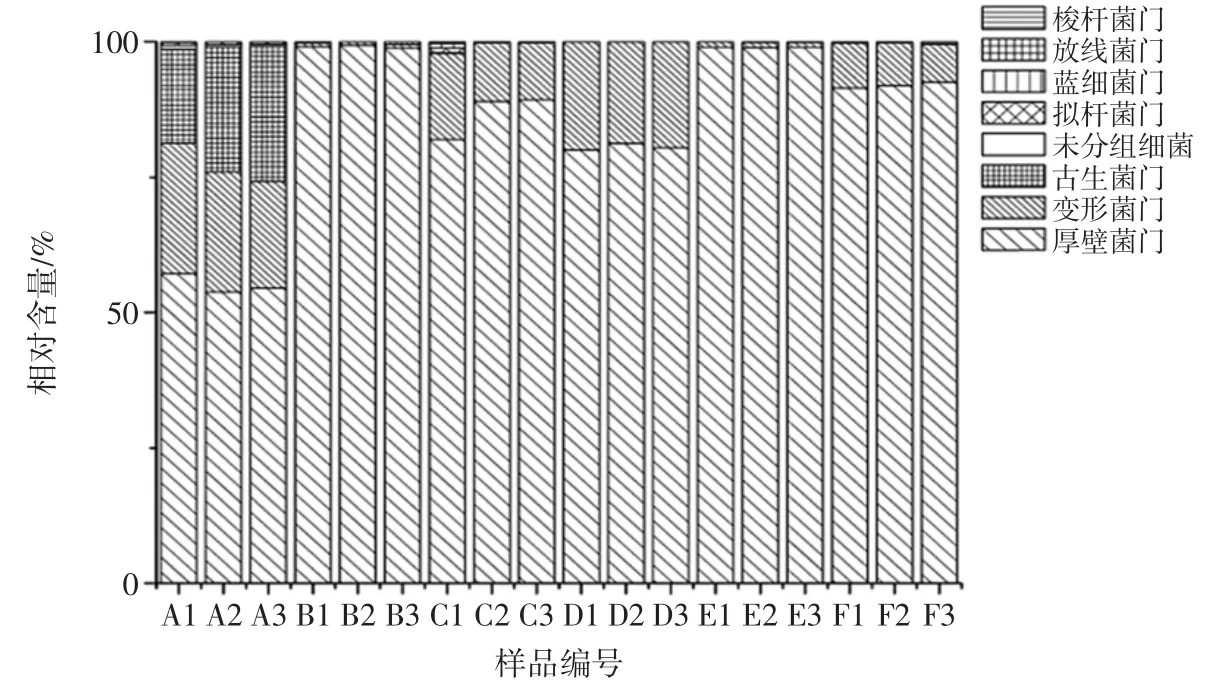
图2 咸鳓鱼微生物门水平样品物种丰度柱状图Fig.2 Relative abundance of bacterial community in salted Chinese herring at the phylum level
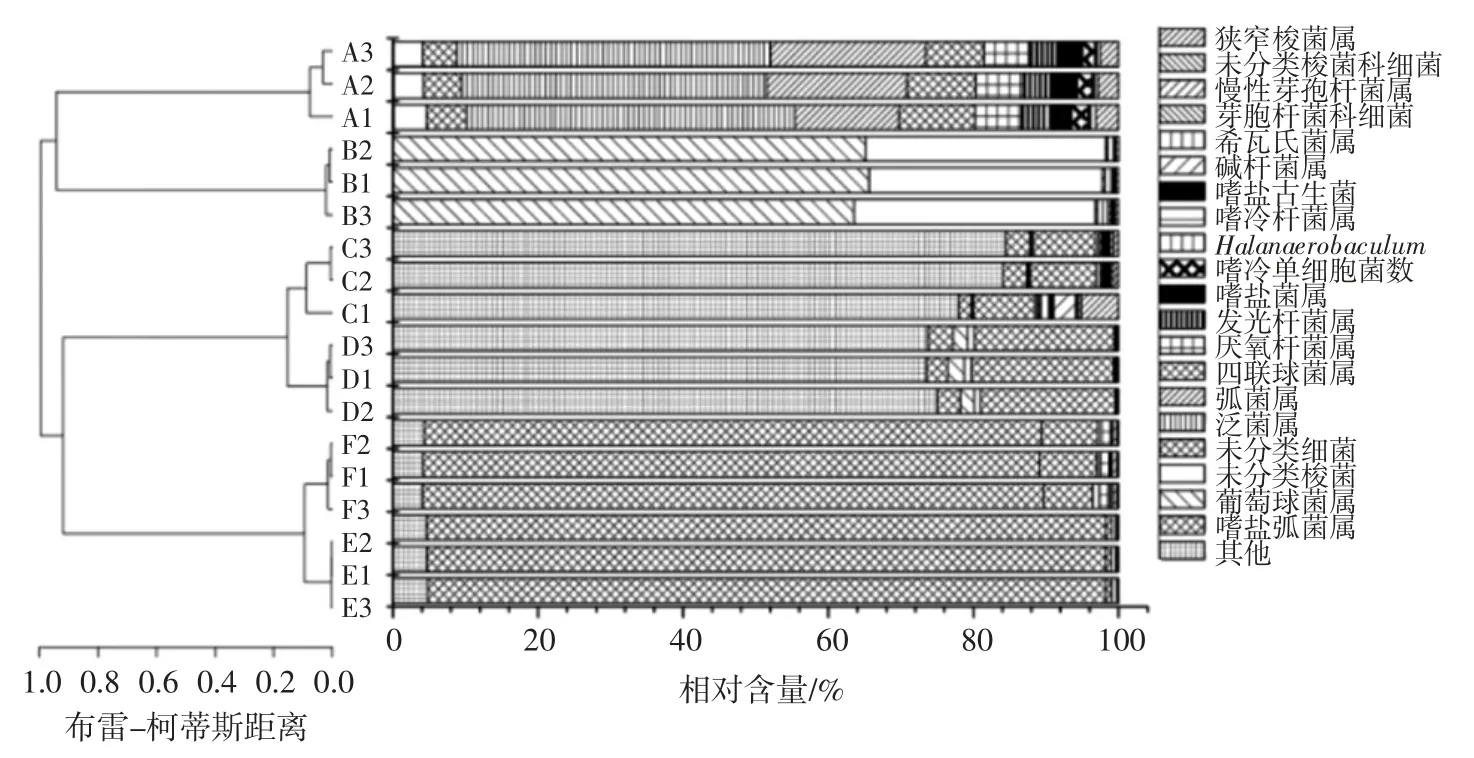
图3 咸鳓鱼微生物属水平样品物种丰度柱状图Fig.3 Relative abundance of bacterial community in salted Chinese herring at the genus level
由图2 可见,在门水平上,厚壁菌门(Firmicutes)是市售咸鳓鱼中主要优势微生物,除样品A 外,其余样品厚壁菌门细菌相对含量均高于75%,而B、E 组样品中,厚壁菌门的相对含量均高达95%以上。变形菌门(Proteobacteria)是厚壁菌门外另一类数量相对较多的微生物,样品C、D、F 组的微生物种类分布较为相似,厚壁菌门微生物在80%~90%之间,变形菌门微生物在10%~20%之间。Park 等[24]用宏基因组测序技术,研究了不同发酵食品中的微生物群落,其中在虾类发酵水产品中,主要微生物群落同样为厚壁菌和变形菌门。
样品A 中微生物虽然同样以厚壁菌门(50.33%)和变形菌门(28%)微生物为主,但该组中还含有比例较高的宽广古细菌门微生物(21.67%),与其他样品组微生物组成存在明显的差异。A 组样品为商家自行腌制90 d 的咸鳓鱼,腌制成熟后于25℃条件下存放,未经长时间的冷冻贮藏,与其他样本本身存在较大的差异。除此以外,少量的拟杆菌门(Bacteroidtes)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)及未分类细菌(Bacteria unclassified)也存在于各类市售咸鳓鱼样品中。
采用Bray-Curtis 比较样品间属水平细菌多样性差异,由图3 可知,各组样品中微生物分布在属水平上差异较大,其中C、D 组样品的微生物分布较为相似,E、F 组样品微生物分布较为相似,A、B 组样品各自呈现出不同的多样性,且与其他样品组差异较大,且样品A 中微生物多样性最为丰富。
A 组样品中主要以碱杆菌属(Alkalibacillus)、嗜盐古生菌(Natrinema)、嗜冷杆菌属(Psychrobacter)、Halanaerobaculum、希瓦氏菌属(Shewanella)及芽孢杆菌科(Bacillaceae unclassified)细菌为主,分别占43.50%、18.36%、9.32%、6.43%和5.19%。除此之外还包括少量的嗜冷单细胞菌属(Psychromonas)、嗜盐菌属(Halobacterium)、发光杆菌属(Photobacterium)及其他菌属。
B 组样品中主要以慢性芽孢杆菌属(Lentibacilus)及未分类芽孢杆菌科细菌(Bacillaceae unclassified)为主,分别占64.73%、32.83%。
C、D 组样品菌相结构相似度较高,聚类分析中能够较好地聚为一类。其微生物菌相组成中均以狭义梭菌属(Clostridium sensu stricto)为主,分别占82.15 %、74.10%;希瓦氏菌属(Shewanella)其次,分别占8.70%和19.12%。梭菌属细菌可以增加发酵食品中的亚硝酸的含量,在蒸煮及未蒸煮的肉制品中,均有发现梭菌属[25],因此其数量在发酵食品中被控制。Diana Di Gioia 等[26]研究发现,从实验室分离的两株乳酸菌均能有效抑制梭菌属菌的生长,其形成的抑菌圈大小为2.5 cm~3.5 cm。因此,在发酵过程中加入一些乳酸菌(益生菌)等菌,是降低咸鳓鱼中梭菌属菌含量的一个比较可行的方案。希瓦氏菌属(Shewanella)是海水鱼类体表栖息的正常菌群,同时也是引起水产品腐败及组胺积累的主要微生物类群[27]。咸鳓鱼中希瓦氏菌的存在可能会引起蛋白质降解、小分子胺类积累,推测其存在与咸鳓鱼中的“霉臭”味的形成有一定关联。
E、F 组样品菌相结构相似度较高,聚类分析中能够较好地聚为一类。未分类梭菌科(Clostridiaceae un classified)微生物数量最多,分别占93.52%和85.21%。狭义梭菌属(Clostridium sensu stricto)分别占4.66%和4.15%。F 样品中希瓦氏菌属(Shewanella)占7.5%。同时,有少量(1.23%)耐盐的四联球菌(Tetragenococcus)检出,该属微生物也是发酵水产品生产中常见微生物[8]。
由上述结果可初步看出,来源相同的样品其微生物菌相构成具有较高的相似性。C、D 样品均来源于宁波水产品批发市场,25 ℃摊放,东南亚进口;E、F 样品则来源于杭州萧山水产品批发市场,25 ℃摊放,东南亚进口。A 组样品为市场销售人员自制咸鳓鱼,腌制时间90 d 左右。B 组为长时间冷冻咸鳓鱼样品,产地不详。A、B 两类样品中的微生物菌相结构与其他样品差异较大。
3 讨论
基于分离培养研究技术从市售咸鳓鱼中获得151株可培养微生物,16S rDNA 序列分析显示,分离菌株可归至14 个属和23 个种。芽孢杆菌属细菌是A、D、E、F 组样品中优势微生物;C 组样品中葡萄球菌为优势菌,嗜冷杆菌和芽孢杆菌数量次之。上述3 个属以外的其他种属细菌在各类样品中均呈零星分布的状态。然而,免培养高通量测序结果在属水平上反映出的微生物种类与分离培养方法不尽相同。Illumina MiSeq 测序结果显示,C、D、E、F 组中狭义梭菌 属(Clostridium sensu stricto)和分类梭菌科(Clostridiaceae unclassified)微生物数量最多是其中的主要优势菌,而A 组样品中碱杆菌属(Alkalibacillus)、嗜盐古生菌(Natrinema)几乎占据了主导地位,B 组样品则以慢性芽孢杆菌属(Lentibacilus)为主。
造成两种方法结果差异较大的原因主要有以下两方面:首先,传统分离培养只能对自然界5%的微生物进行分离培养,同时,每类培养基只能针对有限种类的微生物进行分离,因此,环境或复杂生境样品中大多微生物的信息不能够较为完备的呈现[8]。为了借助纯培养技术更为全面地揭示样品中微生物信息,必须选择多种培养基对样品中可能存在的微生物类群进行分离。其次,由于高通量测序是以样品中全部微生物的基因组为模板进行PCR 和测序分析,因此,一些曾经存在于腌制体系以及储运中后续滋生微生物的信息均能够被呈现出来,但无法据此判断各类微生物的存在时期及其存活情况[2,11]。B 组样品系长期冷冻保藏样品,采用分离培养方法未能成功从其中获得可培养微生物,推测可能是长时间的冷冻保藏后,可培养微生物数量较低,且在本研究实验条件下难于复苏,但基于免培养的高通量测序技术,其中微生物信息仍能够有效被揭示。
分离培养研究方法揭示了市售咸鳓鱼成品中仍存活的微生物种类和数量,这些菌株可能来源于生产过程,也可能源自运输和贮藏环境。尽管,市售咸鳓鱼携带微生物中大多数均为非致病菌,但分离菌株携带与生物胺积累相关的氨基酸酸脱羧酶基因比例较高,组氨酸脱羧酶基因携带率高达87.42%,鸟氨酸脱羧酶基因和赖氨酸脱羧酶基因的检出率也均在45%及以上。从基因水平评估,这可能是成为产品中生物胺积累的潜在因素。因此,市售咸鳓鱼携带微生物的数量应该予以控制,并且对其安全性有待进一步全面评估。
