4种食源性致病菌的多重PCR快速检测方法研究
2019-11-14李聪刘健慧李志辉张敏高浩檀建新
李聪,刘健慧,李志辉,张敏,高浩,檀建新
(河北农业大学食品科技学院,河北保定071000)
近年来,食源性疾病屡见不鲜,其中主要的食源性致病菌有沙门氏菌、金黄色葡萄球菌、志贺氏菌和蜡样芽孢杆菌等,可导致腹泻、呕吐、痢疾等多种疾病,严重者可造成死亡,因此,食品产品中要求不得检出[1]。常规微生物学方法检测食源性致病菌,通常需要经过富集培养、形态观察、生理生化鉴定等的过程,耗时耗力,且主观性强,极易导致样品菌种的流失,出现阴性结果,不能及时的发现并控制潜在的危险[2-3]。目前新型的检测方法荧光定量聚合酶链式反应(realtime polymerase chain reaction,PCR),灵敏度高,但极易因试验操作不当出现假阳性,而且需要专业性强的工作人员和较为昂贵的仪器,用于多重检测有一定难度。
而PCR 检测法可以根据琼脂糖凝胶电泳观察被检的特异性片段长度大小来判断,简单易懂,耗时短。多重PCR 是在普通PCR 的基础上,在同一PCR 体系中加入不同菌种特异性基因的特异性引物,扩增多个模板的不同区域,得到相应的不同片段长度,以此来检测目标菌的有无。因此可利用多重PCR 技术同时检测食品中的多种病原菌,在短时间内同步筛选多组样品。多重PCR 省时省力,成本低,大大提高了工作效率[3]。多重PCR 技术检测食源性致病菌已经被逐渐应用,如闵文光等利用三重PCR 的方法检测志贺菌、副溶血性弧菌和大肠埃希菌O157[4];姜华等利用多重PCR检测婴幼儿配方奶粉中3 种食源性致病菌[5]。本研究选用蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌和沙门氏菌的6 个特异性基因,设计了12 对特异性引物,对其进行筛选,优化多重PCR 反应条件,建立4 种食源性致病菌的多重PCR 快速检测方法。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
蜡样芽孢杆菌(CMCC63302)、金黄色葡萄球菌(CMCC26003)、宋内氏志贺氏菌(CMCC51334)、鼠伤寒沙门氏菌(CMCC50115)、大肠埃希氏菌(CMCC44752)、铜绿假单胞菌(CICC21636)、苏云金芽孢杆菌(CICC22945)、绿脓杆菌(CMCC10110)、阪崎肠杆菌(ATCC51024)、副溶血性弧菌(CICC21617)、变形杆菌(CMCC49027)、单增李斯特菌(CMCC54001),均保存于河北农业大学生物工程实验室。
1.1.2 试剂
营养肉汤培养基:北京陆桥生物技术有限公司;琼脂糖:北京全式金生物公司;agar:索莱宝生物科技有限公司;细菌基因组DNA 提取试剂盒:天根生化科技有限公司;2×Es Taq MasterMix(Dye):康为世纪生物科技有限公司;50 bp DNA Ladder:中科瑞泰生物科技有限公司;ddH2O:河北农业大学生物工程实验室制备。
1.2 仪器与设备
MTH-012 型旋涡混合仪:海门其林贝尔仪器制造有限公司;070-851 型 PCR 仪:德国 Biometra 公司;DYY-10 C 型电泳仪:北京市六一仪器厂;JY04S-3E 型凝胶成像分析系统:北京科普尔科技发展有限公司;UV-1700 型紫外分光光度计:上海优尼科公司;K5500型超微量核酸测量仪:北京凯奥科技发展有限公司。
1.3 方法
1.3.1 菌株的培养
分别挑取蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌、沙门氏菌的单菌落,接种于8 mL 灭菌的营养肉汤培养基,37 ℃摇床180 r/min 过夜培养。
1.3.2 模板的制备及计数
取1 mL 过夜培养菌液,提取基因组DNA 为模板,具体操作方法见细菌基因组DNA 提取试剂盒说明书。用核酸测定仪对DNA 浓度及纯度进行测定。另取1 mL 菌液,10 倍梯度稀释,涂布于固体肉汤培养基中,37 ℃过夜培养,进行平板计数。
1.3.3 引物的设计与合成
针对蜡样芽孢杆菌的gyrB、nheA 基因[6-7],金黄色色葡萄球菌的nuc、SED、MecA[8-10]基因、志贺氏菌的ipaH 基因[11-13]和沙门氏菌的 ttr、sal、SiiA 基因[14-16],共设计了11 套引物,引物由上海生工公司合成,引物序列及扩增片段长度等见表1。
1.3.4 引物的筛选和确定
以表1 中的11 对引物分别对4 种目的菌进行扩增,单一PCR 反应体系为:2×Es Taq Master Mix(Dye)5 μL、20 μmol/L 上下游引物各 0.2 μL,DNA 模板0.8 μL,加 ddH2O 补足到 10 μL。单一 PCR 反应程序为:94 ℃预变性5 min,94 ℃变性30 s,梯度设置退火温度,退火 30 s,72 ℃ 延伸 30 s,72 ℃再延伸 7 min,反应30 个循环。对PCR 产物进行凝胶电泳分析,选择扩增条带单一且大小不同、退火温度相似的引物,确定为多重PCR 引物组。
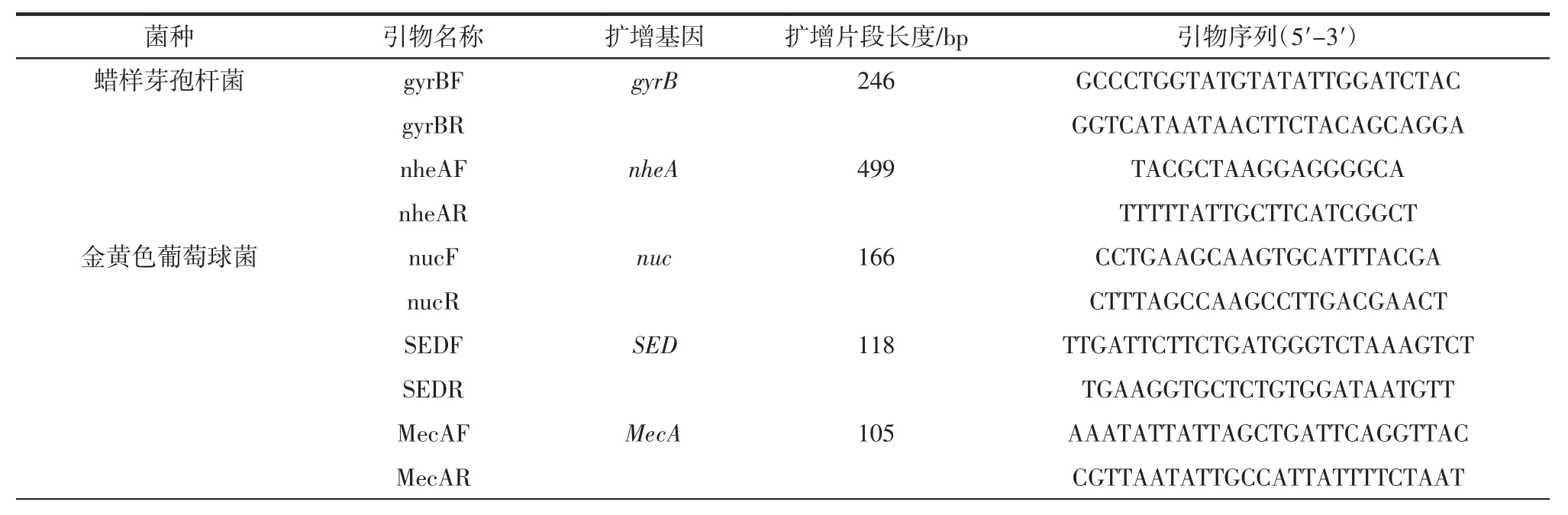
表1 引物序列Table 1 Primer sequence

续表1 引物序列Continue table 1 Primer sequence
1.3.5 多重PCR 退火温度的确定
用筛选得到的引物组,进行多重PCR 扩增。多重PCR 反应体系为:2×Es Taq Master Mix(Dye)5 μL,20 μmol/L 上下游引物各 0.2 μL,DNA 模板各 0.8 μL,加 ddH2O 补足到 10 μL。多重 PCR 反应程序为:94 ℃预变性5 min,94℃变性30 s,梯度设置退火温度,退火30 s,72 ℃ 延伸 30 s,72 ℃再延伸 7 min,反应 30 个循环,对PCR 产物进行凝胶电泳分析,选择条带清晰的退火温度,确定为多重PCR 退火温度。
1.3.6 多重PCR 引物浓度的确定
在多重PCR 体系中,同时加入蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌和沙门氏菌4 种目标菌的引物,其起始引物浓度均为20 μmol/L,按照表2[17]对PCR产物进行凝胶电泳分析,确定最佳引物加入量。

表2 引物的加入量Table 2 The addition amount of each pair of primer
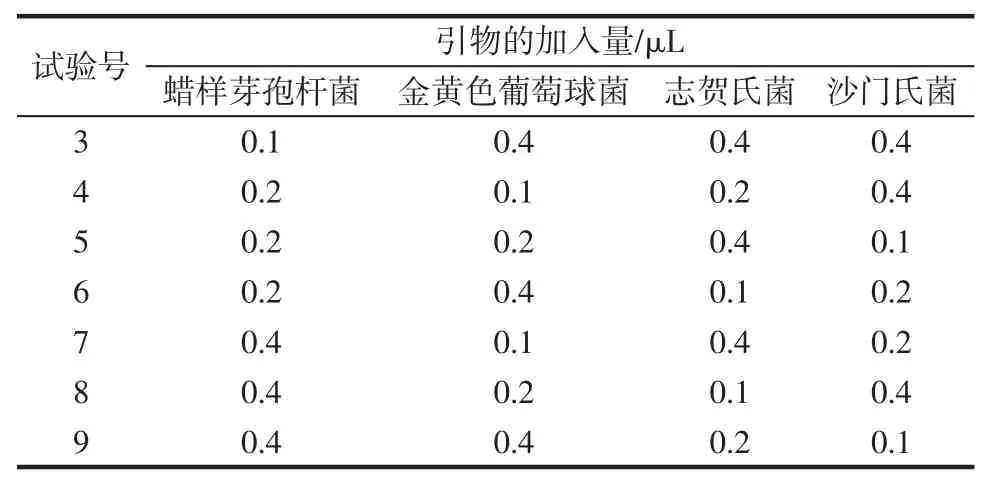
续表2 引物的加入量Continue table 2 The addition amount of each pair of primer
1.3.7 多重PCR 特异性的鉴定
为验证引物组的特异性,以筛选出的引物分别对蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌、沙门氏菌以及其他8 株非目的菌进行扩增(包括大肠埃希氏菌、单增李斯特菌、阪崎肠杆菌、副溶血性弧菌、绿脓杆菌、铜绿假单胞菌、变形杆菌、苏云金芽孢杆菌)进行PCR扩增,反应体系与程序同单重PCR,并对PCR 产物进行琼脂糖凝胶电泳分析。
1.3.8 多重PCR 灵敏度的分析
分别对已知浓度的蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌、沙门氏菌基因组DNA,用灭菌的ddH2O 进行10 倍梯度稀释,每个梯度各取0.8 μL 作为多重PCR反应的模板,用本研究建立的多重PCR 反应体系进行扩增。琼脂糖凝胶电泳观察PCR 产物,分析其灵敏度。
1.3.9 人工接种牛奶样品多重PCR 灵敏度的验证
取过夜培养的4 种菌液各1 mL,10 倍梯度稀释进行菌落计数,另各取5 mL 接种于30 mL 灭菌的牛奶中,均质后取4 mL 提取基因组DNA,10 倍梯度稀释提取的基因组DNA,作为多重PCR 的模板,凝胶电泳观测条带。
2 结果与分析
2.1 特异性引物的筛选
用表1 中的11 对引物,分别对蜡样芽孢杆菌、金黄色色葡萄球菌、志贺氏菌和沙门氏菌进行扩增。结果如图1~图4 所示。

图1 蜡样芽胞杆菌特异性引物和扩增温度的筛选Fig.1 Screening of the specific primers and annealing temperature of Bacillus cereus

图2 金黄色葡萄球菌特异性引物和扩增温度的筛选Fig.2 Screening of the specific primers and annealing temperature of Staphylococcus aureus

图3 志贺氏菌特异性引物和扩增温度的筛选Fig.3 Screening of the specific primers and annealing temperature of Shigella

图4 沙门氏菌特异性引物和扩增温度的筛选Fig.4 Screening of the specific primers and annealing temperature of Salmonella
由图可知,蜡样芽孢杆菌gyrB 引物对在52.5、55.7 ℃范围内条带明显,片段长246 bp;金黄色葡萄球菌nuc 引物对在52.5 ℃处有单一明亮条带,片段长166 bp;志贺氏菌的ipaHⅠ引物对在52.6 ℃处单一明亮条带,片段长210 bp,ipaH Ⅲ引物对在退火范围内条带单一,片段长65 bp;沙门氏菌SiiA 引物对在梯度退火温度下条带单一明亮,片段长107 bp,退火温度相近且扩增出的片段长度不同,有利于多重PCR 扩增结果的判断,最终选择 gyrB、nuc、ipaHⅢ、SiiA 引物对为多重PCR 反应的引物组。
2.2 多重PCR的退火温度的确定
以筛选所得的引物组,利用多重PCR 反应体系,扩增4 种菌的基因组DNA,因2.1 所选的引物在53 ℃左右有比较清晰的条带,故设置50 ℃~57 ℃为多重PCR 的退火温度梯度,结果见图5。

图5 多重PCR 退火温度的筛选Fig.5 Optimization of annealing temperature of multiplex PCR
如图5 所示,当退火温度在这个范围内间均能得到4 条目的带,且条带区间明显,故证明本研究建立的多重PCR 体系,可特异性扩增出目的条带,且其大小与预期扩增基因片段大小一致,但在53.9 ℃之前条带略暗,退火温度为53.9 ℃时条带更加清晰明亮,因此,选定54 ℃作为多重PCR 的最适退火温度。但多重PCR 扩增的志贺氏菌65 bp 与金黄色葡萄球菌166 bp条带相对暗一些,故对4 组引物对的加入量进行优化。
2.3 多重PCR引物浓度的确定
用每一对引物进行PCR 扩增所得条带都明亮清晰,但当多对引物、多个模板同时在一个体系中时,条带亮度分布不均,故对引物浓度加以优化,结果见图6。
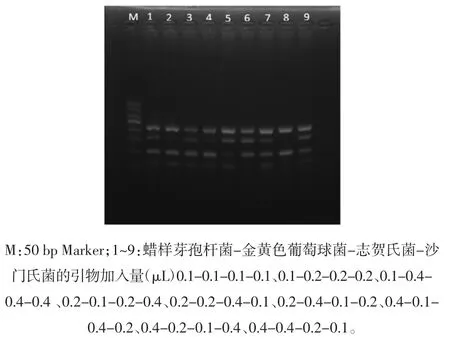
图6 多重PCR 引物加入量的优化Fig.6 Optimization of primer addition of multiplex PCR
如图6 所示,在第5 泳道,4 条目的条带清晰明亮,且分布均匀,即蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌和沙门氏菌的引物分别加入 0.2、0.2、0.4、0.1 μL。
2.4 多重PCR体系的特异性分析
蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌、沙门氏菌以及其他8 株非目的菌(包括大肠埃希氏菌、铜绿假单胞菌、苏云金芽孢杆菌、绿脓杆菌、阪崎肠杆菌、副溶血性弧菌、变形杆菌、单增李斯特菌)为模板进行扩增,均未见条带出现,故验证多重PCR 引物组有一定的特异性,能够进行4 种目标菌的特异性分析。具体结果结果图7。

图7 多重PCR 特异性分析Fig.7 Specificity analysis of the multiplex PCR method
2.5 多重PCR灵敏度的鉴定
测得1mL 蜡样芽孢杆菌的核酸浓度为52.649ng/μL,对应菌落浓度为1.5×107CFU/mL;1mL 金黄色葡萄球菌的核酸浓度为14.245 ng/μL,对应菌落浓度为108CFU/mL;1 mL 志贺氏菌的核酸浓度为357.78 ng/μL,对应菌落浓度为108 CFU/mL;1 mL 沙门氏菌的核酸浓度为108.32 ng/μL,对应菌落浓度为 1.05×108CFU/mL。用ddH2O 10 倍梯度稀释提取的DNA 模板,取0.8 μL 进行多重PCR,测定其检出限,结果见图8。

图8 多重PCR 的灵敏度Fig.8 Sensitivity of multiplex PCR
如图8 所示,在第5 泳道仍可见清晰条带。最终得出多重PCR 对蜡样芽孢杆菌的核酸浓度检出限为4.21 pg,对应菌落浓度为2×101CFU/mL;金黄色葡萄球菌的核酸浓度检出限为1.14 pg,对应菌落浓度检出限为1.3×102CFU/mL;志贺氏菌的核酸浓度检出限为28.62 pg,对应菌落浓度为1.3×102CFU/mL;沙门氏菌的核酸浓度检出限为8.67 pg,对应菌落浓度为1.4×102CFU/mL。
2.6 多重PCR在牛奶中灵敏度的鉴定
取4 mL 牛奶提取基因组DNA,其核酸浓度为493.62 ng/μL,10 倍梯度稀释 DNA,各取 3.2 μL 为模板进行多重PCR 扩增,结果见图9。
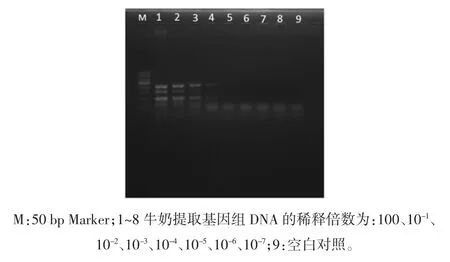
图9 牛奶中多重PCR 的灵敏度Fig.9 Sensitivity of multiplex PCR for analysis of milk
如图9 所示,扩增的目的条带分区明显,在第4 泳道有清晰条带。可得在牛奶中4 种菌的检出限分别是:蜡样芽孢杆菌2.35×102CFU/mL、金黄色葡萄球菌 3.72×103CFU/mL、志贺氏菌 4.2×103CFU/mL、沙门氏菌3.25×103CFU/mL。灵敏度相比于纯菌的检出限要低,可能是受牛奶中蛋白的影响,降低了基因组DNA 的提取效率。
3 讨论
目前,普通PCR 技术在食品检测、疾控检测中,已经相当成熟,相对于传统的生化特性检测,有着快速、特异、灵敏度高的特点。在简单的PCR 基础上,多重PCR 融合了普通PCR 方便、快捷的优点,加入多个引物对,可进行多个菌种多个样品的快速分析[18],简单易操作,无需昂贵的仪器和专业的实验人员,也可进行准确的分析,为快速发展的食品检测行业,提供了很好的理论和技术基础[19]。由于多重PCR 是在同一反应下进行的,节约成本,因此相对于常规的单重PCR来说,大大缩短的检测时间,提高了检测效率[20-21]。食品检测的快速发展,多重PCR 方法以其特异性强、灵敏度高等优点被广泛应用于食源性致病菌的快速检测中[22]。
本试验以蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌、沙门氏菌为研究对象,探讨应用多重PCR 检测食品中的致病菌。首先筛选退火温度相似,扩增片段区间不同的引物,最终得到适合多重PCR 的gyrB、nuc、ipaH III、SiiA4 个引物对,且特异性强。当蜡样芽孢杆菌、金黄色葡萄球菌、志贺氏菌和沙门氏菌的引物(初始浓度均为 20 μmol/mL)分别加入 0.2、0.2、0.4、0.1 μL,退火温度为54 ℃时,扩增条带更为明显,作为多重PCR 的最适扩增条件。人工污染牛奶,仍可见清晰条带,故应用于食品中的致病菌检测是可行的。综上,本研究建立的多重PCR 反应系统具有良好的特异性和灵敏性,为食品中常见食源性致病菌的检测提供试验依据和技术方法。
