水通道蛋白1和肿瘤坏死因子受体相关蛋白1在人脑胶质瘤中的表达及相关性*
2019-11-14卢家潮寿记新王冰冰高海东
卢家潮,寿记新,王冰冰,高海东
(郑州大学第五附属医院 神经外科,河南 郑州 450052)
脑胶质瘤又称胶质细胞瘤或神经胶质瘤,其发病率在中枢神经系统肿瘤中居首位,且其恶性程度也高于其他颅内肿瘤,治疗时间长、过程非常复杂、预后差,对人类生命健康造成巨大危害[1]。水通道蛋白1(Aquaporin-1, AQP1)作为一种镶嵌在细胞膜又极其保守的蛋白,具有自身的跨膜转运功能,转运分子大小为28 kD,基因定位于人染色体7p14[2]。AQP1 主要定位于中枢神经系统脑室脉络丛上皮细胞,发挥维持水通道及离子通道(c-GMP)平衡的双重效应,与脑脊液生成、分泌有关[3]。研究表明[4-5],AQP1 在间变性星形胶质细胞瘤和肿瘤供血血管内皮细胞表达上调,AQP1 mRNA 及蛋白表达随肿瘤恶性程度增加而升高。肿瘤坏死因子受体相关蛋白1(TRAP1)也称HSP75,是线粒体热休克蛋白90(HSP90)的主要成员。稳定的TRAP1 蛋白由645 个氨基酸脱水缩合而成,并且拥有1 个三磷酸腺苷匹配区域,在该区域三磷酸腺苷以独特的构象与γ 磷酸基团进行匹配,从而发挥作用[6]。在胶质瘤,线粒体作为肿瘤细胞的能量代谢中心,TRAP1 的高表达能改变线粒体的某些融合/ 分裂相关蛋白的表达,使肿瘤细胞处于高能量代谢状态[7-8]。国外学者研究分析发现TRAP1 的表达与肿瘤直径的大小、恶性程度的高低及有无转移等密切相关,即肿瘤直径越大、恶性程度越高伴随远处转移者TRAP1 处于高表达状态,同时发现TRAP1 过度表达增加神经胶质瘤患者死亡风险[9]。但AQP1 与TRAP1 在脑胶质瘤的表达水平及其相关性的研究,目前鲜有报道,本文旨在研究两者在脑胶质瘤中的表达及其相关性,为实验及临床治疗提供参考。
1 资料与方法
1.1 临床资料
选取2014年3月—2017年12月在郑州大学第五附属医院神经外科病区的住院患者66 例,根据术前患者临床表现及影像学资料,术后病理切片确诊为脑胶质瘤。全部标本均为第1 次手术切除,且术前从未进行过任何放化疗及免疫疗法等治疗。其中,男性38 例,女性28 例;年龄21~65 岁,平均53.7 岁;根据《WHO 中枢神经系统肿瘤组织学分类》(2007),将66 例患者分为低级别组(Ⅰ、Ⅱ级)(A 组)35 例和高级别组(Ⅲ、Ⅳ级)(B 组)31 例。另采集同期15 例行第三脑室底造瘘术及大脑内减压术患者的正常脑组织作为对照组。所有获取的标本在实验前由家属签署知情同意书并得到本院医学伦理委员会批准。
1.2 主要试剂与仪器
AQP1、TRAP1 抗人单克隆抗体均购自上海优宁维生物科技股份有限公司,SP 试剂盒、DAB 显色剂均购自上海哈灵生物科技有限公司,总RNA 提取试剂购自上海富衡生物科技有限公司。RNA 纯度经微量紫外分光光度计检测,A260/A280 在1.6~1.8 之间,满足实验要求。AQP1、TRAP1、β-actin 基因引物序列由Primer Premier 6.0 软件设计,由生工生物工程(上海)股份有限公司合成。引物序列:AQP1 正向5'-CGGATCCATGGCCAGCGAGTTCAAGAAG-3',反向5'-GCTCTAGATTTGGGCTTCATCTCCACCCTG- 3';TRAP1 正向5'-TTAGTAACATATGGCGCGCGAGCT GCGG-3',反向5'-TTCCTCGAGTTAGTGTCGCTCCAGG GCCTT-3';β-actin 正向5'-CGAGCTGGACATCCG CAAAT-3',反向5'-GTGGCAGGTGGACAGCGAGC-3。
1.3 逆转录聚合酶链反应(RT-PCR)检测AQP-1 与TRAP1 mRNA 的表达
cDNA 4μl,dNTP Mixture(2mmol/L)20μl,引物(10 μmol/L) 各2μl,10×Taq Buffer 5μl,Taq 酶1.5μl,dH2O 30.5μl,总容量65μl。AQP1:95℃预变性3min,92℃变性35 s,57.5℃退火30s,70℃延伸4min,共35 个循环,70℃最后延伸14min。TRAP1 反应条件:94℃预变性3min,95℃变性40s,56.8℃退火33s,72℃延伸8min,共35 个循环,72℃最后延伸12min。将RT-PCR 反应产物与1.5%的琼脂糖凝胶电泳,电压稳定在85V 电泳约52min,接着对电泳结果进行拍照保存,再经美国Eagle EYE Ⅱ型凝胶图像软件处理系统,用(目的基因的吸光度值)/(β-actin 吸光度值)代表目的基因的相对表达含量。
1.4 Western blotting 检测AQP-1 与TRAP1 蛋白的表达
提取少量组织标本尽量碾碎后放进预冷的含1% PMSF 的RIPA 裂解液,按每孔约80μl 加入6 孔板,放置冰上50min 后吸取裂解液,温度4℃下将裂解液以14000r/min 离心35min 后取上清液,BCA 蛋白检测方法进行蛋白定量。AQP1、TRAP1 分别于10%及7% SDS-PAGE 分离,采用半干湿法转至PVDF,常温下用8%的脱脂牛奶隔离1h,分别加入一抗:小鼠抗人AQP1、TRAP1 抗体(Abcam 公司),工作浓度均为1:1000。二抗:HRP 结合的抗小鼠IgG 抗体(Zymed Laboratories Inc, 美国),工作浓度1:2000。ECL 化学 发光转至X 射线胶片。采用美国Eagle EYE Ⅱ型凝胶图像软件处理系统测定目标蛋白和标准对照的吸光度,并以(目标蛋白吸光度值)/(标准对照吸光度值)作为目标蛋白半定量相对值。
1.5 统计学方法
数据分析采用SPSS 21.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析,进一步两两比较用LSD-t检验,相关性采用Spearman 相关分析,P<0.05 为差异有统计学意义。
2 结果
2.1 3 组AQP1 mRNA 及蛋白的表达情况
3 组AQP1 mRNA 及蛋白表达的比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,A 组、B 组AQP1 mRNA 和蛋白表达较对照组上调(P<0.05),B 组AQP1 mRNA 和蛋白表达较A 组上调(P<0.05)。见表1和图1、2。
2.2 3 组TRAP1 mRNA 及蛋白的表达情况
3 组TRAP1 mRNA 及蛋白表达的比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,A组、B组TRAP1 mRNA和蛋白表达较对照组上调(P<0.05),B 组TRAP1 mRNA 和蛋白表达较A 组上调(P<0.05)。见表2和图3、4。
表1 各组AQP1 mRNA 及蛋白表达的比较 (±s)
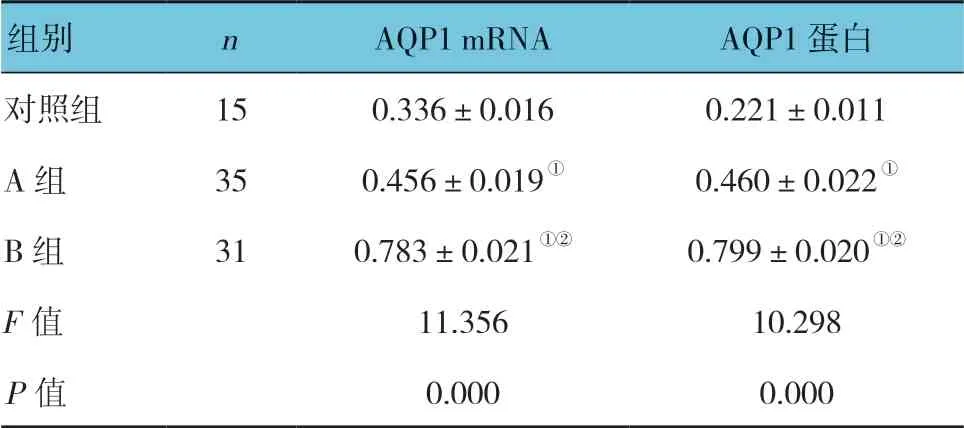
表1 各组AQP1 mRNA 及蛋白表达的比较 (±s)
注:①与对照组比较,P <0.05;②与A 组比较,P <0.05。
组别 n AQP1 mRNA AQP1 蛋白对照组 15 0.336±0.016 0.221±0.011 A 组 35 0.456±0.019① 0.460±0.022①B 组 31 0.783±0.021①② 0.799±0.020①②F 值 11.356 10.298 P 值 0.000 0.000
图1 AQP1 mRNA 表达

图2 AQP1 蛋白表达
2.3 AQP1 与TRAP1 表达的相关性
随着AQP1 mRNA 及蛋白表达的增多,TRAP1表达也有逐渐增多的倾向,Spearman 相关分析显示AQP1 mRNA 及蛋白表达和TRAP1 mRNA 及蛋白表达无相关性(rs=0.074 和0.058,P=0.065 和0.080)。
表2 3 组TRAP1 mRNA 及蛋白表达的比较 (±s)
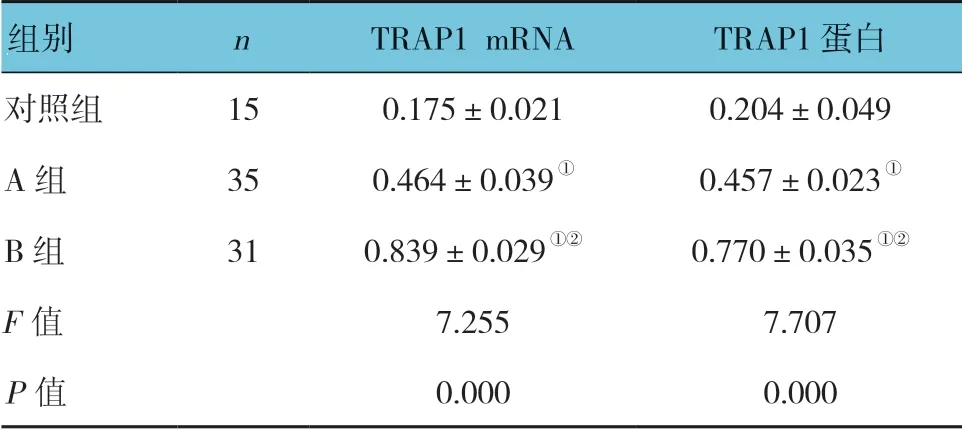
表2 3 组TRAP1 mRNA 及蛋白表达的比较 (±s)
注:①与对照组比较,P <0.05;②与A 组比较,P <0.05。
组别 n TRAP1 mRNA TRAP1 蛋白对照组 15 0.175±0.021 0.204±0.049 A 组 35 0.464±0.039① 0.457±0.023①B 组 31 0.839±0.029①② 0.770±0.035①②F 值 7.255 7.707 P 值 0.000 0.000
图3 TRAP1 mRNA 表达
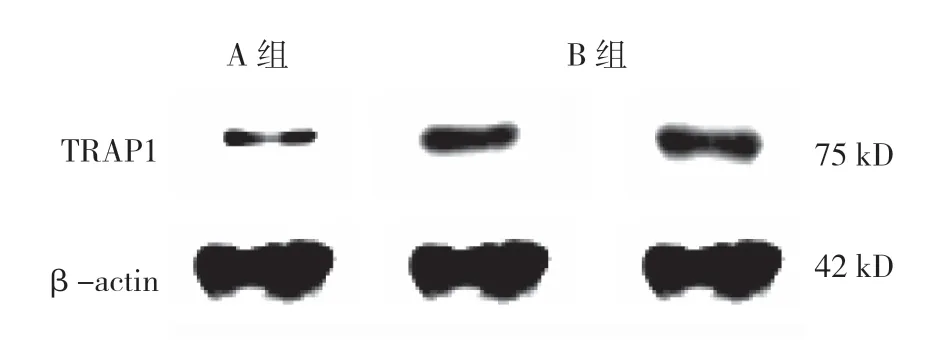
图4 TRAP1 蛋白表达
3 讨论
目前,在中枢神经系统中原发性脑胶质瘤之所以难根治,根本原因是该类肿瘤拥有非常丰富的血供及具有高度侵袭的特性[10],在中枢神经系统,AQP1 mRNA及蛋白表达主要在侧脑室及第四脑室脉络组织上,已 有学者研究证实,AQP1 mRNA 及蛋白表达与Na+-K+-ATP 酶定位一致,集中在于朝向脑脊液的顶质膜的 微绒毛的表面,据推测,这可能与脑脊液生成和分泌有关,并参与水和离子平衡调节[11],本研究发现,AQP1在原发胶质瘤(低度恶性与高度恶性)中普遍表达,而恶性程度不同的胶质瘤AQP1 表达的特点不同,肿瘤内部AQP1 的表达高于瘤周组织或者正常组织,说明AQP1 的表达与原发胶质瘤的肿瘤特性有关,这与EL HINDY 等[12]在AQP1 与人类星形细胞瘤血管生成的相关性标本中观察到的结果类似。而AQP1 在胶质瘤新生血管中的普遍表达则提示AQP1 的作用可能与胶质瘤的异常增殖和侵袭性生长有内在联系。有文章报道[13],TRAP1 在细胞运动调控中具有双重作用,在抑制TRAP1 活性而激活细胞运动,即有大量的能量来源时可能会降低细胞的最大迁移潜能,靶向TRAP1治疗可以选择性地增强抗转移治疗的疗效。WU 等[14]通过实验证实,胶质母细胞瘤组织TRAP1 表达水平高于正常脑组织,使用药物干扰TRAP1 转录与翻译过程,可诱导细胞核分裂期(G2/M 期)阻滞,导致PKB 磷酸化活性降低,诱导有丝分裂失败,降低肿瘤细胞增殖和迁移。本实验结果显示,A、B 组较对照组AQP1、TRAP1 mRNA 及蛋白表达强度上调,说明AQP1、TRAP1 与胶质瘤的发生与病理等均有密切关系;且AQP1 与TRAP1 的mRNA 和蛋白表达强度与胶质瘤的肿瘤分期具有一致性,即随着肿瘤病理级别增加,AQP1、TRAP1 表达强度依次增强。但经Spearman相关分析后显示AQP1 mRNA 及蛋白表达与TRAP1 mRNA 及蛋白表达无相关性。
综上所述,AQP1、TRAP1 与人脑胶质瘤发病和进展关系密切,而两者对胶质瘤的病理进展无协同作用。虽然该研究为深入研究胶质瘤的分子发病机制积累一定的实验基础,但要更深层次地认识胶质瘤仍需大样本对比分析。
