肺癌食管癌缺失基因1及其甲基化在鼻内翻性乳头状瘤中的表达研究*
2019-11-14蒋伟蓉唐金勇李云秋钟宇
蒋伟蓉,唐金勇,李云秋,钟宇
(1.湖南岳阳职业技术学院,湖南 岳阳 414000;2.郴州市第一人民医院 耳鼻咽喉头颈外科,湖南 郴州 423000;3.湖南师范大学附属第一医院 耳鼻喉科,湖南 长沙 410005)
鼻内翻性乳头状 瘤(nasal inverted papilloma, NIP)是一种耳鼻喉科临床中常见的良性肿瘤,具有局部发病、侵袭性强、易复发且易恶性变的特点[1]。5%的NIP 与鼻窦癌有关,因此探讨NIP 的发病机制有助于其早期诊断及治疗。肺癌食管癌缺失基因1(deleted in lung and esophagi cancer 1,DLEC1)是一个新的候选肿瘤抑制基因,研究发现DLEC1基因是一个良好的预后指标[2]。而增殖细胞核抗原Ki-67 是一种与细胞有丝分裂密切相关的抗原,能敏感而特异且较全面可靠地反映人体细胞增殖活性[3]。本研究通过检测NIP组织中DLEC1表达及基因甲基化和Ki-67 的表达,探讨DLEC1与NIP 发病及临床病理特征的相关性。
1 资料与方法
1.1 一般资料
选取2017年1月—2018年1月湖南师范大学附属第一医院(湖南省人民医院)及郴州市第一人民医院经病理确诊为鼻内翻性乳头状瘤患者30例为NIP组。其中,男性14 例,女性16 例;年龄39~67 岁,平均51.8 岁。另选取同期鼻中隔偏曲矫正术患者20 例为对照组,取其正常中鼻甲黏膜组织。其中,男性12 例,女性8 例。所有组织标本常规石蜡包埋切片备用。
1.2 方法
1.2.1 试剂 石蜡包埋组织DNA 提取试剂盒购自美国Omega 公司,引物、Taq 酶、Gold View Ⅱ型核酸染色剂等购自大连宝生物工程有限公司,EZ DNA Methylation-Gold 试剂盒购自北京天漠科技开发有限公司,即用型EnVisionTMSupper/HRP 检测试剂盒购自福州迈新生物技术有限公司。
1.2.2 NIP 组织中DLEC1和Ki-67 检测 采用即用型EnVisionTMSupper/HRP检测试剂盒检测DLEC1和Ki-67 表达,操作步骤按试剂盒说明书进行。DLEC1在细胞核和/或细胞浆呈棕黄色为表达阳性,Ki-67 在细胞核呈棕黄色为表达阳性,于高倍显微镜下(×400)取5 个视野,依据染色细胞数及强弱分类及表达的细胞平均数所占百分比判定:<5%为阴性,≥5%为阳性。
1.2.3DELC1甲基化检测 采用DNA 提取试剂盒提取石蜡包埋组织中DNA,采用EZ DNA Methylation-Gold 试剂盒,将组织DNA 取1μg 进行修饰;以上游2 000 bp 作为该基因启动子区域设计引物,甲基化(M)引物序列,正向:5'-GATTATAGCGATGACGGGAT TC-3',反向:5'-ACCCGACTAATAACGAAATTAACG- 3';未甲基化(U)引物序列,正向:5'-TGATTATAGTGA TGATGGGATTTGA-3',反向:5'-CCCAACTAATAACAA AATTAACACC-3';扩增产物大小193 bp。PCR 反应 体系25 μl,反应条件根据文献修改[4]。甲基化:95℃ 预变性10 min,40 个循环(94℃变性30 s,58℃退火45 s,72℃延伸30 s),最后72℃延伸5 min,4℃;非甲基化:95℃预变性10 min,40 个循环(94℃变性30 s,55℃退火45 s,72℃延伸30 s),最后72℃延伸5 min,4℃。取扩增产物琼脂糖凝胶电泳判断结果。为保证检测可靠性,采用反复多次检测DLEC1均为甲基化阳性的肺腺癌A549 细胞DNA 为甲基化阳性对照,外周血单个核细胞DNA 标本为非甲基化阳性对照。产物电泳只出现非甲基化条带,结果统计为非甲基化;出现甲基化条带,则无论是否出现非甲基化条带,均统计为甲基化。
1.3 统计学方法
数据分析采用SPSS 19.0 统计软件,计数资料采用例(%)表示,比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组DLEC1 和Ki-67 的表达情况
NIP 组DLEC1失表达23 例(76.7%),对照组DLEC1失表达9 例(45.0%),两组比较差异有统计学意义(χ2=5.223,P=0.022);NIP 组Ki-67 阳性18 例(60.0%),对照组Ki-67 阳性2 例(10.0%),两组比较差异有统计学意义(χ2=12.500,P=0.000)。见图1。
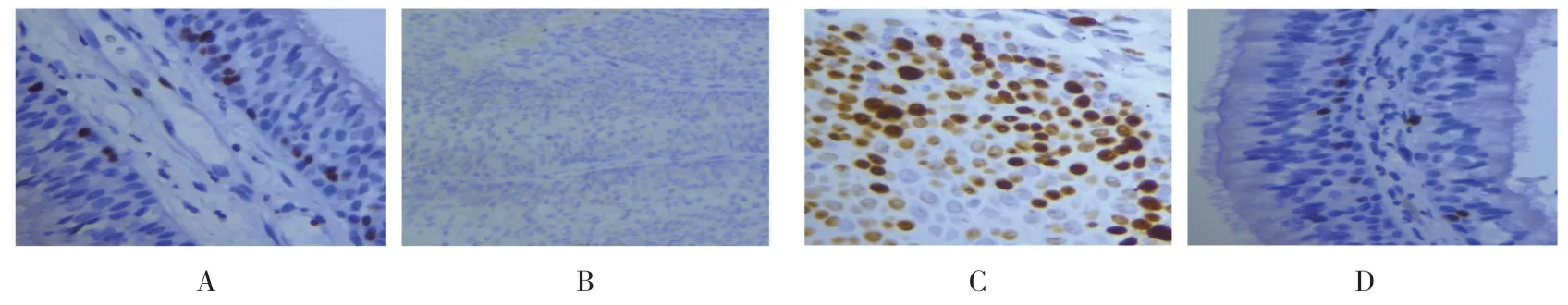
图1 两组DLEC1 和Ki-67 的表达情况 (×400)
2.2 两组DLEC1 启动子甲基化水平
NIP 组DLEC1启动子区CpG 岛甲基化阳性检出率为43.3%(13 例),对照组有10.0%(2 例)DLEC1启动子区呈甲基化状态,两组比较,差异有统计学意义(χ2=6.349,P=0.012)。见图2。
2.3 NIP 组DLEC1 与Ki-67 表达的关系
NIP 组DLEC1与Ki-67 的表达有关(χ2=5.660,P=0.017)。见表1。

图2 两组DLEC1 基因启动子甲基化水平
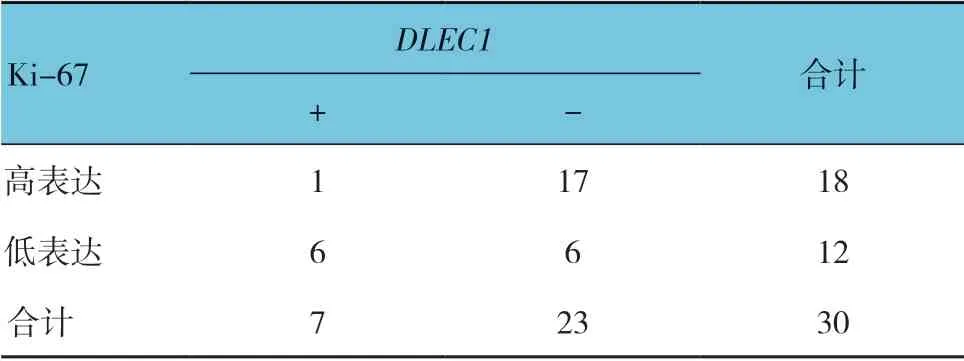
表1 NIP 组DLEC1 与Ki-67 表达的相关性
3 讨论
NIP 在1854年被首次报道[5],是一种鼻腔和鼻旁窦的良性肿瘤,它有3 个主要特点[6-7]:局部相对高侵袭性、高复发率及可能在发病初或复发时发现与恶性肿瘤相关。目前,肿瘤的性质及是否为鳞癌的癌前病变及发病机制仍不明确,这些特点使得其在临床治疗较为困难,因此对NIP 发病机制的研究具有重要的临床意义。
有研究[8-10]认为,其发病可能与HPV 感染有关,HPV 感染易引起组织细胞增殖,Ki-67 为增殖性核抗原标志物,在除G0期细胞,Ki-67 在所有G1、S、G2和M 期细胞中均有表达,且在许多恶性肿瘤中的表达多与肿瘤活跃、病理分期及早期复发有关。本研究中发现NIP 组Ki-67 表达高于对照组,与其他研究结果类似,说明在NIP 中存在组织增生。
许多标志物[11-12]如桥粒芯蛋白3 和表皮生长因子受体等与NIP 有关,但NIP 恶性转化的确切机制尚不清楚,有研究者[13]曾对口腔鳞癌及癌前病变黏膜白斑中DLEC1的表达及机制进行研究,发现DLEC1在口腔鳞癌中表达受抑制,且其抑制程度与肿瘤浸润深度相关。DLEC1表达从正常组织到黏膜白斑到鳞癌依次减弱。DLEC1[14]定位于3p22~p21.3,因已证实其在肝癌、鼻咽癌、肺癌、胃癌、口腔鳞癌和肾细胞癌组织中表达下调,因而被鉴定为候选抑癌基因[15-18]。该基因包含37 个外显子,是一种相对较新的基因,其3p 位点是几个抑癌基因的著名位点。
DLEC1通过表观遗传改变而受抑制,其表达方式与表观遗传相关,受启动子CpG 高甲基化组蛋白有或无去乙酰化而被调控[19]。有研究在胃癌和结肠癌细胞系中再引入DLEC1可抑制肿瘤细胞克隆。而在多个肿瘤中发现DLEC1活性被抑制,可能是通过影响DLEC1启动子甲基化而实现[20]。其他研究[21]发现,在肝细胞癌中DLEC1可诱导细胞周期G1期阻滞,本研究发现NIP 组DLEC1失表达高于对照组,NIP 组DLEC1与Ki-67 表达有关,NIP 组DLEC1启动子区CpG 岛甲基化阳性检出率高于对照组,提示在NIP 中DLEC1基因受抑制,其发病可能与其有关。
综上所述,DLEC1表达缺失可能与NIP 的发病相关,通过DLEC1启动子区CpG 岛甲基化造成基因在NIP 中失表达,并与Ki-67 协同,引起NIP 组织异常增殖而发病。DLEC1可能成为治疗NIP 并防止其复发的新的治疗靶点。
