1型糖尿病大鼠外周5-HT水平下降与结肠动力障碍的相关性研究
2019-11-13成颖莹戎伟芳张国花
成颖莹, 王 娟, 戎伟芳, 张国花
(上海交通大学基础医学院解剖学与生理学系,上海 200025)
糖尿病是一种以高血糖为主要特征的代谢性疾病,1型糖尿病患者胃肠道并发症比较常见,如胃轻瘫、肠道动力异常等[1]。由肠嗜铬细胞合成并分泌的5-羟色胺(5-hydroxytryptamine, 5-HT)参与调节肠道运动、肠神经发生、上皮细胞的分泌及血管的舒张,同时参与黏膜的生长维持与机体的炎症反应[2]。有研究表明5-HT参与糖尿病血糖和胰岛素分泌的调节[3],5-HT4受体激动剂可以改善糖尿病小鼠胃轻瘫[4]。本研究旨在研究结肠及血液中5-HT在1型糖尿病发展过程中的变化特点及外源性给予5-HT对糖尿病大鼠血糖和结肠运输功能的影响。
1 材料与方法
1.1 实验动物
SD雄性大鼠46只,体质量200~220g,2月龄,由上海交通大学医学院实验动物中心提供,自由进食饮水,恒温25℃。
1.2 试剂与仪器
1.2.1 主要药品与试剂 链脲佐菌素(streptozo-tocin, STZ)、5-HT、洋红(carmine)购自Sigma公司;羊抗5-HT抗体购自Neuromics公司;Alexa fluro 568标记的驴抗羊二抗购自Invitrogen公司;BCA蛋白测定试剂盒、增强型显影液购自Thermo Scientific公司;预染蛋白marker、辣根过氧化物酶(HRP)标记的羊抗兔IgG、HRP标记的羊抗小鼠IgG购自Bio-rad公司;兔抗色氨酸羟化酶(TPH1)抗体购自Millipore公司;鼠抗β-actin购自Bioworld公司。
1.2.2 主要仪器 罗康全活力型血糖仪购自德国罗氏诊断有限公司;冰冻切片机、荧光倒置显微镜购自德国Leica公司;Ultimate 3000 UHPLC高效液相色谱系统购自Dionex公司;冷冻离心机、TSQ Vantage三重四级杆质谱仪系统购自Thermo Scientific公司;显影仪ImageQuant LAS 4000购自GE公司。
1.3 方法
1.3.1 大鼠1型糖尿病模型的建立 采用腹腔注射STZ建立大鼠1型糖尿病模型。将STZ溶解于0.01mol/L冰冷的柠檬酸-柠檬酸钠缓冲液(pH=4.0),腹腔注射给药(50mg/kg),对照组腹腔注射等体积的缓冲溶液。3d后检测血糖浓度,选取血糖浓度≥15mmol/L的大鼠(模型建立成功)进行后续实验。模型建立过程中,持续观测动物的体质量和血糖情况。
1.3.2 免疫荧光组织化学 为了研究1型糖尿病进程中结肠5-HT表达变化特点,利用免疫荧光方法检测5-HT免疫阳性细胞的数目变化。用冰冻切片机将固定并包埋好的结肠组织块切片,15μm厚,贴片于载玻片上。用含10%正常驴血清的1% PBST在室温下封闭1h;一抗为羊抗5-HT(1∶1000)室温孵育4h后4℃孵育过夜,阴性对照的一抗用1% PBST代替。用Alexa fluro 568标记的驴抗羊(1∶1000)和DAPI(1∶1000)常温下孵育1h。0.05mol/L PBS清洗后用封片剂封片。使用荧光显微镜拍照,每只动物随机选取4~6个视野,并计数免疫阳性表达细胞。
1.3.3 高效液相色谱质谱联用法(HPLC-MS)检测大鼠血清中5-HT含量 大鼠麻醉后用胶带仰卧位固定在木板上,打开胸腔暴露心脏,用1mL注射器吸取左心室动脉血500~1000μL,转移到1.5mL EP管中,4℃静置过夜。第2天,常温下5000×g,离心10min后取上清液,用HPLC-MS检测血清中5-HT的含量,测得的5-HT浓度单位为ng/mL。
1.3.4 Western印迹法 为了进一步明确在糖尿病发展进程中,外周5-HT含量的减少是否与其合成速率下降有关,采用Western印迹法检测结肠黏膜组织中5-HT合成的限速酶TPH1的蛋白表达水平。腹腔注射1%戊巴比妥钠(80mg/kg)溶液麻醉大鼠,暴露腹腔,剪取1cm左右的结肠,用眼科剪小心地沿肠系膜中线将所取肠段剪开,黏膜层朝上铺平在载玻片上,在组织的一侧用刀片划出切口,随后用细胞刮板从切口处开始均匀用力,将结肠上层的全部黏膜层组织刮下来。组织经裂解液裂解蛋白,BCA法测定蛋白浓度。每组取30μg蛋白,SDS-PAGE分离蛋白,PVDF膜转膜,5%脱脂牛奶室温封闭2h,一抗为兔抗TPH1抗体孵育4℃过夜,使用HRP标记的羊抗兔二抗常温下孵育2h,在成像系统上进行曝光并记录。
1.3.5 外源性5-HT的给药方案 根据5-HT在1型糖尿病进程中的变化特点,在糖尿病模型建立两周后,腹腔注射5-HT(10mg/kg,溶解于0.9% NaCl),隔天1次,共6次[5],对照组注射同体积溶剂,第6次注射后1d进行大鼠结肠动力行为学测定。
1.3.6 大鼠结肠动力行为学测定 在结肠动力行为学测定前1周内对各组大鼠进行结肠置管手术[6]。主要将聚乙烯PE10导管距盲肠2cm处置于结肠内2.5cm,导管另一端沿皮下穿出固定于颈部皮肤。大鼠结肠置管术后约5d进行结肠动力学行为检测。实验时向导管中注入新鲜配置的洋红-纤维素溶液(6%,0.5mL),随后持续观察10h,记录带有红色染料粪便的排出时间,计算非糖尿病组均值,并将所有数值与均值进行对比,比较各组之间的相对变化。
1.4 统计学处理

2 结 果
2.1 糖尿病模型大鼠结肠及血清内5-HT的含量减少
免疫组化方法检测结果显示,结肠组织中5-HT的表达随着糖尿病的进程呈进行性下降,具有时间依赖性: 5-HT免疫阳性反应的细胞主要分布在黏膜层,可能主要是上皮肠嗜铬细胞和固有层中肥大细胞[7]。与非糖尿病组相比,糖尿病模型建立后1、2和4周,黏膜层上皮和固有层中5-HT阳性表达细胞的数量均出现显著性减少(P=0.0003,P=0.002,P<0.0001),见图1A、图1B。利用HPLC-MS方法检测发现与非糖尿病组相比,STZ诱导的1型糖尿病模型大鼠血清中的5-HT浓度在模型建立后3~4周时出现明显降低(P=0.002,P=0.0009),见图1C。
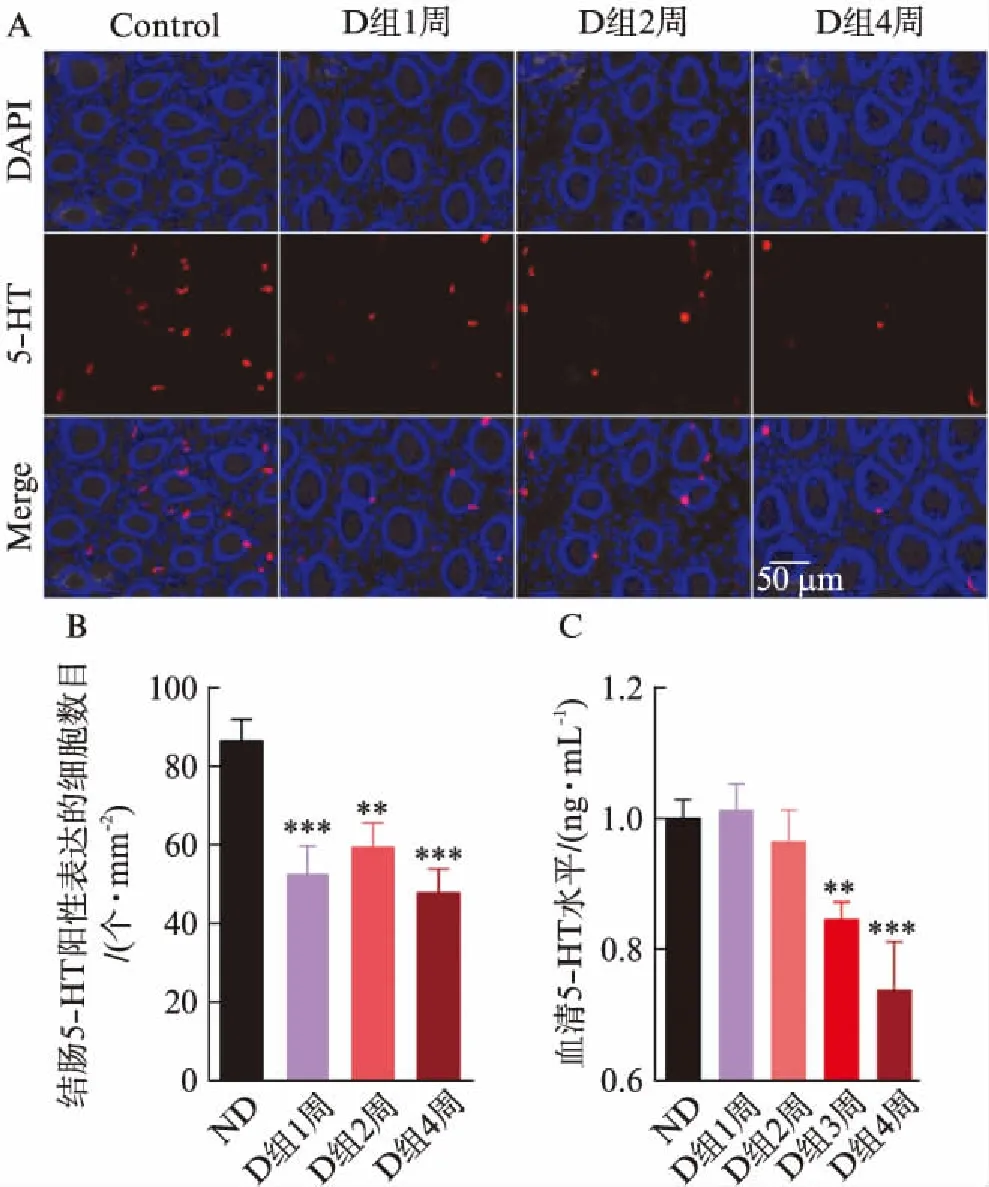
图1 STZ诱导的1型糖尿病模型大鼠外周5-HT含量下降Fig.1 The decrease of peripheral 5-HT level in SYZ-induced type 1 diabetic rats.A、B: 结肠5-HT免疫荧光染色的变化;与ND组比较,D组1~4周时,大鼠结肠组织中5-HT免疫阳性反应的细胞数目明显减少(**P<0.01,***P<0.001);C: 各组大鼠血清中5-HT浓度的变化;与ND组相比,D组3、4周时,血清中5-HT含量明显降低(**P<0.01,***P<0.001);ND: 非糖尿病;D: 糖尿病
2.2 糖尿病模型大鼠结肠组织内TPH1的蛋白水平无变化
Western印迹法结果显示: 与非糖尿病组大鼠相比,糖尿病组4周时大鼠结肠黏膜组织中TPH1的表达水平没有发生显著的变化,见图2。

图2 STZ诱导的1型糖尿病模型大鼠结肠黏膜层 组织内TPH1蛋白水平的变化Fig.2 The change in TPH1 protein level in mucosa of colon in STZ-induced type 1 diabetic rats D组与ND 4周组大鼠结肠黏膜层组织内TPH1的表达水平差异无统计学意义(P=0.6913);ND: 非糖尿病; D: 糖尿病
2.3 外源性给予5-HT对糖尿病大鼠血糖和体质量的影响
进一步观察了外源性补充5-HT对糖尿病大鼠体质量和血糖的影响。结果显示: 与非糖尿组大鼠相比,糖尿病对照组大鼠出现明显的体质量下降(图3B)和血糖升高(图3C);外源性给予5-HT后,与糖尿病对照组相比,糖尿病5-HT处理组(D-5-HT)体质量(图3B)和血糖(图3C)均没有较大的变化。

图3 外源性5-HT对糖尿病大鼠体质量和血糖的影响Fig.3 The effects of exogenous 5-HT on body weight and blood glucose of diabetic ratsA: 给予动物外源性5-HT方案;B、C: 外源性5-HT对糖尿病大鼠体质量与血糖的影响[糖尿病对照动物体质量下降和血糖升高(**P<0.01,***P<0.001);外源性给予5-HT对糖尿病大鼠体质量下降没有影响;外源性5-HT给药后1周可轻微减轻了糖尿病大鼠血糖的升高,但是依然高于15mmol/L;给药后2周5-HT对糖尿病大鼠血糖升高无影响];ND: 非糖尿病;D: 糖尿病
2.4 外源性给予5-HT对糖尿病大鼠结肠动力障碍的影响
进一步观察了外源性补充5-HT对糖尿病大鼠结肠功能的影响。结果如图4所示: 与非糖尿病组大鼠相比,STZ诱导的1型糖尿病组大鼠排出带红色染料粪便的时间明显延长,即变化百分比增大[非糖尿病组为(100.0±36.9)%,糖尿病组为(354.4±58.7)%,P=0.032],说明1型糖尿病模型大鼠的结肠动力功能出现了一定的障碍;外源性给予5-HT能明显缩短糖尿病大鼠结肠运输时间,即变化百分比下降[糖尿病组为(354.4±58.7)%,糖尿病5-HT组为(101.4±34.9)%,P=0.050]。

图4 外源性给予5-HT对糖尿病大鼠结肠动力功能的影响Fig.4 The effect of exogenous 5-HT on the colonic motility of diabetic rats与ND组相比,##P<0.01;与DC组相比,**P<0.01;ND: 非糖尿病;DC: 糖尿病对照
3 讨 论
糖尿病是由多种病因引起的以慢性高血糖为特征的代谢紊乱。2013年流行病学统计数据显示,世界范围内约有3.8亿糖尿病患者,预计到2030年会达到6亿[8]。糖尿病患者血糖的升高,往往累及多种器官并引起并发症,其中,胃肠道并发症最为常见[9],比如胃轻瘫、便秘等,也有研究表明糖尿病患者结直肠癌患病风险增高[10];这些均严重影响糖尿病患者的生活质量,而临床治疗仍存在诸多限制。
外周5-HT主要由肠嗜铬细胞(enterochromaffin cell, EC)分泌,参与机体生理与病理状态下的多种反应。5-HT在糖尿病模型动物体内的含量变化是研究者关注的热点: 在STZ诱导的1型糖尿病大鼠中,十二指肠EC的数量与5-HT的含量均显著增高[11];四氧嘧啶诱导的糖尿病大鼠模型成模6周后,从胃到结肠等不同部位5-HT含量急剧下降[5];在STZ诱导的糖尿病大鼠全血5-HT含量下降,而肠道5-HT含量明显上升[12]。上述研究表明5-HT变化与模型建立方法、检测时间结点和检测部位有关。本研究通过对STZ诱导的糖尿病大鼠进行结肠5-HT免疫阳性细胞的计数及心脏动脉血血清5-HT含量的连续监测,发现糖尿病模型建立后1周,结肠黏膜层中5-HT免疫阳性细胞数目即开始减少,且随着糖尿病的进程呈进行性减少,具有时间依赖性;而且血清5-HT的含量也在模型建立后3周显著降低,可见在STZ诱导1型糖尿病大鼠进程中,结肠和外周的5-HT水平总体处于一个缺乏的状态。由于5-HT的合成是通过TPH1对色氨酸进行羟基化而引发的,而TPH1是5-HT合成的限速酶;因此,5-HT的产生受TPH1的活性和色氨酸的可用性调节[3]。所以本研究检测了糖尿病进程中结肠5-HT合成的主要限速酶TPH1的表达,结果发现,糖尿病动物结肠黏膜层组织中TPH1的表达没有明显变化,提示在糖尿病发展过程中,5-HT的合成速率没有发生改变。近年来,肠道菌群紊乱与1型糖尿病之间的相关性受到学者关注[13-15],而肠道菌群影响5-HT的合成和分泌[16],今后会进一步研究肠道菌群紊乱与1型糖尿病与外周5-HT水平下降之间的关系。
有研究提示5-HT参与糖代谢和胰岛素分泌的调控: 在正常个体中,5-HT可以降低正常小鼠的血糖,改变其血清胰岛素水平;但是在STZ诱导的1型糖尿病小鼠中,5-HT既不改变血糖水平,也不改变其血清内胰岛素的水平[17];然而,在2型糖尿病患者中,5-HT可刺激胰岛素释放[18]。本实验证明了外源性给予糖尿病大鼠5-HT后,1型糖尿病大鼠的体质量和血糖并没有明显的改变。这进一步说明,5-HT对1型糖尿病大、小鼠的血糖升高均没有抑制作用。综上,5-HT可能对糖尿病个体糖代谢及胰岛素分泌的调控与糖尿病的类型有关。
糖尿病肠道动力障碍的发生机制复杂多样: 平滑肌细胞功能损伤[19]、Cajar间质细胞结构和功能异常[20-21]、自主神经病变[22-23]、胃肠神经元病变[24-25]、胃肠激素分泌异常[26-27]、巨噬细胞极化状态改变[28]等均可以引起糖尿病的胃肠动力障碍。5-HT以旁分泌的形式,参与调控胃肠蠕动和分泌,对胃肠动力具有促进作用,若EC细胞或5-HT信号通路发生异常,可能会导致胃肠动力出现相应的异常变化。本实验结果证明,糖尿病动物存在结肠动力障碍,而且结肠和外周血清中5-HT水平呈进行性下降,而外源性给予5-HT能改善糖尿病动物的结肠动力障碍,增加动物排出粪便的速度。这进一步说明,5-HT的减少,与糖尿病结肠动力障碍存在一定的相关性。外源性补充5-HT可能通过多方面的作用改善结肠动力障碍: (1) 5-HT可能通过5-HT4型受体直接作用于肠神经系统感觉神经元、中间神经元和运动神经元,引起乙酰胆碱、P物质和CGRP协同释放促进平滑肌收缩[29];(2) 5-HT可能通过5-HT4型受体减轻神经损伤死亡[30-31]进而抑制糖尿病自主神经和/或胃肠神经病变改善动力障碍。这一推测尚需进一步验证。
综上,外周5-HT水平随1型糖尿病进程呈进行性减少,且结肠动力功能出现障碍,而补充外源性5-HT可以改善糖尿病大鼠结肠动力障碍,但不能抑制血糖升高。这些结果提示,1型糖尿病外周5-HT水平的下降可能与结肠动力障碍有关,外源性5-HT改善肠道动力功能的作用机制有待探讨。
