翼状胬肉患者眼表微生物菌群分析
2019-11-12惠娜,秦莉,黎黎
惠 娜,秦 莉,黎 黎
0引言
翼状胬肉是一种眼部常见的慢性炎症性增殖性疾病,睑裂部异常增生肥厚的球结膜及其下纤维组织跨越角膜缘长入角膜形成其典型翼状形态[1]。近年来,对翼状胬肉发病机制进行了大量研究和探索,例如角膜缘干细胞屏障受损失去屏障作用、紫外线照射、病毒感染、遗传因素或基因突变、细胞因子、生长因子、金属蛋白酶增加、地理环境等因素均有影响[2-4],以及对于翼状胬肉致病基因的鉴定研究[5],但尚无定论。有研究表明,免疫介导的炎症反应在翼状胬肉的发生发展中起着重要作用。而眼表微生物菌群与外部环境交互作用,参与机体防御等免疫反应环节,维持眼表微生物的稳定对于眼部意义重大。目前微生物组的研究多集中于肠道、口腔[6-7],而眼表微生物菌群组成的变化是否与翼状胬肉相关尚不清楚,未来对翼状胬肉治疗的研究方向可能集中在基因遗传途径上[8]。因此,本研究通过16S rDNA基因测序翼状胬肉眼及对侧正常眼眼表微生物菌群的多样性、相对丰度等进行比较,从而探讨翼状胬肉患者眼表微生物组成的改变,为下一步研究翼状胬肉的发病机制奠定基础,为翼状胬肉的预防和治疗提供新的思路。
1对象和方法
1.1对象研究对象为2018-09/2019-01在我院就诊的50例翼状胬肉患者,最终根据获取DNA浓度,纳入翼状胬肉组(A组)为26例26眼,对照组(B组)为胬肉患者的对侧正常眼9例9眼。两组年龄、性别比较,差异无统计学意义(P>0.05)。纳入标准:单眼发病;原发性翼状胬肉。排除标准:有其它眼部疾病、过敏性疾病及全身性疾病,近期配戴过角膜接触镜,近期做过眼表理疗及眼部手术,近期使用过激素类药物。根据实验需求,通过本院伦理委员会认证,征得患者同意并签字,拟行严格无菌眼表取材。
1.2方法
1.2.1样品采集与保存受试者双眼滴盐酸丙美卡因滴眼液,1~3min后嘱受试者双眼向上看,使用无菌干棉拭子,轻微压力涂擦受试者眼球下方的球结膜表面。嘱受试者勿眨眼,勿碰触眼部皮肤等其他部位,严格无菌操作。采用同样的方法对受试者对侧正常眼进行样本采集。结膜样本拭子,保存于1.5mL无菌管中放入冰盒送入实验室,-80℃冰箱冻存,1wk内提取(16Sr)DNA。
1.2.2 DNA提取与PCR扩增样本被接收后,将棉拭子前端无菌处理剪下,转移至离心管中,裂解,冷却,加入1mL酚/氯仿/异戊醇离心12000r/min,10min,25℃。取上清,加入-20℃预冷的异丙醇,10% 3mL醋酸钠,-20℃过夜沉淀。重复离心3次,晾干后溶于适量缓冲液,提取完成,使用10g/L琼脂糖凝胶检测DNA提取质量。用V3-341F(5’-ACTCCTACGGGAGGCAGCAG-3’)和V4-806R(5’-GGACTACHVGGGTWTCTAAT-3’)通用区引物对16SV3~V4可变区进行PCR扩增。取30ng DNA样品及融合引物配置PCR反应体系。以基因组DNA为模板,进行融合引物PCR,使用Agencourt AMPure XP磁珠进行纯化并溶于Elution Buffer,建库完成。使用Agilent 2100 Bioanalyzer软件检测文库的片段范围及浓度。检测合格的文库进行测序。
1.2.3测序及数据处理
1.2.3.1高通量测序使用IIIumina的Miseq PE301+8+8+301平台进行双端测序。
1.2.3.2数据处理下机数据经过数据过滤,滤除低质量的reads,剩余的Clean data用于后期分析;将reads拼接成Tags;将Tags聚成OTU,对OTU进行物种注释;基于OTU和物种注释结果进行样品物种复杂度分析以及组间物种差异分析。群落结构层面:多样本物种分布比较,群落相似度比较,群落相似度PCoA分析,组间进化的差异显著性(Un)Weighted Unifrac分析,分析因子之间的关系,构建系统发育树。

图1维恩图。

图2基于丰度的PLS-DA分析。
统计学分析:采用Lefse软件进行统计学分析,找出各组间差异的微生物种类,两样本间的差异分析及多样性比较采用R软件的秩和检验。以P<0.05为差异有统计学意义。
2结果
2.1 OTU聚类分析在97%相似性下对序列进行OTU聚类分析,共得到1837个OTUs,翼状胬肉组共含有1381个OTUs,对照组共得到1207个OTUs,两组共有的OTU个数为751个(图1)。各组样品丰富度和均匀度良好,而翼状胬肉组比对照组拥有较多的特有OTU个数。
2.2基于OTU丰度的PLS-DA分析PLS-DA分析是一种将主成分分析和多元回归的功能相结合,达到循环PCA的各个成分以使其之间的间隔达到最大化,从而加大各组观察结果之间的间隔的目的。本研究的PLS-DA分析显示翼状胬肉组与对照组分成了两个群落,显示了两组OTU丰度上有差异(图2)。
2.3物种注释分析两组样本共鉴定出了172种细菌,这些细菌分为34个门369属。两组眼表微生物菌群结构在门水平上的比较:两组样本的前四位优势菌门相同,丰度由高至低依次为:放线菌门、厚壁菌门、变形菌门、拟杆菌门。四种优势菌门共占翼状胬肉组的97%,占对照组中的92%。在翼状胬肉组,放线菌门丰度明显高于正常对照组,但差异无统计学意义(P=0.87,图3)。
在属水平,翼状胬肉组共发现337个菌属,明显高于对照组的275个菌属。同样两组前三位优势菌属相同,丰度由高至低依次为:棒状杆菌属、未分类菌属、葡萄球菌属,共占翼状胬肉组的53%,占对照组的49%。在翼状胬肉组,棒状杆菌的丰度明显高于对照组,但差异无统计学意义(P=0.57,图4)。
在种水平,未分类菌种、葡萄球菌种及链球菌种为两组样本的共同优势菌种,其中,未分类菌种在两组中丰度均最高,且在两组中比例基本相同。值得关注的是,棒状杆菌在翼状胬肉组的丰度仍明显高于对照组,表皮葡萄球菌种、放线菌种及副球菌种在翼状胬肉组丰度明显低于正常对照组(图5)。
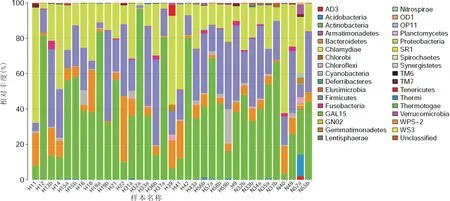
图3样品门分类水平中物种柱状图。

图4样品属分类水平中物种柱状图。
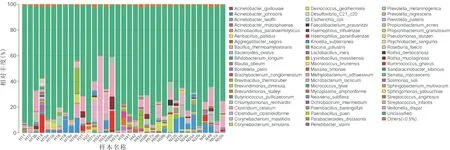
图5样品种分类水平中物种柱状图。
2.4 Alpha多样性分析通过单样品的多样性分析(Alpha多样性)可以反映微生物群落的丰度和多样性。根据obseerved species指数、chao指数、ace指数分析,对照组的多样性高于翼状胬肉组,差异有统计学意义(P<0.01,图6)。两组物种多样性存在差异,有统计学意义(P<0.05,图6)。本次样品文库的平均覆盖率(coverage指数)为99.93%,稀释曲线平缓已达到平台期,反映测序深度已经基本覆盖到样品的所有物种,能代表样品的真实情况(图7)。
2.5样品组间菌群构成差异分析我们通过对两组样本进行lefse分析显示,两组样品共有15种差异菌被发现,它们分别属于不同分类水平的菌,在翼状胬肉组特有的物种为:紫单胞菌科、图利茨菌目;对照组特有的物种为:红细菌目、副球菌属、奈瑟球菌属、乏养菌属、卟啉单胞菌属、反硝化细菌热胞菌属、黄单胞菌属、郝柠檬氏菌属、劳特罗普氏菌属。这些差异物种在两组的相对丰度及数量均较低(图8)。
3讨论
微生物的多样性及结构研究是进行复杂微生态系分析的基础,通过研究翼状胬肉患者眼表及正常眼表微生物菌群的丰度与结构,能够揭示翼状胬肉眼表与正常眼表微生物群落之间的关系,从而为预防和治疗翼状胬肉提供合理的理论依据[9]。
近年来,国内外学者关注到在机体定植的微生物菌群,已参与到宿主的防御、免疫等多个环节,微生物菌群与机体的交互作用,对机体疾病的发生发展有深远影响。例如肠道菌群与糖尿病、肥胖、溃疡性结肠炎、结直肠癌、甲状腺功能亢进,甚至焦虑、抑郁症,都有较强关联[6,10]。但眼表微生物菌群以及其与眼部疾病的关系研究报道甚少。以往传统微生物细菌培养法显示:构成人眼表的微生物群落以革兰氏阳性菌为主,其中主要以葡萄球菌属为主,其次是类白喉菌(包括棒状杆菌)、链球菌、丙酸杆菌、微球菌等,其他还偶见芽孢杆菌、假单胞菌、嗜麦芽窄食单胞菌、大肠埃希菌、产碱杆菌、不动杆菌、奈瑟菌和莫拉菌等[11-12],国外研究还分离出少量的考克菌、罗氏菌、气球菌、肠球菌、流感嗜血杆菌等[13-15]。但传统微生物检测,大多情况是纯培养,不可避免地会造成菌株的富集或衰减,人为地改变了原始菌群的构成,对研究结果造成了较大的偏差[16]。并且对于复杂环境的局限性,许多微生物无法培养得到,因此严重低估了微生物多样性对宿主的影响。而且,仅从形态特征,理化特征、菌体某些化学成分,还不足以鉴定微生物,以及深刻认识其亲缘关系,也不能解释临床现象,故需要从基因水平全面识别微生物的特点。16S rRNA/DNA序列分析的优势在于:可检测出罕见的细菌;可作为分枝杆菌的常规检测手段;帮助人们发现新的菌种;检测无法分离培养的细菌等。16S rRNA/DNA序列分析已经被应用于分析肠道[17]、口腔[18-19]、呼吸道[20]等多部位,针对眼部的研究相对较少,目前仍未得出公认的眼表微生物菌群结果[21],但根据针对结膜炎[22-24]、角膜炎[25]、干眼[26]等研究,均认为该方法是分析眼部样品科学可靠的方法。近年来,越来越多的微生物的16S rDNA序列被测定并收入国际基因数据库中,用16S rDNA作目的序列进行微生物菌群结构分析更为快捷方便。

图6组间Alpha多样性盒形图A:obseerved species指数;B:chao指数;C:ace指数;D:shannon指数;E:simpson指数;F:Good’s coverage。

图7物种多样性Alpha指数稀释曲线图。

图8LDA SCORE。
本研究基于16S rDNA的PCR产物的基因鉴定法在两组样本中共发现了172种细菌,显示眼表的细菌多样性明显高于其他技术[9,22],在属水平,丰度最高的是棒状杆菌,此结果与我们其它实验组的结果一致,说明了研究结果的可靠性。两组均以革兰氏阳性菌为主,这与传统的微生物细菌培养的检测结果相一致。本研究与美国BASCOM PALMER眼科研究所运用二代测序技术基于16S rDNA PCR鉴定法对部分健康人群的眼表菌群的研究结果基本相似[22,27-28],进一步印证了眼表菌群主要由以凝固酶阴性葡萄球菌、棒状杆菌、链球菌、丙酸杆菌等革兰氏阳性菌为主的多种菌共同组成。同时,无法分类菌种在种水平上两组中均占比例较高,说明新技术一方面证实了部分经典培养法对眼部菌群研究的结论,另一方面对菌群分析得更加细致和准确的同时也产生了新的问题。
根据多样性研究结果显示翼状胬肉组眼表微生物菌群Alpha多样性较正常对照组减少(P<0.01)。但考虑相对丰度及物种均匀度的影响后的shannon指数并未发现显著性差异。Beta多样性显示两组菌群构成区分不明显。说明两组的菌群组成相似度高,但翼状胬肉组的微生物菌群物种的丰富度较正常对照组减少,有显著差异性。在健康人体中,微生物群、宿主和外环境所构成的生态系统在正常情况下是相互平衡的,平衡遭到破坏而引起疾病称为微生态失衡[7]。而多样性的减少可能导致眼表微生物菌群的微生态失衡,影响到机体的免疫调节及眼表微生物菌群的稳态。这是否与翼状胬肉的发生有一定的相关性是值得研究的问题。
另外,值得关注的是,两组样品在属水平及种水平上,棒状杆菌的丰度在翼状胬肉组均明显高于对照组。棒状杆菌属革兰氏阳性杆菌。除白喉棒状杆菌外,其他棒状杆菌为人类口腔、鼻腔、咽喉部、外耳道、眼结膜、外阴和皮肤等处的寄生菌,这类细菌一般无致病性,因此在临床上棒状杆菌一般被视为正常菌群[27,29]。但近年研究表明,该菌属的多数菌种均可作为条件致病菌引起抵抗力低下的宿主发生各类感染[30]。由于以往检测条件的限制,棒状杆菌的检出率远较实际低。而本研究结果中棒状杆菌检出的比例增加提示可能会增大了条件致病的可能性。
综上所述,我们的研究结果显示了翼状胬肉组较对照组在眼表微生物菌群的数量和多样性方面有差异。其中,引起我们关注的是棒状杆菌的比例在翼状胬肉组明显增高,而这种结果是否会引起进一步的免疫反应,并与翼状胬肉的发生发展有关,这是我们进一步研究的方向。
