低浓度阿托品联合角膜塑形镜治疗青少年中低度近视的疗效
2019-11-12牛玉玲叶茹珊邓铤明牛静宜
牛玉玲,叶茹珊,邓铤明,金 玲,牛静宜
0引言
近年来,我国青少年近视发病率逐渐升高,发病年龄明显提前,统计报道,国内15岁以内青少年近视患病率超过70%[1]。角膜塑形镜是临床公认干预近视的有效方案,适合夜间睡眠配戴,可重塑角膜形态,降低近视屈光度,具备良好的视觉效果[2-5]。阿托品为毒蕈碱型受体拮抗剂,早期多用于散瞳、调节痉挛等方面[6-7]。但国内对低浓度阿托品与角膜塑形镜联用对中低度近视控制的效果尚鲜有报道。因此,为分析角膜塑形镜联合低浓度阿托品对青少年中低度近视的控制效果,现对我科收治的中低度近视青少年患者76例152眼展开了研究分析,报告如下。
1对象和方法
1.1对象选取2016-01/06我科收治的中低度近视青少年患者76例152眼。纳入标准:年龄8~18岁;屈光度-0.50~-2.00D;双眼屈光差<1.50D,双眼散光<-1.00D,均为顺规散光;散瞳验光等效球镜度数-0.50~-2.00D;双眼最佳矫正视力≥1.0;眼前节、眼底检查正常;无角膜塑形镜配戴禁忌证;无近期眼部治疗史(单光框架眼镜除外);无角膜接触镜配戴史;可规律配戴角膜塑形镜>1a;患者及家属均知情且自愿签署研究同意书;获得医院伦理委员会审批通过。排除标准:合并角膜炎、干眼症等其他眼科疾病者;既往有眼部手术史者;有角膜塑形镜配戴禁忌证者;合并全身性疾病者;合并心肝肾肺器质性功能障碍者;合并严重精神疾病者;合并自身免疫性疾病者;依从性差,无法按时复查者。按自愿原则将患者分为角膜塑形镜组36例72眼与角膜塑形镜联合低浓度阿托品组40例80眼(联合组)。角膜塑形镜组中男21例,女15例;平均年龄13.61±2.41岁;平均屈光度-1.38±0.23D;平均眼轴长度23.61±3.42mm。联合组中男23例,女17例;平均年龄13.73±2.52岁;平均屈光度-1.40±0.25D;平均眼轴长度23.58±3.39mm。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法所有患者戴镜前均进行裸眼视力、全自动主客观验光、裂隙灯显微镜检查眼前节、眼底镜、泪液分泌试验、眼轴及眼压测量、角膜地形图等常规检查,排除角膜塑形镜配带禁忌证。两组患者均根据患者角膜屈光、偏心率、中心曲率半径选择合适镜片试戴,角膜塑形镜直径10.0~11.0mm,光学区直径6.0mm,厚度0.22mm,采用反几何五弧设计,均在裂隙灯下行荧光素染色,进行静态评估,更改镜片参数,调适好后验光,要求角膜塑形镜光学区覆盖瞳孔区,活动度为1.0~2.0mm,荧光素染色四弧分区分界清晰,晨起摘镜角膜地形图检查示塑形位置好,角膜光滑,裸眼视力≥0.8,且无明显不适感、异物感。并要求配戴者每晚坚持配戴8~10h。联合组加用0.1g/L阿托品滴眼液点眼,每晚睡前应用,1次/d。两组均于戴镜每3mo复诊以下项目:采用国际标准视力表监测裸眼视力(LogMAR视力);采用自动验光仪检查屈光度, IOL Master仪测定眼轴长度,非接触式眼压计测定眼压变化,眼表干涉仪测定泪膜脂质层厚度(lipid layer thickness,LLT),OQAS-Ⅱ系统监测泪膜动态,获取客观散射指数(object scattering index,OSI)均值,监测患者泪膜破裂时间(tear film break-up time,BUT),角膜地图仪测定角膜曲率[8],Pentacam眼前节分析系统测定角膜厚度及前房深度[9]。上述各指标均重复测定3次取均值。记录戴镜前、戴满1a后停戴30d两组上述指标的差异。观察统计两组患者治疗期间结膜炎、角膜感染、视觉异常等并发症发生率。

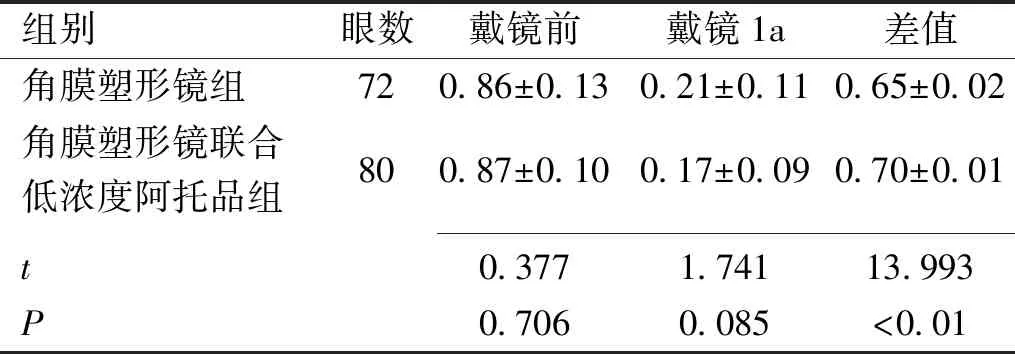
组别眼数戴镜前戴镜1a差值角膜塑形镜组720.86±0.130.21±0.110.65±0.02角膜塑形镜联合低浓度阿托品组800.87±0.100.17±0.090.70±0.01t0.3771.74113.993P0.7060.085<0.01


组别眼数戴镜前戴镜1a差值角膜塑形镜组72-1.38±0.23-1.59±0.460.21±0.23角膜塑形镜联合低浓度阿托品组80-1.40±0.25-1.50±0.430.10±0.18 t0.3610.8812.333P0.7180.3800.022
2结果
2.1两组患者戴镜前后裸眼视力比较戴镜前、戴镜1a两组裸眼视力比较差异均无统计学意义(P>0.05),联合组戴镜前、戴镜1a裸眼视力变化幅度高于角膜塑形镜组,差异有统计学意义(P<0.01),见表1。
2.2两组患者戴镜前后屈光度变化比较戴镜前、戴镜1a两组患者屈光度比较差异无统计学意义(P>0.05),联合组戴镜前、戴镜1a屈光度差值低于角膜塑形镜组,差异有统计学意义(P<0.05),见表2。
2.3两组患者戴镜前后眼轴长度比较戴镜前、戴镜1a两组患者眼轴长度比较差异无统计学意义(P>0.05),但联合组戴镜前、戴镜1a眼轴长度差值低于角膜塑形镜组,差异有统计学意义(P<0.01),见表3。
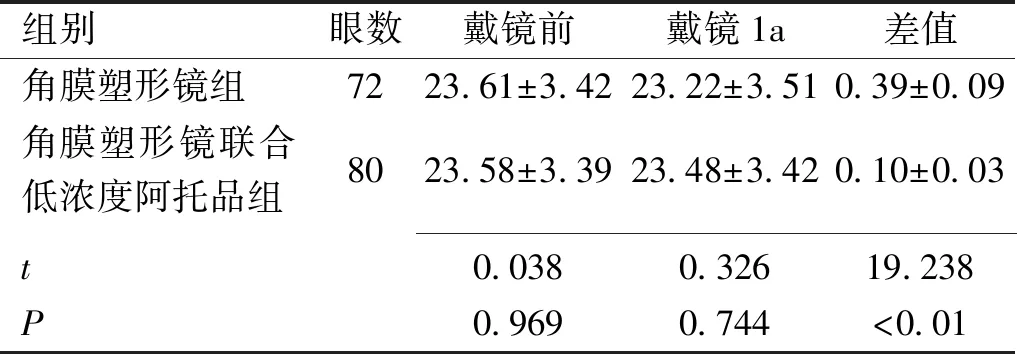
组别眼数戴镜前戴镜1a差值角膜塑形镜组7223.61±3.4223.22±3.510.39±0.09角膜塑形镜联合低浓度阿托品组8023.58±3.3923.48±3.420.10±0.03 t0.0380.32619.238P0.9690.744<0.01
组别眼数戴镜前戴镜1a差值角膜塑形镜组7217.72±3.2717.83±3.370.11±0.10角膜塑形镜联合低浓度阿托品组8017.71±3.3117.81±3.390.10±0.08 t0.0130.0250.483P0.9890.9790.630
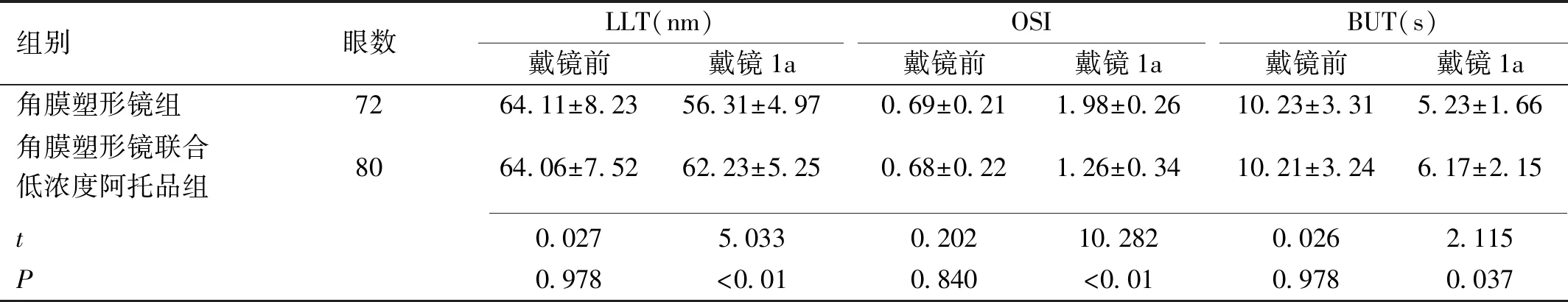
组别眼数LLT(nm)戴镜前戴镜1aOSI戴镜前戴镜1aBUT(s)戴镜前戴镜1a角膜塑形镜组7264.11±8.2356.31±4.970.69±0.211.98±0.2610.23±3.315.23±1.66角膜塑形镜联合低浓度阿托品组8064.06±7.5262.23±5.250.68±0.221.26±0.3410.21±3.246.17±2.15 t0.0275.0330.20210.2820.0262.115P0.978<0.010.840<0.010.9780.037
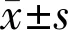
组别眼数角膜曲率(D)戴镜前戴镜1a角膜厚度(μm)戴镜前戴镜1a前房深度(mm)戴镜前戴镜1a角膜塑形镜组7241.63±1.7339.66±0.41563.41±35.52557.25±10.143.64±0.333.61±0.05角膜塑形镜联合低浓度阿托品组8041.65±1.7139.21±0.35565.65±36.23546.88±12.023.65±0.353.56±0.06 t0.0505.1170.2714.0770.1273.960P0.959<0.010.786<0.010.898<0.01
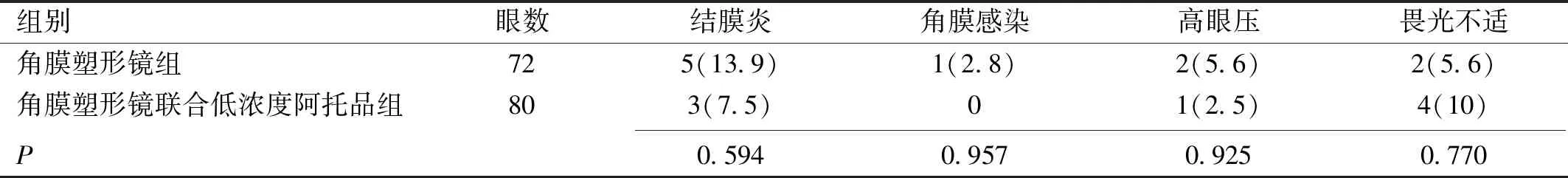
表7 两组患者眼部相关并发症发生率比较 眼(%)
2.4两组患者戴镜前后眼压变化比较两组患者戴镜前、戴镜1a眼压比较差异无统计学意义(P>0.05),见表4。
2.5两组患者戴镜前后泪膜功能各指标比较戴镜前,两组LLT、OSI、BUT比较差异无统计学意义(P>0.05),戴镜1a,联合组LLT、BUT高于角膜塑形镜组,OSI低于角膜塑形镜组,差异有统计学意义(P<0.05),见表5。
2.6两组患者戴镜前后角膜各参数比较戴镜前,两组角膜曲率、角膜厚度、前房深度比较差异无统计学意义(P>0.05),戴镜1a,联合组角膜曲率、角膜厚度、前房深度变化幅度均低于角膜塑形镜组,差异均有统计学意义(P<0.01),见表6。
2.7两组患者戴镜并发症发生率比较两组患者并发症均以结膜炎为主,程度较轻,角膜塑形镜组中5眼结膜炎中并发角膜感染1眼,其中1眼结膜炎1a内反复发作3次,联合组1眼1a内发作结膜炎2次,主要与初期配镜不熟练引起或戴镜时手指划伤等有关,其余各并发症发生率比较差异无统计学意义(P>0.05),见表7。
3讨论
近视是全球范围最常见屈光问题,同时也是造成视觉障碍的主要眼病[10]。目前尚未完全明确近视的发生机制,多认为与遗传、行为及视觉环境等因素有关[11-12]。而行为、调节因素则为处于成长发育阶段青少年近视发生的主要原因。经典调节理论表示,近距离阅读使用调节、长期调节可引起调节痉挛,导致眼轴长度增加,引起近视发生,且随学习及阅读时间延长,近视程度进展[13-14]。同时近视可引起视疲劳、远视力降低,对青少年学习及日常生活产生影响。对青少年近视尚无确切治愈手段,一般轻中度近视可通过各类方式矫正,以普通框架眼镜矫正多见,其通过光学矫正近视屈光状态提高其远视力,属人工性正视眼,无明显治疗及预防作用[15]。近年来发现,角膜塑形镜可通过调节眼睑压力及泪液虹吸作用,调节角膜上皮细胞分布,改善屈光度,控制眼轴长度,延缓近视进展[16]。角膜塑形镜系基于反几何原理设计的高透氧性硬性镜片,主要通过机械压迫、眼睑按摩、泪液液压等机制改善角膜形态,降低近视程度。Sunee等[17]对高度近视患者采用夜戴型角膜塑形镜治疗,结果发现较普通框架眼镜其可明显改善高度近视患者屈光度,抑制眼轴增长。研究发现,配戴普通框架眼镜后视网膜中心凹成像于视网膜上,而视网膜周边成像于视网膜后可引起远视性离焦,导致眼轴长度增加[18]。相对而言,配戴角膜塑形镜后,角膜中央平坦化,中周部陡峭形态改变,可降低视网膜远视性离焦程度,控制眼轴增长。Polling等[19]进行随访发现,高度近视患者配戴角膜塑形镜1~2a后眼轴长度增长减缓。但对其在中低度青少年近视中的应用效果尚未明确。本研究中所有患者均采用角膜塑形镜治疗,裸眼视力均得到一定程度的改善,且其眼轴长度、屈光度控制明显优于刘明珠等[20]报道的常规框架眼镜各参数,肯定了角膜塑形镜对中低度青少年近视的调节作用。但近期有学者提出,阿托品配合角膜塑形镜联合应用可能存在协同效应,可进一步改善患者视力[21]。
阿托品属非选择性M受体拮抗剂,为用于近视眼预防的常用药物,长期应用阿托品控制近视进展已成为临床共识。统计数据显示,阿托品每年可延缓近视进展0.55D[22]。队列研究显示,儿童每日规律使用阿托品点眼可延缓屈光度增加[23]。Loh等[24]对近视动物模型采用阿托品治疗,结果发现阿托品治疗期间,巩膜形态产生明显改变,神经纤维层增厚,软骨层变薄,促使屈光不正趋向正视化发展,因此认为阿托品主要通过作用于巩膜纤维层发挥近视控制作用。但贺美男等[25]指出,长期应用高浓度阿托品可能增加过敏性结膜炎、畏光、瞳孔扩大发生风险。本研究中所有对象均为中低度青少年近视患者,联合组应用角膜塑形镜联合低浓度阿托品治疗,角膜塑形镜组单用角膜塑形镜治疗,两组均持续规律配戴角膜塑形镜1a,结果发现,联合组患者裸眼视力、屈光度及眼轴长度控制方面略优于单用角膜塑形镜,与Cheng等[26]提出结论相符,同时与任秋锦等[27]研究报道的单用低浓度阿托品对眼轴长度影响相似,略低于单用低浓度阿托品,考虑一方面配戴角膜塑形镜后角膜中央趋向平坦化,中周部视网膜远视离焦减少,可延缓眼轴增多,另一方面,低浓度阿托品可通过作用于视网膜外组织M受体或非胆碱能系统有效控制剥夺性眼轴增加。有学者表示,长期配戴角膜塑形镜对角膜知觉可能产生一定的负面影响,导致泪膜稳定性降低[28]。Qian等[29]指出,角膜形态变化可能引起泪液流动渠道改变,影响泪液稳定性。本研究发现,两组患者戴镜1a后角膜曲率、角膜厚度、前房深度均有一定的降低,联合组降低幅度较角膜塑形镜组低,提示加用阿托品点眼后近视患者角膜形态改变幅度低于角膜塑形镜组,分析主要配戴角膜塑形镜通过机械作用可将角膜接触镜与角膜紧密贴合,改变角膜曲率;镜片物理机械压力导致角膜表面组织重新分布、层次排列紧密,易引起角膜厚度变薄,导致前房变浅;长期配戴可能造成角膜持续缺氧,引起上皮细胞无氧代谢反应,导致眼球渗透压上升,易引起角膜水肿;而加用低浓度阿托品可减少配戴角膜塑形镜对角膜上皮的机械刺激,减少机械应力对角膜表面组织的影响,减少角膜上皮脱落,加速角膜上皮细胞修复,避免渗透压上升,减轻角膜水肿,减少角膜厚度及前房深度丢失。同时联合组泪膜功能相关指标LLT、BUT高于角膜塑形镜组,OSI低于角膜塑形镜组,其中BUT为评估泪膜功能的主要参数,BUT减少提示泪膜稳定性降低;泪液外层LLT则为维持泪液稳定性的重要参数,配戴角膜塑形镜后LLT变薄,液体层蒸发过快,同样对泪膜稳定性产生影响;OSI则为间接反映泪膜质量参数,本研究发现,加用阿托品点眼后近视患者泪膜功能及泪膜质量降低情况较角膜塑形镜组少,考虑到可能与加用低浓度阿托品可阻断胆碱能节后纤维支配效应器,解除瞳孔括约肌、睫状肌痉挛,影响细胞内神经递质释放,进而维持角膜上皮细胞完整性,提高泪膜的稳定性,减少配戴角膜塑形镜所引起的角膜不适感,进而提高患者视觉功能。此外,进行并发症观察发现,两组并发症相近,眼压变化无明显差别,但加用阿托品的联合组畏光不适发生率略高于角膜塑形镜组,考虑主要与阿托品作用于瞳孔括约肌M受体,阻断胆碱能神经对睫状肌的作用,可能导致括约肌麻痹,造成瞳孔散大、畏光,但两组对比差异无统计学意义,主要与低浓度阿托品应用对眼部刺激较小有关,通常不会引起患者较大不适感;而配戴角膜塑形镜出现畏光不适则可能与配戴角膜塑形镜下泪液循环差,角膜呈缺氧水肿,或摘镜方式不当,超时配戴等导致角膜上皮损伤,进而引起畏光不适症状有关。
综上所述,角膜塑形镜联合低浓度阿托品可提高青少年中低度近视控制效果,控制屈光度上升及眼轴长度增长,提高裸眼视力,减少配戴角膜塑形镜对角膜形态及泪膜功能的影响,且安全性肯定。但本研究纳入样本数量少,观察时间短,可能是引起两组并发症发生率统计学检验无差异的原因,后续需进一步扩充样本量,进一步明确加用低浓度阿托品对中低度近视青少年并发症的影响。
