GSK-3β及相关基因在颞叶癫痫大鼠海马的表达研究
2019-11-09黄文皎田发发陈文利
黄文皎,田发发,陈文利,刘 达
目前在大多数人类颞叶癫痫及其动物模型中[1~3]都发现海马苔藓纤维出芽(mossy fiber sprouting,MFS)是普遍存在的病理改变。多项研究发现tau蛋白过度磷酸化可促进海马苔藓纤维出芽并参与颞叶癫痫的形成过程[4,5]。而tau蛋白磷酸化与GSK-3β密切相关。GSK-3β是一种多功能的苏氨酸/丝氨酸类激酶,参与神经细胞的生存发育,结构稳定,神经细胞极性的形成、运动和凋亡过程[6,7]。GSK3β氨基末端第9位丝氨酸的磷酸化(p-GSK3β)可抑制其活性。而多项研究表明,SB216763是目前发现抑制作用最强并具备较高选择性的抑制剂且没有神经毒性[8,9]。在经典的PI3K-AKT信号通路中,AKT和PTEN均是GSK3β活性调节的上游因子,更重要的是二者在神经细胞极性的形成和维持过程中均起到重要的调节作用[10]。本课题组的前期研究已证实:在戊四氮致痫大鼠模型中,随着点燃效应的逐步建立,海马MFS的程度逐渐增强,该区GSK3β表达水平和活性、总tau蛋白、磷酸化tau蛋白的表达水平也一致性增高[11,12]。但AKT和PTEN是否通过调节GSK3β活性进而改变tau蛋白磷酸化水平而参与颞叶癫痫的发生,目前国内外研究尚未有报道。本实验通过干预GSK3β的活性,应用RT-PCR方法检测在癫痫形成过程中GSK3β及AKT及PTEN、微管相关蛋白tau(MAPT)的基因表达动态变化,探讨GSK-3β信号通路在颞叶癫痫中的作用。
1 材料与方法
1.1 材料 健康雄性Sprague-Dawley(SD)大鼠[中南大学实验动物部,许可证号:SCXK(湘)2006-0002],垂直板电泳仪(美国Bio-Rad公司),直流稳压电泳仪(美国Bio-Rad公司),电泳凝胶图像分析仪(上海天能科技有限公司),硝酸纤维素膜NC膜(美国Pierce公司Step plus One),荧光定量PCR仪(美国ABI公司),BIO-RADS1000TM PCR仪(美国BIO-RAD公司),PCR扩增仪(美国PERKIN ELMER公司),戊四氮(美国SIGMA公司),SB216763(美国SIGMA公司),Trizol提取液(美国Invitrogen公司),引物(AKT1、PTEN、GSK-3β、MAPT、GAPDH),All-in-OneTMqPCR,MixAll-in-OneTMFirst-Strand cDNA Synthesis Kit(广州复能基因)。
1.2 实验动物模型制作及分组 健康雄性Sprague-Dawley(SD)大鼠,采用随机数字表,将大鼠分为PTZ+SB216763干预组(n=30)、PTZ+DMSO实验组(n=30)和DMSO+SB216763空白对照组(n=10)。干预组、实验组予以每日腹腔注射戊四氮亚惊厥剂量(30 mg/kg);空白对照组每日腹腔注射等量生理盐水。根据首次腹腔注射后第3天、1 w、2 w、4 w和6 w将实验组和对照组随机分为5个亚组。并于点燃过程的第2天、第4天、第6天分别予以干预组及对照组大鼠侧脑室注射GSK-3β的选择性抑制剂SB216763,实验组侧脑室注射经生理盐水稀释的DMSO溶剂。戊四氮诱导大鼠痫性发作的发作级别按照Racine标准进行分级,凡连续5次腹腔注射给药后出现Ⅲ级或Ⅲ级以上发作则视为动物模型点燃成功标准。点燃成功后可停止注射戊四氮。
1.3 Western blot方法检测p-GSK-3β蛋白的表达观察其活性变化 分别于首次腹腔注射后第3天、1 w、2 w、4 w、6 w提取实验组及干预组大鼠左侧海马总蛋白(每个亚组4只大鼠,实验组及干预组各20只大鼠),蛋白变性后,SDS-PAGE电泳,转膜,封闭,孵育抗体,一抗为P-GSK-3β兔抗大鼠多克隆抗体IgG 1∶500,化学发光法显色、曝光。对胶片进行扫描,用凝胶图像处理系统Quantity One分析目标带的光密度值并进行数据处理,以GAPDH(分子量37 kDa)蛋白为内参照进行目的蛋白的定量分析。
1.4 RT-PCR检测各组海马的PTEN、AKT1、GSK-3β和MAPT的m-RNA表达 按Trizol 法分别于首次腹腔注射后第3天、1 w、2 w、4 w、6 w提取对照组,实验组及干预组大鼠右侧海马RNA(实验组及干预组各20只大鼠,每个亚组4只大鼠;对照组共10只大鼠,每个亚组2只大鼠)。将提取的RNA进行逆转录,操作按MixAll-in-OneTM First-Strand cDNA Synthesis Kit试剂盒说明进行。逆转录产物扩增采用2×Taq PCR Master Mix试剂盒,并参照其说明进行。启动荧光定量PCR仪,选择SYBR Green(包括溶解曲线),Comparative CT(ΔΔCt),95 ℃初始变性10 min,95 ℃变性10 s,40个循环数,退火温度55 ℃,20 s,延伸72 ℃至少15 s,继续延伸95 ℃,15 s,40个循环结束后,溶解曲线阶段60 ℃ 1 min,继续95 ℃ 15 s后终止反应完成3步法PCR过程。分析扩增曲线及溶解曲线,利用相对定量法:2ΔΔCt分析各组大鼠之间各指标mRNA表达的区别。
2 实验结果
2.1 造模情况 实验组大鼠除去因各种原因未达点燃标准(包括麻醉意外死亡1只,癫痫大发作死亡2只,PTZ给药4 w后仍未达点燃标准1只)予以剔除,余26只平均点燃时间为(21.4±1.8)d,从中随机选取20只进入实验组。而经GSK-3β抑制剂SB216763处理的干预组大鼠中有3只在反复侧脑室注射手术过程中死亡,PTZ给药4 w后仍未达点燃标准的大鼠共4只。其余23只大鼠平均点燃时间为(26.4±1.2)d,随机选取20只大鼠进入干预组。与实验组相比,其造模成功率及平均点燃时间均有显著差异(P<0.05)。两组大鼠每天腹腔注射PTZ后平均发作级别的变化趋势对比存在明显差异(P<0.05)(见图1)。
2.2 Western blot结果 本研究采用Western blot方法检测实验组和干预组大鼠在不同时间点P-GSK-3β在海马区域总的表达变化差异。结果显示:实验组P-GSK-3β表达变化前2 w内表达逐渐下降,6 w组时恢复到正常水平。干预组P-GSK-3β表达在第3天时反而升高(P<0.01),1 w后开始缓慢下降。除6 w组外(P>0.05),两组相应各时间点均存在差异(P<0.05)(见表1、图2)。
2.3 RT-PCR结果
2.3.1 对照组大鼠GSK-3β mRNA表达较稳定,在各个时间点的表达无统计学差异,而实验组大鼠GSK-3β从第3天开始即出现表达上升趋势,1 w时达高峰,除6 w组外(P>0.05),与对照组各时间点相比均存在统计学差异(P<0.05)。干预组与实验组大鼠相比,其表达变化趋势基本一致(见表2、图3)。
2.3.2 与对照组相比,GSK-3β的上游负调控因子AKT1 mRNA在实验组大鼠3 d时表达明显上调(P<0.05)。干预组与实验组大鼠表达趋势基本一致(见表3、图4)。
2.3.3 PTEN为GSK-3β上游正调控因子,实验组大鼠与对照组相比,第3天即出现显著升高趋势(P<0.05),6 w时表达低于对照组。干预组与实验组大鼠相比,各个时间点均无显著差异(P>0.05)(见表4、图5)。
2.3.4 GSK-3β的下游磷酸化底物总tau蛋白MAPT在实验组大鼠的表达与对照组大鼠相比,第3天即出现表达上调,并进行性上升,第6周时下降至对照组水平。除6 w组外(P>0.05),其余各时间点均存在统计学差异(P<0.05)。干预组与实验组大鼠相比,虽仍从第3天开始呈表达上升趋势,但上升幅度明显减少,除6 w组外,其余各时间点均存在统计学差异(P<0.05)(见表5、图6)。

表1 两组大鼠各时间点海马的P-GSK-3β
与实验组相应各时间点比较*P<0.05,ΔP<0.01

表2 各组大鼠不同时间点GSK-3β mRNA的相对表达量
与对照组相应各时间点比较*P<0.05;与实验组相应各时间点比较ΔP<0.05

表3 各组大鼠不同时间点AKT1 mRNA的相对表达量
与对照组相应各时间点比较*P<0.05;与实验组相应各时间点比较ΔP<0.05

表4 各组大鼠不同时间点PTEN mRNA的相对表达量
与对照组相应各时间点比较*P<0.05;与实验组相应各时间点比较ΔP<0.05

表5 各组大鼠不同时间点MAPT mRNA的相对表达量
与对照组相应各时间点比较*P<0.05;与实验组相应各时间点比较ΔP<0.05

注:已点燃大鼠的自发发作不计算在内;两组相应各时间点比较*P<0.05


图2 各时间点实验组与干预组P-GSK-3β蛋白在海马的表达
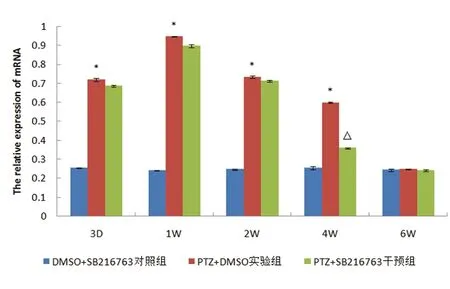
图3 各组大鼠不同时间点GSK-3β mRNA的相对表达量比较
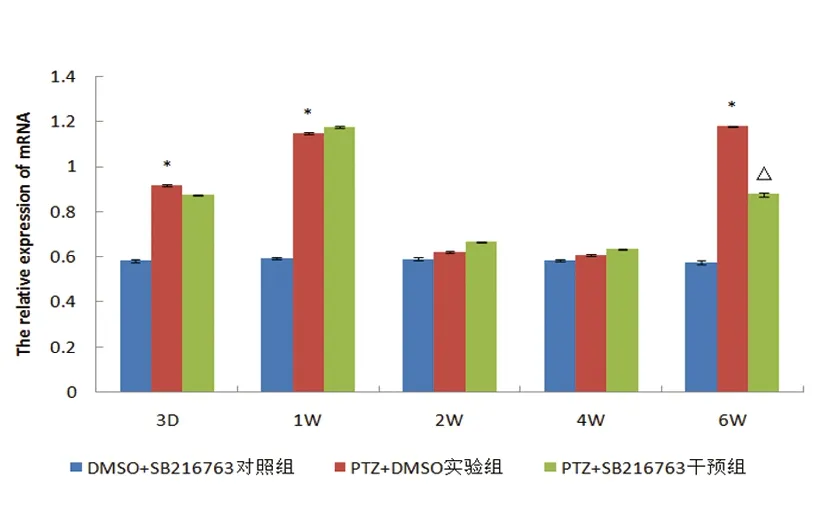
图4 各组大鼠不同时间点AKT1 mRNA的相对表达量比较

图5 各组大鼠不同时间点PTEN mRNA的相对表达量比较

图6 各组大鼠不同时间点MAPT mRNA的相对表达量比较
3 讨 论
有研究报道GSK-3β通过磷酸化tau蛋白参与局灶性皮质发育不良的病理过程[13],而该疾病是导致人类难治性颞叶癫痫反复发作的主要原因之一。在单转染了tau蛋白的海马神经细胞中,微管蛋白束的表达和功能均可正常,而tau蛋白和GSK-3β共同转染的细胞内可出现异常的微管蛋白聚集[14]。经GSK-3β抑制剂处理后的细胞,不仅tau蛋白磷酸化水平下降,同时轴突出芽也受抑制。本课题之前的研究也发现GSK-3β很可能通过调节tau蛋白的磷酸化水平参与的颞叶癫痫的形成与发展[11,12]。本研究在建模过程早期通过侧脑室注射GSK-3β高选择性抑制剂SB216763,发现干预组p-GSK-3β(其非活性形式)蛋白表达较实验组明显升高,说明抑制GSK-3β活性有效,尽管并不能阻止大鼠颞叶癫痫的发生,但其癫痫发作的阈值有所提高,每天经PTZ诱导的痫性发作的级别减轻,造模成功率也明显降低。这些变化均进一步证实GSK-3β参与颞叶癫痫的发生发展过程,通过抑制其活性可能减缓癫痫发生的严重程度。
GSK-3β可参与多条信号通路,其上游调节因子也众多,但与神经细胞极性形成及轴突生长关系密切的GSK-3β上游调控因子则主要是PI3K/AKT信号通路中的PTEN及AKT[10,15,16]。GSK3β是AKT的直接磷酸化底物,可使GSK3β的Ser9磷酸化抑制其活性。PTEN(phosphatase and tensin homology deleted on chromosome 10)中文名为人第10号染色体缺失的磷酸酶及张力蛋白同源的基因,是一个PIP3-磷酸酶,对PI3K起拮抗作用,它可以通过去磷酸化将PIP3转变为PI- 4,5-P2,减少AKT的活化而阻止所有由AKT调控的下游信号传导,包括增强GSK3β的活性[17,18]。
本研究采用qPCR技术检测3组大鼠海马组织内GSK-3β及其相关基因表达的变化结果显示,实验组与对照组相比,第3天GSK-3β mRNA表达水平即出现显著上调,并持续升高,6 w时基本恢复正常水平。再次证实,GSK-3β参与了癫痫的形成,而干预组与实验组的表达变化趋势一致,各时间点相比没有显著差异,进一步说明SB216763抑制剂仅对GSK-3β的活性起到抑制作用,而GSK-3β总表达水平则不受影响。
在PTZ点燃过程早期,实验组较对照组PTEN及AKT基因表达也出现表达升高趋势,2 w时则出现表达下降,与GSK-3β的表达变化趋势一致,可解释为GSK-3β的表达在受到癫痫刺激因素影响的早期,其上游正调控因子(PTEN)起主导作用,在PTEN基因表达升高的影响下,GSK-3β的表达及活性升高,而AKT的表达升高可能是由于GSK-3β活性升高的负反馈调节引起的代偿性升高。可起到促进神经细胞存活,减少凋亡的保护作用。整个点燃过程,实验组与干预组PTEN及AKT基因表达变化一致,无明显统计学差异,考虑短期抑制GSK-3β活性并不会对其上游调控因子产生影响。而在实验组大鼠达到完全点燃并出现反复自发性发作的后期6 w时,AKT的表达再次升高,并且实验组较干预组升高的更为明显,提示颞叶癫痫的反复自发性发作可能引起AKT的表达升高,调节AKT的活性有可能影响颞叶癫痫的发展。其具体相关性仍有待于进一步研究。
MAPT(microtubule-associated protein tau)代表GSK-3β的下游磷酸化底物tau蛋白的总表达量。在实验组大鼠点燃早期较对照组呈升高趋势,4 w时达高峰,而6 w时下降致正常水平。提示tau蛋白的总表达在颞叶癫痫形成过程中均发挥作用。而干预组与实验组相比,MAPT的升高趋势明显下降,提示在颞叶癫痫模型中,抑制GSK-3β的活性,可通过对tau蛋白的总表达量起到一定抑制作用,进一步延缓癫痫的形成及发展。
综上所述,本课题的研究证明,GSK-3β很有可能受到上游因子PTEN及AKT的双重调节,改变自身的表达及活性,通过调节下游底物tau蛋白的表达,参与颞叶癫痫的形成及发展过程。
