葛仙米水溶性多糖含量测定方法的研究
2019-11-08苏攀峰许剑锋刘艳芳王玉兰唐庆九
苏攀峰,陈 盛,许剑锋,周 帅,刘艳芳,赵 明,王玉兰,唐庆九*
(1上海海洋大学食品学院,上海201306;2上海市农业科学院食用菌研究所,上海201106;
3上海水产品加工及贮藏工程技术研究中心,上海201306;4湖南炎帝生物工程有限公司,株洲412000)
葛仙米是低等单细胞的蓝藻,又称珍珠菜,与地木耳(N.commune)、发菜(N.flagelliforme)同属蓝藻门(Cyanophyta)蓝藻纲(Cyanophyceae)段殖藻目(Hormogonales)念珠藻科(Nostocaceae)念珠藻属(Nostoc),有1 500多年的食用历史[1-3]。Yang等[4]研究发现,食用葛仙米不含蓝藻毒素,是一种有较高药用和食用价值的经济蓝藻。葛仙米不仅富含蛋白质,还含有丰富的多糖[5-6]。研究表明,葛仙米多糖在提高免疫、抗肿瘤、抗凝血、抗菌性、抗氧化等方面具有重要的作用[7-11],因此被广泛用于食品、保健品和化妆品中。
多糖含量测定方法主要有蒽酮比色法和苯酚-硫酸法[12-14],已经广泛用于植物、真菌等多糖的测定。葛仙米中多糖含量高,而且黏度非常大,多糖较难完全提取出来,运用药典或农业部的多糖含量测定方法时,结果不稳定。因此,本试验对葛仙米水溶性多糖提取的影响因素进行系统研究,并对前处理方法的各指标进行考察,以期为葛仙米水溶性多糖的准确测定建立基础。
1 材料与方法
1.1 材料
1.1.1 材料与主要试剂
葛仙米由湖南炎帝生物工程有限公司提供,干燥粉碎后备用。重蒸酚、浓硫酸、葡萄糖均为分析纯,国药集团化学试剂有限公司生产。
1.1.2 主要仪器
Eppendorf AG 22331高速离心机、Eppendorf移液枪(Eppendorf公司);XW-80A漩涡振荡器(海门市其林贝尔仪器制造有限公司);HWS12型电热恒温水浴锅(上海一恒科学仪器有限公司);DJ-10A倾倒式粉粹机(上海淀久中药机械制造有限公司);FA2004N分析天平(上海舜宇恒平科学仪器有限公司);ICS2500离子色谱仪(Dionex公司);Synergy HT酶标仪(Bio-TEK公司);Dionex ICS2500系统,包括:GS50四元梯度泵、ED50A电化学检测器(金电极)、LC30柱温箱(30℃);Chromeleon 6.5色谱工作站;CarboPac MA-1阴离子交换分析柱(4 mm×250 mm)(Dionex公司,美国)。
1.2 方法
1.2.1 葛仙米中单糖、二糖含量测定
根据文献报道[15-18],以赤藓糖醇、阿拉伯糖醇、海藻糖、甘露醇和葡萄糖为标品,精确取100.0 mg的葛仙米,用超纯水溶解至10 mL,室温振荡2 h,离心,离子色谱测单糖、二糖的含量。
色谱条件:流动相为0.48 mol/L NaOH,0.4 m l/min的流速,柱温30℃,上样量25μL。
1.2.2 葡萄糖标准品的标准曲线绘制
精确量取葡萄糖标准溶液0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL置于20 mL干燥试管中,用蒸馏水补至1.0 mL,分别加入5%的苯酚溶液0.5 mL、混匀后迅速加入2.5 mL浓硫酸,漩涡振荡,沸水浴15 min,迅速冷却至室温,490 nm处测其吸光度,计算回归方程,绘制标准曲线。
1.2.3 葛仙米水溶性多糖含量测定

其中,W是多糖质量体积比(mg/mL),D为提取液总体积(mL),M为样品质量(mg)。
1.2.4 葛仙米水溶性多糖提取条件的单因素试验
1.2.4.1 浸泡时间对提取葛仙米水溶性多糖含量的影响
准确取葛仙米100.0 mg置于具塞三角瓶中,按料液比(W/V,mg/mL)1∶500加入蒸馏水,分别在室温下浸泡 1 h、2 h、3 h,100℃加热提取2 h,迅速冷却至室温,离心(13 000 r/min、5 min),取上清测定多糖含量,重复3次,取平均值。
1.2.4.2 加热温度对提取葛仙米水溶性多糖含量的影响
准确称取葛仙米100.0 mg,提取温度分别为40℃、60℃、80℃、100℃,其他提取条件同上。
1.2.4.3 加热时间对提取葛仙米水溶性多糖含量的影响
准确称取葛仙米100.0 mg,提取时间分别为0.5 h、1 h、3 h、5 h,其他提取条件同上。
1.2.4.4 料液比对提取葛仙米水溶性多糖含量的影响
准确称取葛仙米各 100.0 mg,料液比(W/V,mg/mL)为 1∶100、1∶200、1∶500、1∶1 000,其他提取条件同上。
1.2.5 葛仙米水溶性多糖提取条件的正交试验
在单因素试验的基础上,选取料液比、提取时间、提取温度进行3因素3水平[L9(33)]正交试验(表1)。正交试验的验证按照所确定的最优提取工艺进行,按‘1.2.3’的方法计算多糖含量。

表1 正交试验因素水平Table1 Factors and levels of orthogonal test
1.2.6 方法学考察
1.2.6.1 溶液制备
准确称取葛仙米100.0 mg置于具塞三角瓶中,采用最优条件进行提取,离心、取上清液稀释10倍作为待测溶液。
1.2.6.2 精密度考察
取待测溶液重复测定6次,计算出多糖的含量和相对标准偏差(RSD)。
1.2.6.3 重现性考察
取葛仙米多糖样品6份,测定、计算出多糖的含量和相对标准偏差(RSD)。
1.2.6.4 稳定性考察
取待测溶液,每隔1 min测定1次,连续记录60 min考察稳定性,计算出多糖的含量和相对标准偏差(RSD)。
1.2.6.5 加样回收率考察
精密移取待测多糖溶液6份,按样品含量与葡萄糖对照品含量比例(1∶1)加入对照品,计算出多糖的含量和相对标准偏差(RSD),计算加样回收率。
1.2.7 统计分析
采用Stata软件进行方差分析,P≤0.05表示差异显著。
2 结果与分析
2.1 葛仙米中多糖含量测定的干扰物质分析
对葛仙米水提物中的单糖、二糖进行分析,并与标准品进行比对和定量(图1),结果发现:葛仙米中可溶性的单糖和二糖均含量极低,其中赤藓糖醇、海藻糖和葡萄糖的含量分别为0.04%、0.07%、0.008%,而葛仙米原料中水溶性多糖含量在30%左右。
2.2 葛仙米水溶性多糖提取条件的单因素结果分析
未浸泡的葛仙米水溶性多糖的含量最低,浸泡3 h的葛仙米多糖的含量最高,但浸泡时间对多糖溶出无显著性影响(图2a)。随着温度的升高,多糖含量显著增加,100℃时多糖溶出度最高,且各温度处理间差异显著(图2b)。加热时间是影响多糖从胞内溶出的一个重要因素,随着加热时间的增加,多糖含量逐渐升高。当加热时间为5 h时,葛仙米水溶性多糖的含量最高,且各处理间差异显著,说明温度对提取葛仙米水溶性多糖含量的影响较大(图2c)。当料液比在1∶200—1∶500时,多糖含量随着料液比的增加而提高;料液比为1∶1 000时,葛仙米水溶性多糖的含量下降(图2d),原因可能是提取溶剂的增加改变了细胞内外的渗透压,不利于多糖的溶出,因此选择料液比1∶500。
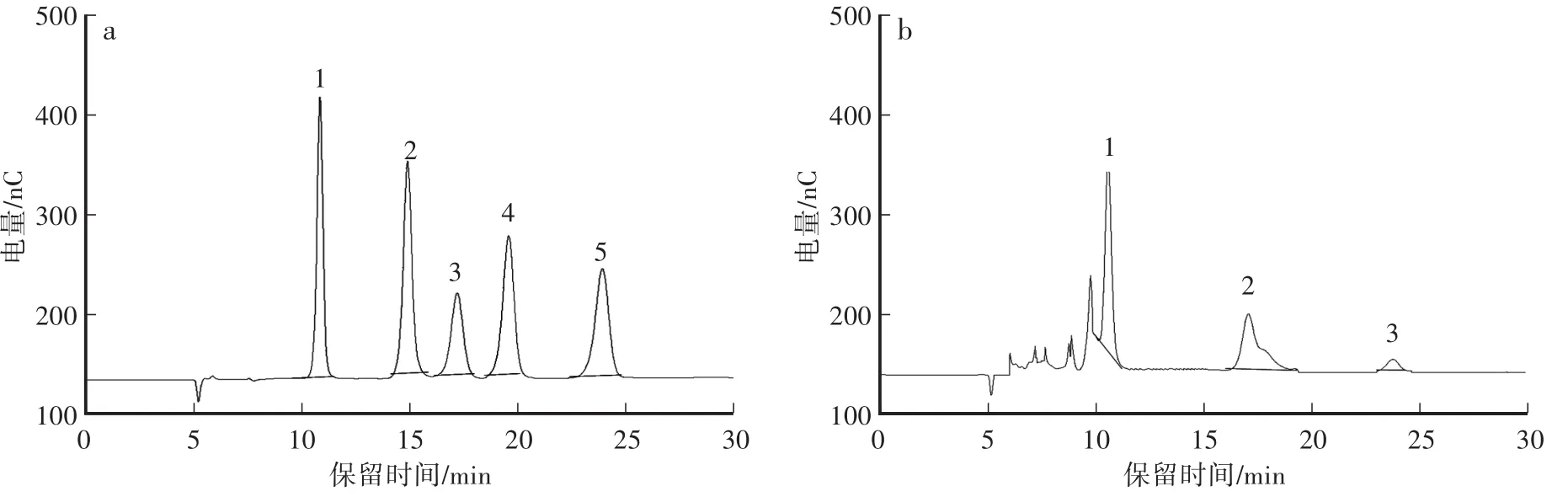
图1 标准品(a)与葛仙米中(b)的单糖和二糖离子色谱图Fig.1 Chromatograms of Monosaccharide and disaccharide of standard(a)and Nostoc sphaeroides kutz(b)
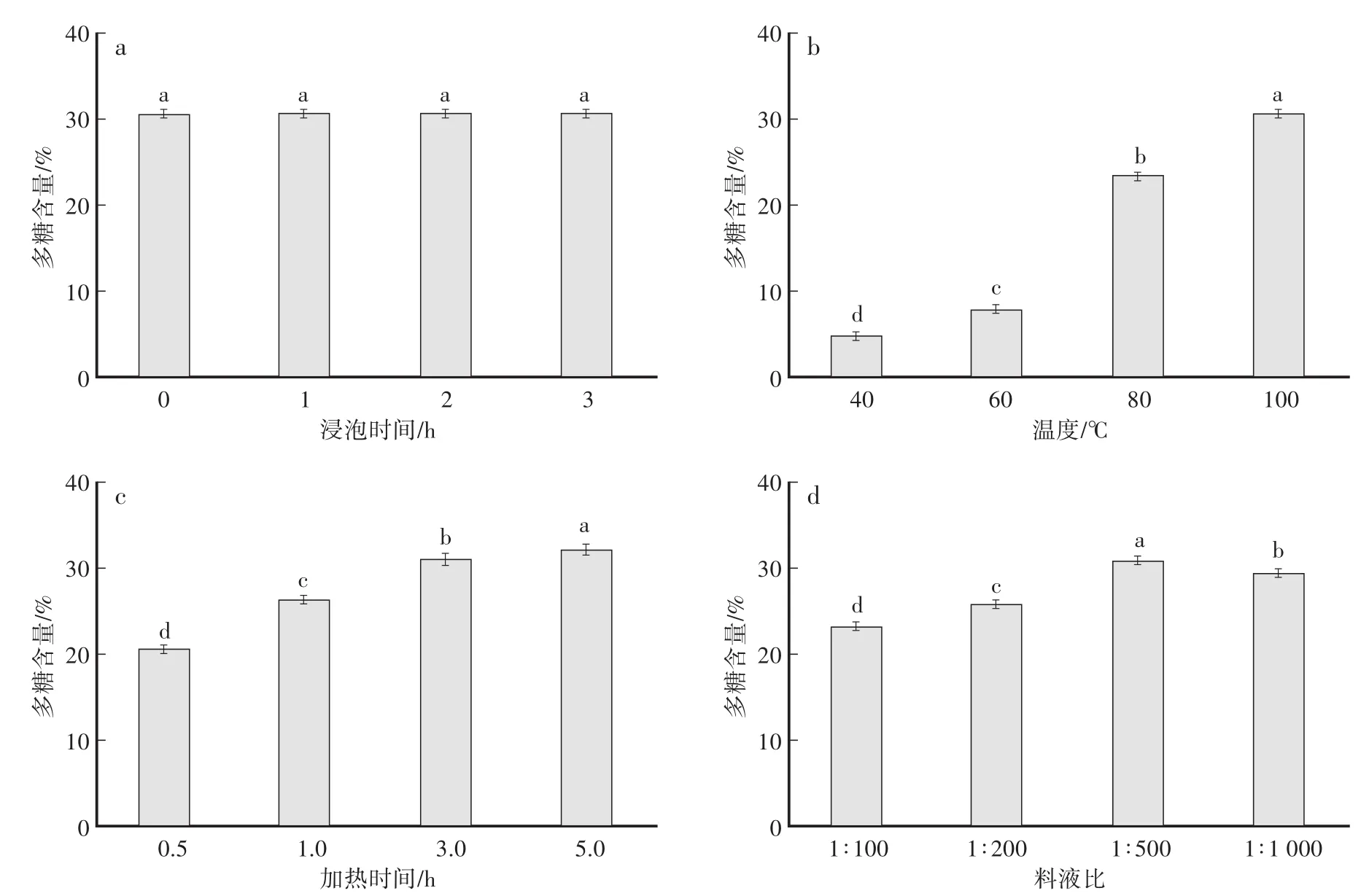
图2 提取条件对葛仙米水溶性多糖含量的影响Fig.2 Effect of extraction conditions on extraction content of Nostoc Sphaeroides kutz water-soluble polysaccharide
2.3 葛仙米水溶性多糖正交试验分析
从表2中的极差值大小可以看出,RA>RB>RC,影响因素的顺序为温度>时间>料液比。由均值大小可知,最优试验方案为:温度100℃、时间6 h、料液比为1∶1 000。

表2 正交试验结果(n=9)Table 2 Results of orthogonal experiments
对正交试验获得的最佳条件进行验证,料液比为1∶1 000和1∶500时,多糖的含量分别为32.98%和32.65%。由于两者无显著差异,为了节省成本,选择料液比为1∶500。
2.4 方法学考察结果
2.4.1 线性考察
根据标准曲线可知,葡萄糖标准溶液的浓度(y)与吸光度值(x)的线性回归方程y=0.1202x-0.0054,R2=0.9997,表明葡萄糖标准溶液浓度在0—0.1 mg/mL时,与吸光度值呈现良好的线性关系。

图1 葡萄糖标准曲线Fig.2 The standard curve
2.4.2 精密度、重现性、显色稳定性考察
由表3可见,苯酚-硫酸法测定葛仙米水溶性多糖的结果精密度高、重现性好及显色反应的稳定性良好,试验数据可靠。

表3 精密度、重现性、显色稳定性的考察结果Table 3 Results of Precision,reproducibility and color stability
2.4.3 加样回收率考察
如表4所示,较小的RSD值显示试验数据的可信度较大;加样回收率均值为100.13%,表明加样回收率高,测定值能够反应实际值。

表4 加样回收率结果(n=6)Table 4 Results of recovery rate experiment
3 结论与讨论
通过单因素和正交试验对葛仙米水溶性多糖测定的前处理条件进行优化,获得了最佳提取条件为温度100℃、时间6 h、料液比1∶500,运用优化的提取条件,用苯酚硫酸法测定发现葛仙米中多糖含量为32.65%,该方法稳定性好,精密度高,重现性好,适合葛仙米中多糖含量的测定。
葛仙米原料中多糖含量高、黏度大[19-21],运用常用的原料预处理方法不能将其中的多糖充分提取出来,通过单因素和正交试验的优化,发现其合适的料液比为1∶500,远远高于一般的多糖提取中使用的1∶50—1∶100,同时提取时间需要到6 h,也比一般的多糖提取时间1—2 h长[22-24]。通过对提取方法的优化,葛仙米中水溶性多糖含量测定稳定,为葛仙米多糖产品的开发奠定了基础。
一般多糖的测定大多需要用水提醇沉去除单糖和寡糖等成分的干扰,或采用多糖减去寡糖的方法。通过阴离子色谱检测发现葛仙米水提物中干扰物质影响较小,所以在多糖含量测定时前处理中不需要进行乙醇沉淀去除干扰物质,可直接用水提物进行分析。
