黄瓜植株对高温闷棚的生理响应
2019-11-08张红梅金海军杨学科丁小涛崔佳维卜立君余纪柱
张红梅,金海军*,杨学科,丁小涛,崔佳维,卜立君,余纪柱**
(1上海市设施园艺技术重点实验室,上海市农业科学院设施园艺研究所,上海201403;2 232152部队,石家庄050081;3上海孙桥溢佳农业技术股份有限公司,上海201210)
植物诱导抗病性的研究工作始于20世纪50年代,随着植物诱导抗病性研究的不断发展,物理诱导因子因具有安全、应用方便的特点受到人们的重视,尤其以生态因子作为诱导因子的抗病性研究倍受关注[1]。研究发现,某些生态压力,如高温、高湿、低湿等条件可以诱导寄主植物的系统抗病性(ISR)[2-5]。在黄瓜生产中高温闷棚是生态防治中最具有代表性、成效最明显的方法。目前,关于高温闷棚防治黄瓜病虫害方面的研究已有一些报道。王其枝等[6]认为,使棚内温度达到38—52℃,可抑制病害的发生和危害,并可消灭害虫。Stermer等[7]曾用短暂热击法诱导黄瓜黄化苗及正常黄瓜苗对黄瓜黑星病(Cladosporium cucumerinumEll.et Arth.)的抗性,黄瓜幼苗经50℃水浴40—50 s后,抗病性明显增强。张富荣等[8]研究认为,在日光温室高水肥管理的条件下,高温闷棚对黄瓜白粉病的发生有一定的抑制作用。以上研究都集中在高温闷棚的方式方法以及防治效果上,而对植物生长过程中通过环境条件及生态压力的调控来激发其自身抗病性反应机制的研究较少,因而限制了生态防治在病害防治中的应用。本试验在黄瓜耐高温研究的基础上,对高温闷棚条件下黄瓜植株的光合参数、生理指标以及病害变化情况进行研究,以期为生态防治方法更好地应用于田间生产提供一定的理论依据。
1 材料与方法
1.1 试验材料
大棚所种黄瓜品种为‘春秋王2号’,欧洲类型短黄瓜,由上海市农业科学院设施园艺研究所提供。
1.2 试验方法
1.2.1 育苗及定植
试验于2015年9—12月在上海市农业科学院庄行综合试验站的两个塑料大棚中进行。大棚为南北走向,钢骨架结构,棚高2.3 m,宽8 m,长40 m,PE膜,薄膜厚度0.10 mm,使用期1年。每棚作5畦,畦面和畦沟全部铺上黑色地膜,地膜下铺滴灌管进行水分管理。9月1日将饱满的黄瓜种子直播于50孔穴盘中,育苗基质为草炭∶蛭石∶珍珠岩=7∶2∶1。9月9日幼苗长到1叶1心时定植到大棚中,缓苗后采用膜下滴灌方式进行浇水,保证每次每棚滴水时间一致,其他按常规方法管理。
1.2.2 高温闷棚方法
2015年10月12日(晴朗天气)上午9:00(室外温度达到20℃)进行闷棚,黄瓜植株处于开花结果前期。将其中一个棚进行高温闷棚,闷棚前打开滴灌浇足水,并在垄沟上洒水,在大棚中部距离地面0 m、1 m、1.5 m、2 m的位置各放置一个温湿度记录仪(WS-TH,杭州微松环境科技有限公司),将大棚卷帘和进出门关闭,大棚内最高温度控制在45—50℃,持续2 h后,逐渐通风降温。另外一个棚正常管理作为对照。
1.2.3 测定项目及方法
在闷棚前9:00、闷棚结束时11:30、闷棚后当天下午1:00、恢复1 d、恢复2 d和恢复3 d后的9:00取叶片(生长点下第6片叶)-80℃保存,用来测定各项生理指标。利用LI-6400光合仪(美国LI-COR公司)测定黄瓜叶片净光合速率(Pn)、气孔导度(Gs)、胞间 CO2浓度(Ci)和蒸腾速率(Tr)(闷棚结束时11:30不测),测定时光照强度约为30 000 lx,CO2浓度为(400±10)μL·L-1;超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性、抗坏血酸过氧化物酶(APX)的测定参照吴雪霞等[9]的方法。可溶性蛋白含量采用考马斯亮蓝G250法测定[10],丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定[10],脯氨酸含量采用磺基水杨酸提取法测定[10]。
闷棚前1天和闷棚后第5天调查霜霉病和白粉病的病情指数。
霜霉病严重度分级标准[11]。0级:无病斑;1级:有微小病斑,其直径小于0.5 cm,病叶占全株真叶数的10%以下;2级:病斑黄化面积占整个叶面积的1/2以下,坏死斑占1/3以下,病叶占全株真叶数的10%—25%;3级:坏死斑面积占整个叶面积1/3—2/3,病叶占全株真叶数的25%—50%;4级:坏死斑面积占整个叶面积2/3以上,病叶占全株真叶数的50%以上,病叶大部分枯黄,全株枯死。
霜霉病病情指数=Σ(每个病级植株数量×级别数量)/(总植株数量×发病最高级别数量)×100。
黄瓜白粉病严重度分级标准[12]。0级:无病斑;1级:有少数抗病型病斑;2级:有多数抗病型病斑或感病型病斑,占叶面积1/3以下;3级:感病型病斑面积占叶面积1/3—1/2;4级:感病型病斑面积占叶面积1/2—2/3;5级:感病型病斑面积超过叶面积2/3,叶片干枯。
白粉病病情指数=Σ(每个病级植株数量×级别数量)/(总植株数量×发病最高级别数量)×100。
每个指标测定重复3次,取平均值。数据采用Excel2003软件进行处理,用OriginPro 8.0软件进行绘图,用SPSS 20.0统计软件进行方差分析和Tukey多重比较。
2 结果与分析
2.1 高温闷棚期间大棚内空气温度变化情况
从图1可以看出,高温闷棚时,大棚上部的空气温度高于下部,地表温度最低。从上午9:00开始闷棚,9:30棚内2 m处空气温度达到40.5℃,地表温度为35.9℃。10:00—11:30,大棚内2 m处(生长点位置)空气温度一直保持在49℃—50℃,1 m和1.5 m处空气温度也达到了40℃以上。11:30开始,对大棚东、西风口开放小口(20 cm风口),12:30逐步将风口开放至最大进行通风。空气温度逐渐下降,12:30时降到41℃。从9:30—11:30,大棚温度维持在40—50℃。
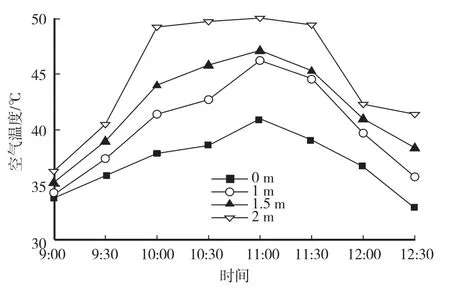
图1 高温闷棚期间大棚内空气温度变化Fig.1 Change of air temperature in greenhouse during high temperature control
2.2 高温闷棚对黄瓜植株叶片光合参数的影响
由图2A可知,进行高温闷棚的大棚中黄瓜植株叶片的Pn值与对照相比均有所降低,闷棚结束后当天下午测得的Pn值最低,只有14.46μmol·m-2·s-1,下降了10.86%,与对照相比差异显著。恢复1—3 d后,Pn有所回升,第3天的Pn值与对照无显著差异。处理棚黄瓜植株叶片的Gs在闷棚后高于对照棚,差异显著,说明植株在高温下增大了气孔导度,以带走更多的热量(图2B)。处理棚和对照棚Ci值的变化无显著差异(图2C)。处理棚的蒸腾速率Tr在闷棚结束后当天下午低于对照棚,两者差异显著;恢复1 d后Tr值最高,处理和对照间无显著差异;而恢复2 d和3 d后的数值较低,这与当时的太阳辐射和棚内温度有关(图2D)。
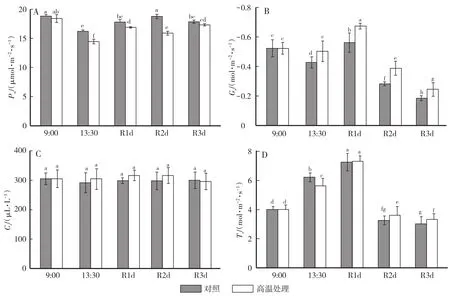
图2 高温闷棚对黄瓜植株叶片光合参数变化的影响Fig.2 Effects of high temperature control on photosynthetic parameters of cucumber leaves
2.3 高温闷棚对黄瓜植株叶片抗氧化酶活性的影响
从图3可以看出,处理棚黄瓜植株叶片的POD、CAT和APX活性在闷棚当天以及恢复1 d时均高于对照棚,且差异显著(恢复1 d的CAT值除外)。处理棚黄瓜植株的POD和APX活性在恢复1 d后达到最高值,分别为0.867μmol·mg-1·min-1FW和0.199μmol·mg-1·min-1FW,比对照增加了122.05%和26.75%。CAT活性在闷棚当天13:30达到最高值0.013μmol·mg-1·min-1FW,比对照增加了85.71%(图3B)。SOD活性变化幅度不大,在闷棚当天13:30和恢复1 d后活性稍高于对照,差异不显著,之后有所下降(图3D)。

图3 高温闷棚对黄瓜植株叶片抗氧化酶活性变化的影响Fig.3 Effects of high temperature control on the activities of antioxidant enzymes of cucumber leaves
2.4 高温闷棚对黄瓜植株叶片脯氨酸和丙二醛含量的影响
从图4A可以看出,高温闷棚后,黄瓜植株叶片中的脯氨酸含量增加,闷棚当天下午以及恢复1 d和3 d时,分别比对照增加了9.69%、9.85%和57.38%,差异显著。丙二醛含量在闷棚当天13:30增加最多,比对照高25.58%,差异显著,其他时间与对照差异不明显(图4B)。
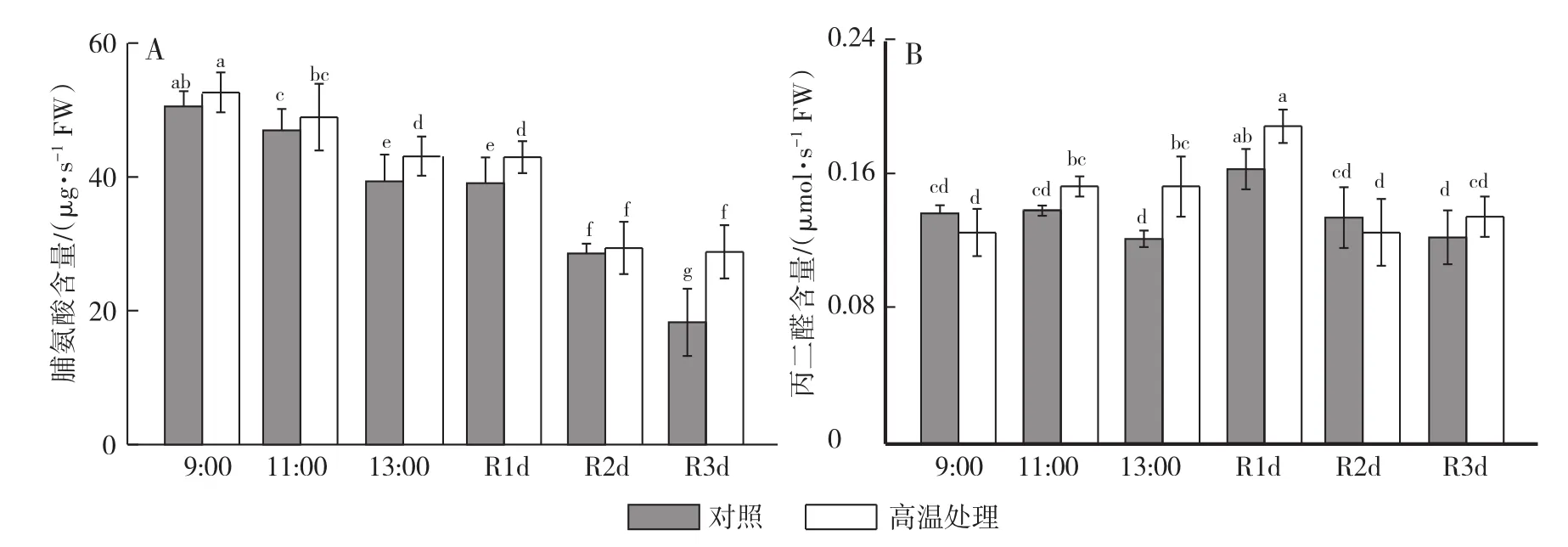
图4 高温闷棚对黄瓜植株叶片脯氨酸和MDA含量变化的影响Fig.4 Effects of high tem perature control on the content of proline and MDA of cucumber leaves
2.5 高温闷棚前后大棚内黄瓜霜霉病和白粉病病情指数的变化
从表1可以看出,闷棚前,对照棚黄瓜植株有白粉病和霜霉病,处理棚只有霜霉病。闷棚后两个棚的病情指数均有所增加,但处理棚增加的幅度明显小于对照棚。闷棚后处理黄瓜棚霜霉病病情指数增加29.20%,比对照棚减少37.44%,白粉病病情指数增加28.64%,比对照棚减少26.89%。由此看见,高温闷棚对黄瓜霜霉病和白粉病的防治具有一定效果。
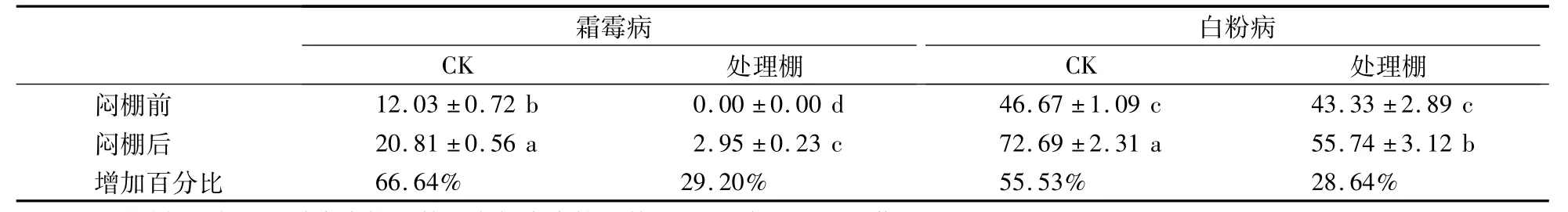
表1 高温闷棚前后大棚内黄瓜霜霉病和白粉病的病情指数Table 1 Disease index of downy m ildew and powdery m ildew of cucumber before and after high tem perature treatment in greenhouse
3 结论与讨论
高温闷棚时,棚内温度与棚外气温有关。当棚外气温低于15℃时,棚内最高温度达不到46.0—48.5℃,对黄瓜霜霉病、白粉病、细菌性角斑病基本上没有抑制效果[13]。本试验是当棚外气温达到20℃时,开始进行闷棚,从10:00到11:30,棚内生长点处的温度处于49—50℃。如果超过50℃的时间持续2 h以上,部分植株嫩叶会出现萎蔫现象,对植株造成一定伤害[13]。因此,闷棚过程中要时刻对温度进行监测,尤其是生长点处的气温,以确保植株的安全。
光合作用是植物合成有机物质和获得能量的根本源泉[14]。温度是影响植物光合作用的一个很重要的因子。郝婷等[15]研究认为,高温处理后黄瓜叶片光合速率明显降低。如果光合速率的降低伴随着气孔导度和细胞间隙CO2浓度的降低,就说明是气孔导度降低限制了外界CO2通过气孔进入细胞间隙,并进一步降低了光合速率,属于气孔限制。但是,有时也会出现光合速率降低而细胞间隙CO2浓度保持恒定的情况,这仍属于气孔限制,其原因是气孔发生了不均匀关闭[16]。许多试验已证实了这一现象[17-18],本试验结果也属于第二种情况,进行高温闷棚的大棚中黄瓜植株叶片的净光合速率有所降低,但细胞间CO2浓度变化不大。
研究发现,短时间高温处理黄瓜后,可诱导其体内产生一系列的抗病性反应,这些反应体现在一系列生理生化指标的变化上[19]。SOD、POD、CAT、APX等抗氧化酶类在植物体内具有协同作用,在胁迫条件下能够清除过量的自由基,维持代谢的平衡,从而使植物在一定程度上忍耐、减轻或抵御胁迫伤害[2]。前人研究发现,甜椒[20]、甜瓜[21]及黄瓜[22]在高温处理后 SOD、POD、CAT和 APX活性增加。张富荣等[8]研究认为,高温闷棚后黄瓜植株通过提高抗氧化酶活性来增加对白粉病的抗性。本研究中高温闷棚后黄瓜植株叶片中的POD、CAT和APX活性增加明显,SOD稍有增加,脯氨酸和丙二醛的含量也高于对照,说明短时间的高温提高了植株体内的抗氧化酶活性。当植物受到病原物侵染时,植物可以识别入侵的病原体,启动体内一系列的防御反应,以减缓或抑制病原物的扩散或再侵染,活性氧迸发是植物对病原菌应答的最早期反应之一[23],而防御酶可以清除这些活性氧。丙二醛含量的增加说明热胁迫引起的膜脂过氧化作用破坏了质膜结构,而游离脯氨酸具有调节渗透及保护细胞膜结构的作用,植物在逆境条件下游离脯氨酸的积累将会提高植物对逆境的忍耐力或适应力[24]。本研究中进行高温闷棚的大棚中黄瓜植株白粉病和霜霉病的病情指数与对照相比明显下降,说明高温闷棚对病害的防治具有一定效果,这与许多研究报道相一致[2,6,8,13],也充分证明了高温诱导处理激发了植株体内一系列抗病过程,从而降低了病菌对植株的侵害。
综上所述,高温闷棚可以通过提高植株防御酶活性和渗透调节物质含量,有效清除活性氧,降低膜脂过氧化伤害,从而增强植株对病菌的抵抗能力。因此,在实际生产中,可以利用生态压力激发植株的系统抗病性。每茬黄瓜高温闷棚次数应视病虫发展和作物生长状况而定,每次间隔12—15 d为宜。一般来说,高温闷棚3次后,黄瓜霜霉病和白粉病得到控制。
