一种螯合型Fe2+探针的构筑及性质
2019-11-08李泽冉朱健萍于涵洋陈韵聪何卫江郭子建
李泽冉 朱健萍 于涵洋 陈韵聪*, 何卫江 郭子建*,
(1南京大学化学化工学院,配位化学国家重点实验室,南京 210093)(2南京大学现代工程与应用科学学院,南京 210008)
铁是人体中含量较为丰富的必需过渡金属元素[1-2],在酶促反应[3-4]、电子传递[5]及氧气运输[6]等多种生理过程中发挥重要的作用。生命体通过复杂而精细的调节机制来维持铁离子的平衡。过量的铁离子会导致活性氧物种含量异常,进而造成细胞损伤和器官功能紊乱[7-8]。铁离子平衡的破坏与一系列重大疾病相关,如肝炎、癌症以及阿尔兹海默病与帕金森病等神经退行性疾病。在细胞的还原性环境中,铁离子大多以Fe2+的形式存在[9-11]。利用荧光探针检测Fe2+在生命体系中的实时分布信息对于理解铁离子相关的生物学过程具有重要的意义。
目前报道较多的Fe2+探针主要分为反应型和螯合型。反应型Fe2+荧光探针发展比较成熟,大致可分为两类。一类是Fe2+与罗丹明上的氮氧自由基反应[12-13],反应后的罗丹明会发出荧光,达到检测Fe2+的目的。另一类是利用Fe2+的催化水解作用,使得探针分子中的酰胺键水解[14-15],恢复荧光信号。螯合型的Fe2+荧光探针[16]是利用N,O等原子与Fe2+的配位作用,使得探针分子的构象[17]或发光性能[18]发生变化,从而反映Fe2+的水平。我们选择稳定性好、量子产率高的BODIPY[19-21]为荧光基团,对Fe2+有较高结合能力的三联吡啶为螯合团,通过苯乙烯基将荧光团与螯合团连接起来,构建了新型Fe2+螯合型探针BTPY,利用紫外吸收和荧光强度的变化实现了Fe2+特异性识别,并能有效区分Fe3+。
1 实验部分
1.1 试剂和仪器
所有药品及试剂购自安耐吉、希恩斯或北京伊诺凯试剂公司,使用前均未经过进一步的处理。光谱性质测试中,所用溶剂为光谱纯试剂,购自Aldrich公司,水为MILLIPORE处理过的超纯水。荧光光谱用FluoroMax-4光谱仪测试,紫外可见吸收光谱在Perkin-Elmer lambda 35光谱仪上测定。荧光光谱和紫外可见吸收光谱数据用Origin软件处理。探针BTPY的1H NMR和13C NMR谱在Bruker AVANCEⅢ400和Bruker DPX 300核磁仪上用标准脉冲序列测定,用TMS作内标。电喷雾质谱用LCQ电喷雾质谱仪(ESMS,Finnigan)测定,并用 ISOPRO 3.0 程序模拟其同位素分布。
1.2 化合物BTPY及中间体的合成和表征
1.2.1 化合物1的合成
将 4-甲基苯甲醛(9.00 mL,76.38 mmol),2-乙酰基吡啶(9.00 mL,72.39 mmol)加入2%的NaOH水溶液(150 mL)中,室温下搅拌6 h。将2-乙酰基吡啶(9.00 mL,72.39 mmol)加入反应体系,调节NaOH水溶液的浓度为20%。60℃下加热搅拌6 h,冷却至室温并过滤,得到黄色滤渣。将滤渣用无水乙醇重结晶,得到浅白色针状晶型化合物1[22],产率:20%。1H NMR(300 MHz,CDCl3):δ2.43(s,3H),7.32(d,2H,J=8.5 Hz),7.36(ddd,2H,J=7.7,4.8,1.2 Hz),7.83(d,2H,J=8.2 Hz),7.89(td,2H,J=7.7,1.8 Hz),8.68(dt,2H,J=8.0,1.1 Hz),8.72~8.76(m,4H)。
1.2.2 化合物2的合成
将化合物1(1.0 g,3.1 mmol)加入四氯化碳溶液(20 mL)中,搅拌15 min。向反应体系中加入过氧化二苯甲酰 (0.05 g,0.2 mmol)和N-溴代琥珀酰亚胺(1.23 g,6.2 mmol),加热回流24 h。将溶液冷却至室温并旋蒸除去溶剂。将得到的黄色固体加入碳酸钙(1.0 g,10 mmol),1,4-二氧六环(40 mL)和水(10 mL)的混合溶液中,回流24 h。冷却至室温,旋蒸,硅胶柱层析分离(乙酸乙酯/石油醚,1∶1,V/V)得到白色固态的化合物2[23],产率为23%。1H NMR(300 MHz,CDCl3):δ7.39(ddd,2H,J=7.5,4.8,1.1 Hz),7.92(td,2H,J=7.8,1.7 Hz),8.01~8.11(m,4H),8.70(dt,2H,J=8.0,1.1 Hz),8.75(ddd,2H,J=4.8,1.9,0.9 Hz),8.80(s,2H),10.12(s,1H)。
1.2.3 化合物3的合成
N2保护下, 将 4-甲氧基苯甲醛 (1.36 g,10 mmol),2,4-二甲基吡咯(2.09 g,22 mmol)加入二氯甲烷(400 mL)中,再加入1滴三氟乙酸,在室温下搅拌。 12 h 后加入 2,3-二氯-5,6-二氰对苯醌(2.72 g,12 mmol),室温搅拌。12 h后加入三乙胺(15 mL),2 min后再加入三氟化硼乙醚(18 mL)。反应体系室温搅拌5 h后,旋蒸,用乙酸乙酯萃取。取有机相,用饱和食盐水洗涤,无水硫酸镁干燥。旋蒸除去溶剂,硅胶柱层析分离(乙酸乙酯/石油醚,1∶15,V/V)得到红色晶状的化合物3[24],产率为38%。1H NMR(300 MHz,CDCl3):δ1.43(s,6H),2.55(s,6H),3.87(s,3H),5.97(s,2H),7.01(d,2H,J=8.8 Hz),7.17(d,2H,J=8.8 Hz)。
1.2.4 化合物BTPY的合成

图1 探针BTPY及其中间体的合成路线Fig.1 Synthesis of probe BTPY and its intermediates
在微波反应器中,加入化合物2(53.5 mg,0.15 mmol),化合物 3(50.67 mg,0.15 mmol),冰醋酸(0.35 mL),哌啶(0.325 mL,3.28 mmol)和分子筛,以二甲基甲酰胺(10 mL)为反应溶剂。微波反应10 min,旋蒸除去溶剂,硅胶柱层析分离(甲醇/二氯甲烷,1∶20,V/V)得到紫色固态的目标化合物(E)-3-(4-((2,2′∶6′,2″-terpyridin)-4′-yl)styryl)-5,5-difluoro-10-(4-methoxyphenyl)-1,7,9-trimethyl-5H-5λ4,6λ4-dipyrrolo[1,2-c∶2′,1′-f][1,3,2]diazaborinine,命名为 BTPY,产率为 16%。1H NMR(400 MHz,CDCl3):δ1.47(s,3H),1.51(s,3H),2.63(s,3H),3.89(s,3H),6.03(s,1H),6.65(s,1H,CH),7.03(d,J=8.2 Hz,2H),7.22(d,J=8.4 Hz,2H),7.29(d,J=10.6 Hz,1H),7.39(dd,J=7.6,5.6 Hz,2H),7.73(d,J=5.5 Hz,2H),7.77(d,J=11.3 Hz,1H),7.88~7.99(m,4H),8.70(d,J=8.0 Hz,2H),8.74~8.80(m,4H)。13CNMR(100 MHz,CDCl3):δ14.67,14.81,55.33,114.54,117.57,118.76,119.95,121.53,123.93,127.04,127.64,127.99,129.39,132.57,133.28,134.89,137.17,137.42,138.38,140.76,142.27,143.39,148.94,149.61,151.96,155.74,155.96,160.17。 ESI-MS(positive mode,m/z):Calcd.674.29,Found:674.42 for[M+H]+。
1.3 探针BTPY光谱性质测试
BTPY用光谱纯DMF(N,N-二甲基甲酰胺)配制成1.0 mmol·L-1的储备溶液放置在4℃冰箱中备用。光谱测试在PBS缓冲溶液体系(10 mmol·L-1,pH=7.40)或光谱纯DMF中进行。向3 mL BTPY(10 μmol·L-1)的 PBS缓冲溶液和DMF溶液中,分别加入不同体积的FeCl2水溶液(1 mmol·L-1),每次加入30μL,充分混合均匀后分别进行荧光光谱滴定和紫外可见吸收光谱滴定测试。
国内对高校实验室安全管理方面的研究较晚,通过学习国外的相关研究以及结合国内高校实验室的具体情况,部分研究者曾试图通过建立安全管理体系,来减少实验室事故的发生.如叶秉良等通过结合浙江理工大学实验室安全管理的具体情况,从实验室布置、安全检查、技术防范、应急预案等几个方面构建我国高校实验室安全管理体系的基本思路[4].李家祥通过研究分析实验室安全管理中存在的问题及原因,构建了安全建防、安全采购、安全教育等管理举措,从而来提高实验室的安全[5].此外,还有部分学者尝试利用层次分析法、模糊评价、BP神经网络等方法对实验室安全管理进行了科学有效评价.
1.4 探针BTPY金属离子选择性测试
向 3 mL BTPY(10 μmol·L-1)的溶液中加入相应浓度的金属离子溶液,充分混合均匀后进行测试。其中, 加入的 K+,Ca2+,Na+,Mg2+离子浓度为 1 mmol·L-1,其余金属离子浓度为 100 μmol·L-1。
1.5 结合常数测试
向 3 mL BTPY(10 μmol·L-1)的 DMF 溶液中,分别加入不同体积的 FeCl2水溶液 (1 mmol·L-1)或Fe(NO3)3·9H2O 水溶液(1 mmol·L-1),每次加 30 μL,充分混匀后进行测试。结合常数根据如下公式拟合:
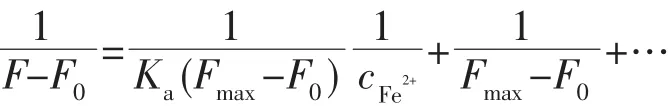
其中F0为探针BTPY在不加Fe2+时,628 nm处的荧光强度。F为加入不同浓度的Fe2+时628 nm处的荧光强度。探针BTPY与Fe2+的结合常数Ka是通过1/(F-F0)对1/cFe2+作图得到的。1/(F-F0)与1/cFe2+呈线性关系,参照公式,由截距与斜率的比值得到Ka的值。
1.6 结合比测试
在3 mL探针BTPY的DMF溶液中,保持BTPY 与 Fe2+的总浓度为 30 μmol·L-1,调整 BTPY 与Fe2+的不同比例,测试紫外吸收强度。以607 nm处的吸光度对cFe2+/(cFe2++cBTPY)作图,通过数据点拟合2条直线,通过2条直线的交点得到探针BTPY与Fe2+的结合比。
2 结果与讨论
2.1 探针BTPY的光谱性质
如图 2a 所示,BTPY(10 μmol·L-1)在 10%(V/V)DMF的PBS缓冲溶液(pH=7.40)中有543和584 nm两个最大吸收峰。其原因是BODIPY与TPY之间的苯乙烯基使得整个分子形成大的共轭体系,使得吸收波长较长。如图2b荧光光谱所示,BTPY最大激发波长为582 nm,最大发射波长为678 nm,斯托克斯位移是96 nm。激发波长在可见光区,荧光发射波长则进入近红外区。

图2 BTPY在10%(V/V)DMF的PBS缓冲溶液中的紫外-可见吸收光谱(a),荧光激发和发射光谱(b);BTPY在DMF中的紫外-可见吸收光谱(c),荧光激发和发射光谱(d)Fig.2 UV-Vis absorption spectrum(a),excitation and emission spectra(b)of BTPY obtained in PBSbuffer containing 10%(V/V)DMF;UV-Vis absorption spectrum(c),excitation and emission spectra(d)of BTPY obtained in DMF
而图2c和d显示,BTPY在纯DMF中的紫外-可见吸收光谱与其在PBS缓冲溶液中明显不同,最大吸收波长为573 nm,同时532 nm处有一个相对较弱的吸收峰。荧光光谱也发生了变化,最大激发和发射波长分别为573和628 nm,较10%(V/V)DMF中的发射波长蓝移了50 nm,依然在近红外区。这表明不同的溶剂对BTPY的发射波长有很大影响。
2.2 探针BTPY与Fe2+作用的光谱研究
而探针BTPY在DMF中加入 100μmol·L-1的Fe2+,荧光几乎完全猝灭(图3b)。这应当与探针BTPY在DMF溶液中的溶解度相关,在纯DMF溶剂中,BTPY的溶解度更大,使得与Fe2+的结合能力增强,荧光能够被完全猝灭。
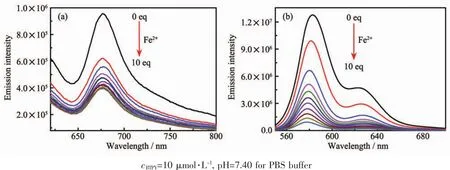
图3 Fe2+对BTPY的荧光滴定曲线:(a)在10%(V/V)DMF的PBS缓冲溶液;(b)在DMF中Fig.3 Emission spectra of BTPY upon Fe2+titration:(a)in PBSbuffer containing 10%(V/V)DMF;(b)in DMF
当10%(V/V)DMF的PBS缓冲溶液 (pH=7.40)体系中分别加入过量的Fe2+和 Fe3+(100μmol·L-1),紫外吸收峰的波长并没有发生明显的变化(图4),仅仅强度稍有下降,可能的原因是在该缓冲溶液体系中,Fe2+和Fe3+与探针结合能力较弱,因此引起的紫外光谱变化很小。
BTPY的 Fe2+和Fe3+的紫外滴定在DMF中完成。如图5,当逐渐增大金属离子浓度,BTPY在573 nm处的吸收峰随金属离子浓度增大而降低,同时在607 nm处出现一个新的吸收峰,并且随着Fe2+或Fe3+的加入而逐渐增强。这与文献报道过的Fe2+会使螯合基团的吸收峰红移,即出现MLCT吸收峰吻合。实验也表明,除了Fe2+之外,Fe3+的加入也会使光谱中出现MLCT吸收带。
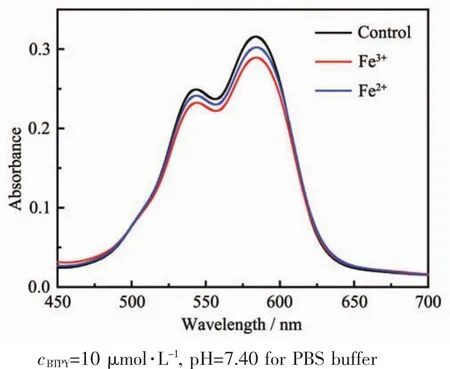
图4 在10%(V/V)DMF的PBS缓冲溶液中,BTPY对Fe2+和Fe3+的紫外响应情况Fig.4 UV-Vis spectra of BTPY obtained in PBSbuffer containing 10%(V/V)DMF upon addition of Fe2+and Fe3+
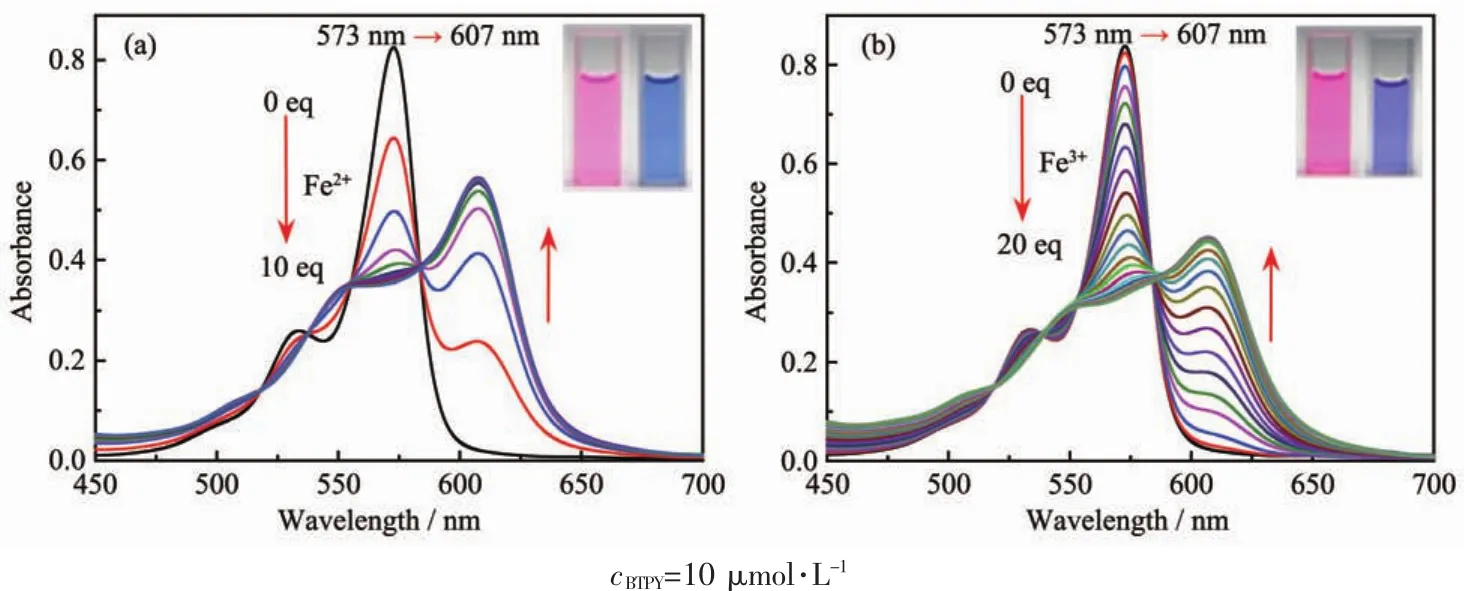
图5 在DMF中Fe2+(a)和Fe3+(b)对BTPY的紫外滴定曲线和颜色变化Fig.5 UV-Vis absorption spectra and color change of BTPY obtained in DMF upon Fe2+(a)and Fe3+(b)titration

图6 在DMF中BTPY对常见金属离子的紫外光谱响应Fig.6 UV-Vis absorption response of BTPY to common metal cations in DMF
探针BTPY对其它常见金属离子的紫外响应如图6所示。其它金属离子的加入,吸收峰不发生明显红移,同时溶液颜色也不发生变化。而Fe2+和Fe3+的加入使吸收光谱在607 nm处出现MLCT吸收带,溶液颜色由亮红色变为蓝紫色。探针BTPY对铁离子独特的紫外选择性,且溶液颜色发生明显变化,使得BTPY可用于铁离子的可视化识别。
2.3 探针BTPY与Fe2+结合比及结合常数的测定
在DMF中测定BTPY与Fe2+的紫外吸收Job曲线。固定 BTPY 与 Fe2+的总浓度为 30 μmol·L-1,改变BTPY与Fe2+的比例,得到不同比值下的紫外可见吸收光谱图。图7为根据607 nm处的紫外吸收强度得到的Job曲线。吸收强度最大时对应的Fe2+与总浓度的比值为0.56,这表明BTPY与Fe2+以1∶1的方式进行结合。

图7 在DMF中根据607 nm处的紫外吸光度测定的BTPY与Fe2+结合的Job曲线Fig.7 Job′s plot of BTPY upon addition of Fe2+in DMF determined by UV absorbance at 607 nm
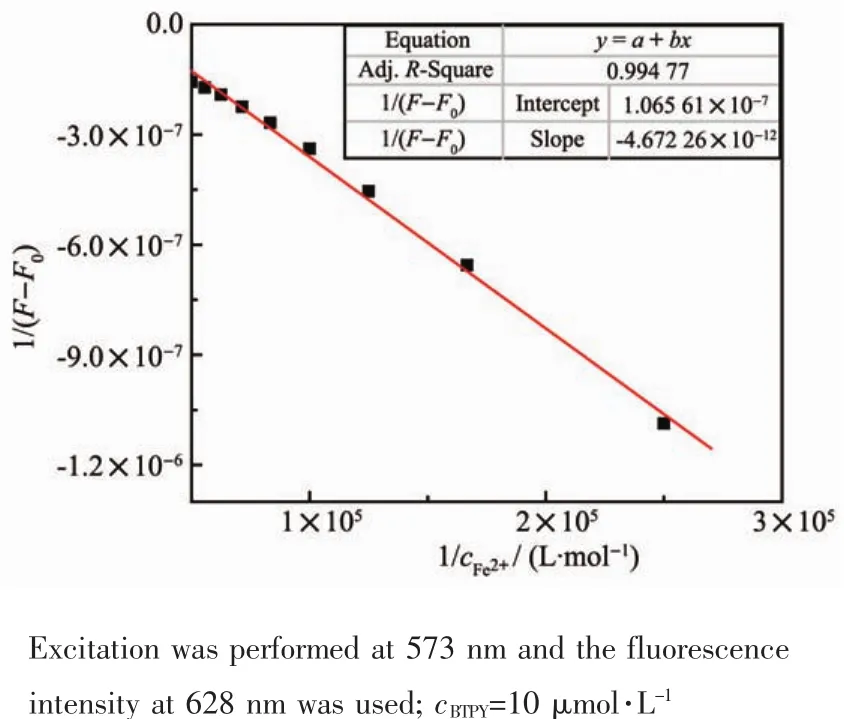
图8 BTPY与Fe2+在DMF中的Benesi-Hildebrand图Fig.8 Benesi-Hildebrand plot of BTPY upon addition of Fe2+in DMF
根据荧光滴定光谱,取628 nm处的荧光强度绘制了探针与Fe2+结合的Benesi-Hildebrand图(图8)。利用结合常数公式对其进行线性拟合,得到拟合直线的截距和斜率,由此计算得到Ka值为2.28×104L·mol-1。用同样的方法测得探针与Fe3+的结合常数为 1.82×104L·mol-1(图 9)。探针 BTPY 与 2种铁离子的结合常数相差不大。

图9 BTPY与Fe3+在DMF中的Benesi-Hildebrand图Fig.9 Benesi-Hildebrand plot of BTPY upon addition of Fe3+in DMF
2.4 探针BTPY对金属离子的选择性
如图10a所示,在10%(V/V)DMF的PBS缓冲溶液(pH=7.40)中,Fe2+和Cu2+对荧光有较强的猝灭作用,而其它金属离子对BTPY基本无响应行为。这说明BTPY对Fe2+和Cu2+有较强的结合能力。在纯DMF中(图 10b),探针 BTPY 除了对 Fe2+和 Cu2+有猝灭型响应行为以外,也对Ni2+有同样的荧光降低响应。这说明在DMF溶剂比例增大的情况下,BTPY与Ni2+也能够较强的结合。
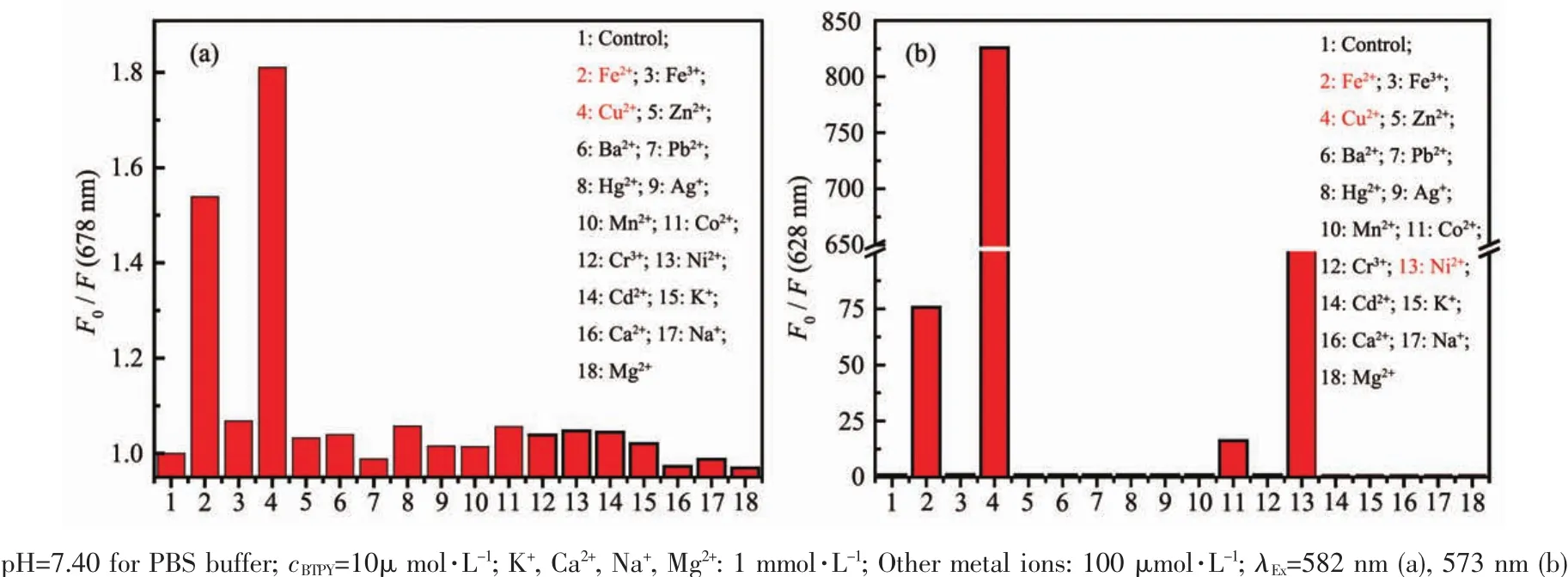
图10 在10%(V/V)DMF的PBS缓冲溶液(a)和DMF(b)中,BTPY在不同金属离子存在时荧光强度的变化Fig.10 Fluorescence intensity changes of BTPY in the presence of different metal ions in PBSbuffer solution containing 10%(V/V)DMF(a)and DMF(b)
3 结 论
选择量子产率较高的BODIPY作为荧光基团,对Fe2+有较好结合能力的TPY作为螯合基团,通过苯乙烯基将这2个基团连接起来,增大了分子内的共轭体系,使得探针BTPY的荧光发射进入近红外区。值得注意的是,在纯DMF中,BTPY对Fe2+和Fe3+有特异性的紫外响应,随着这2种金属离子的加入,其573 nm处的吸收峰红移到607 nm处,为典型的MLCT吸收带。同时,Fe2+和Fe3+的加入,会使溶液颜色由亮红色变为蓝紫色,而探针BTPY对其它离子则没有这种响应行为,因此,BTPY可用于铁离子的可视化识别。在10%(V/V)DMF的PBS缓冲溶液中,BTPY选择性地对Fe2+和Cu2+有荧光猝灭型响应,而对包括Fe3+在内的其它金属离子基本无响应行为。因此,只有Fe2+能同时引起BTPY紫外光谱的红移和荧光光谱的猝灭效应,可以实现对Fe2+的高度选择性检测。
