不同形态氮肥对紫花苜蓿生长、硝酸盐转运蛋白基因MtNRT1.3表达及氮吸收的影响
2019-11-07王玉强刘文涛赵国琦孙盛楠
王玉强,沈 宇,钱 进,刘文涛,赵国琦,孙盛楠
(扬州大学动物科学与技术学院,江苏 扬州 225009)
氮素是植物生长必不可少的大量营养元素,也是植物体内重要有机化合物的结构性元素,如蛋白质、核酸、叶绿素、酶和激素等;同时又是作物高产、品质优良的重要影响因素[1]。土壤中主要存在2种形态氮源,铵态氮和硝态氮,植物主要通过根系吸收土壤中的铵态氮和硝态氮,而不同形态的氮素会影响植物的氮素同化、光合作用以及植物体内阴阳离子的平衡,从而对植物生长产生不同的效应[2-3]。
铵态氮和硝态氮是植物吸收的主要氮素形式,吸收量占吸收阴、阳离子的70%左右[4],铵态氮促进植物吸收阴离子,消耗有机酸;而硝态氮促进植物吸收阳离子,促进有机阴离子的合成。不同植物对不同形态氮素的吸收、转化利用能力也不同,比如旱地植物一般表现为“喜硝性”,而水生植物或强酸性土壤上生长的植物,则一般表现为“喜铵性”,这是植物为适应土壤环境而长期进化的结果。有研究[5]表明,水稻田施用铵态氮,可以明显提高植株的株高、地上干物质量,从而促进水稻的生长。而有研究[6]发现,不同形态氮肥对小麦的产量、增产量和增产率的影响中,硝态氮肥最高,硝态氮、铵态氮组合次之,铵态氮最低。
大量研究都着眼于植物对铵态氮与硝态氮的吸收量、吸收速率和光合特性上,忽视了土壤这个具有强大缓冲能力的载体。植物的生长和营养的吸收利用都离不开土壤,土壤的理化性质可以直接影响植物对铵态氮和硝态氮的吸收。有研究[7]发现,在土壤高pH的条件下,不论来自有机质的矿化还是直接施入土壤的铵态氮,会迅速通过硝化作用转化为硝态氮,土壤中铵态氮浓度低至只有0.77 mmol·dm-3,而硝态氮浓度能高达 6 mmol·dm-3。

目前研究最多的NRT1转运体是拟南芥AtNRT1.1蛋白。硝酸盐可以诱导其表达[24]。AtNRT1.1在功能上与硝酸盐对根生长的刺激作用有关[25,26]。AtNRT1.1已被证明在硝酸盐感应系统中发挥了作用,该系统通过促进根尖中生长素的流动来刺激根系生长[27,28]。迄今为止,豆科植物中的硝酸盐转运体很少受到关注,可能是因为这些物种能够通过共生结瘤的生物固氮来适应氮饥饿[29]。尽管硝酸盐在豆科植物中也起着重要的营养和信号作用,但在这些物种中只有少数假定的硝酸盐转运体被克隆出来[30],到目前为止,它们都没有功能特征。事实上,在氮限制条件下,豆科植物能够吸收矿物质氮,尤其是土壤中硝态氮,以满足其营养需求,然后才能分化出功能共生结瘤。此外,有研究[31]表明,硝酸盐通过局部和系统性调节途径,抑制根结瘤和固氮活性。在给植物接种根瘤菌的试验中,氮输入被证明能够调节百脉根(Lotusjaponicus)中根瘤的发生[32]。硝酸盐转运蛋白基因MtNRT1.3主要在紫花苜蓿根中表达,编码双亲和硝酸盐转运体,类似于拟南芥中的AtNRT1.1[33]。有研究发现蒺藜苜蓿中的MtNRT1.3与描述的NRT1家族成员不同,根中MtNRT1.3的表达受氮饥饿刺激,并在含有NO3-的培养基中受到抑制[34]。
紫花苜蓿是现代畜牧业生产中重要的蛋白饲草资源,本研究以紫花苜蓿为研究对象,探究紫花苜蓿对不同形态氮素的吸收、转化和土壤微环境对外源氮素添加的响应,以及氮素、植物和土壤三者之间的相互关系。探讨不同形态氮肥对土壤氮含量及植物根系养分吸收的影响,了解土壤氮素与植物供求关系,揭示不同形态氮素对紫花苜蓿生理特征、氮含量的影响,通过平衡铵态氮和硝态氮含量,合理调控氮肥种类和养分供求以满足作物要求,提高资源利用效率和作物生产力。
1 材料与方法
1.1 试验材料
供试紫花苜蓿品种为WL233(购于北京正道种业有限公司),供试肥料包括:分析纯硝酸钠、氯化铵和硫酸钾;化学纯化过磷酸钙,有效磷(以P2O5计)为14%~16%。
盆栽土壤取自扬州大学草学智能温室试验地0~30 cm的表土,有机质19.08 g·kg-1,全氮0.85 g·kg-1,pH值8.32,铵态氮4.83 mg·kg-1,硝态氮12.48 mg·kg-1。
1.2 试验设计
试验采用盆栽法,于2019年4月在扬州大学草学智能温室内进行。试验选择容器为18 cm×17 cm×20 cm的塑料花盆,每盆装土3.5 kg,根据土壤基础肥力测定,每盆按照1 kg土施加K2O 200 mg、P2O5300 mg作为基肥。每盆均匀点播10粒种子,待幼苗长出第3片真叶时进行间苗,每盆留8株长势一致的健康幼苗。
试验设计采用单因素完全随机设计,共设4个处理,分别为以不施氮处理为对照组(Con)、铵态氮(NH4Cl-T1)、硝态氮(NaNO3-T2)和混合氮(铵态氮、硝态氮1︰1混合-T3),每个处理重复4次,共16盆。各形态氮肥施加总量为250 mg·kg-1(每1 kg土),以Fahraeus无氮营养液[35]结合NH4Cl和NaNO3配置所需氮素浓度,3叶期时开始浇灌,每次浇灌营养液200 mL,每周浇一次营养液,并进行日常浇水、除杂防护管理,共计5周。现蕾期取样测定各个指标。
1.3 测定指标和方法
1.3.1土壤pH及土壤氮含量的测定 用常规农化分析方法测定pH值(Sartorious PB-10)[36]。采用试剂盒(购于苏州科铭生物科技有限公司)测定土壤铵态氮和硝态氮含量。
1.3.2紫花苜蓿生长性状及植株铵态氮和硝态氮含量测定 株高:测量植株的自然状态下的垂直高度;根长:将植株根系整个挖出,去除土壤(保证根的完整),用直尺测量主根的根长;所有处理地上部和地下部(蒸馏水洗净,吸水纸吸干)称取鲜重,留一小部分用于测定植株铵态氮、硝态氮含量和根中MtNRT1.3 基因的表达(—80℃保存),其余部分于烘箱105℃杀青30 min后,在75℃烘干至恒重,称取干质量即为生物量;
植物铵态氮和硝态氮含量:采用试剂盒测定(购于苏州科铭生物科技有限公司)。
1.3.3紫花苜蓿根RNA的提取和cDNA的合成 称取1~2 g紫花苜蓿根,用磷酸缓冲盐溶液(Phosphate buffer saline,PBS)洗净,吸水纸吸干,放入玻璃研磨器中,接着加入1 mL Trizol(细胞和组织总RNA提取试剂)研磨至匀浆,装于1.5 mL指形管中,加入0.2倍体积的氯仿,离心20 min,取上清,加入等体积的冰异丙醇,—20℃冰箱过夜沉淀。
将之前过夜沉淀的混合液4℃,12 000 rpm离心20 min;弃去上清,加入750 μL的75%乙醇(焦碳酸二乙酯无酶水配制),继续4℃,12 000 rpm离心20 min;重复上一步骤,在超净工作台中将指形管内水分晾干,根据得到的RNA团块大小加入适量的DEPC水,65℃水浴10 min,然后放回冰上,测量RNA浓度。取1 μLRNA溶液,在260 nm和280 nm测定吸光度值,并计算A260/A280,检测RNA的纯度。
用Thermo Script反转录酶(Invitrogen)和OligodT18 Primer对2 μg的RNA样品进行反转录,反应温度为42℃,合成cDNA。
1.3.4qPCR法测定紫花苜蓿MtNRT1.3基因的表达 引物及内参基因见表1,使用SYBR Premix Ex Taq (Perfect Real Time)Kit(TaKaRa Biotechnology (Dalian)Co.,Ltd.)试剂盒进行qPCR定量测定。反应体系为20 μL:SYBR Green Super Mix (2×)10 μL,稀释过的cDNA 2 μL,正反引物各 0.8 μL,用超纯水补齐。计算采用2-ΔΔCt法计算基因的相对表达量。

表1 实时荧光定量PCR引物信息
1.4 数据处理
采用Microsoft Excel 2015 和SPSS 19.0 进行数据处理及方差分析,Sigmaplot 10.0进行作图。
2 结果与分析
2.1 不同形态氮肥对土壤pH值和铵态氮和硝态氮含量的影响
由图1A可得,施有硝态氮肥的T2和T3处理组土壤pH值显著低于T1和对照组(P<0.05),单施铵态氮T1处理组与对照组相比差异不显著。土壤中铵态氮和硝态氮含量直接关系到植物从土壤可以获得的氮含量。从图1B可以看出,不同处理对土壤氮含量有显著影响,T2处理土壤中铵态氮含量显著高于其他各组,T3处理组显著低于其他各处理组(P<0.05),T1处理与对照组相比无显著差异(P>0.05)。由图1C可以看出,T2处理土壤中硝态氮含量也显著高于其他各处理组,与图1B土壤中铵态氮含量不同的是T3处理硝态氮含量显著高于T1和对照组,土壤中硝态氮含量依次为T2>T3>T1>Con,且各组间差异显著(P<0.05)。
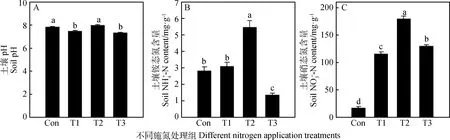
图1 不同施肥处理对土壤pH及土壤铵态氮和硝态氮含量的影响
2.2 不同形态氮肥对紫花苜蓿株高、根长及生物量的影响
由图2B可以看出,不同形态氮肥处理下,紫花苜蓿根长差异不显著(P>0.05),但是株高有显著差异。只施硝态氮肥的T2处理下紫花苜蓿株高显著高于对照组和混合氮T3处理组,其他各组间差异不显著(图2A)。

图2 不同施肥处理对紫花苜蓿株高及根长的影响
施加氮肥能够有效提高植物的生物量,由图3A可知,各施肥处理组地上生物量显著高于对照组,且单施铵态氮和硝态氮地上生物量显著高于混合氮T3处理组(P<0.05);单施铵态氮肥T1处理组地下生物量显著高于对照组和混合氮T3处理组(P<0.05),但与单施硝态氮肥组T2处理组相比差异不显著(P>0.05)(图3B);从图3C根冠比可以看出,单施硝态氮肥组根冠比显著低于对照组(P<0.05),值得注意的是,对照组根冠比的比值大于其他各处理组,T1处理根冠比比值大于T3处理组,T3处理大于T2处理(P>0.05)。

图3 不同施肥处理对紫花苜蓿地上、地下生物量及根冠比的影响
2.3 不同形态氮肥对紫花苜蓿植株铵态氮和硝态氮含量的影响
不同形态氮肥处理对紫花苜蓿植株铵态氮和硝态氮含量有显著影响。由图4A可知,混合氮T3处理下植物铵态氮含量显著高于其他各处理组,且各组间差异显著(P<0.05),植物铵态氮含量在不同处理间依次升高(Con

图4 不同施肥处理对紫花苜蓿地上部铵态氮和硝态氮含量的影响
2.4 不同形态氮肥对硝酸盐转运蛋白基因MtNRT1.3表达的影响
硝酸盐转运蛋白基因MtNRT1.3主要在紫花苜蓿根中表达,图5可以看出,Con组MtNRT1.3基因的表达量显著低于其他处理组;单施硝态氮肥的T2处理该基因的表达量最高,MtNRT1.3基因的表达量显著高于T1和T3处理组(P<0.05);T1和T3处理组间无显著差异(P>0.05)。
2.5 紫花苜蓿生理特征和MtNRT1.3与土壤氮含量的关系
由表2可以看出,土壤铵态氮含量与基因MtNRT1.3、株高和土壤pH呈显著正相关关系(P<0.01);土壤硝态氮与叶铵态氮、地上生物量和基因MtNRT1.3呈显著正相关关系(P<0.01),但与根冠比呈显著负相关关系(P<0.01)。

图5 不同施肥处理对紫花苜蓿硝酸盐转运蛋白基因MtNRT1.3表达量的影响
3 讨论
3.1 添加不同形态氮素对土壤理化性质的影响
土壤具有良好的缓冲能力,一般都能维持稳定的土壤微环境,但是有研究表明,不同施肥处理会打破土壤稳定的pH环境[37]。植物可以直接利用土壤中的铵态氮和硝态氮,根系吸收阴阳离子是平衡的,根系吸收铵态氮时就会向土壤中释放H+使土壤pH值下降;吸收硝态氮时,向土壤释放OH-致使土壤pH值升高。本试验铵态氮处理和混合氮处理降低了土壤pH值,硝态氮处理数值上提高了土壤pH值,但是与对照相比差异不显著,这说明施加铵态氮处理植物吸收铵态氮较多,从而降低了土壤pH[38,39]。图1B T1处理组铵态氮含量与对照组无显著差异,说明单施铵态氮肥对土壤铵态氮含量影响较小,这与王西娜等[40]的研究一致,这也说明铵态氮更容易被植物吸收利用;T3处理土壤中铵态氮和硝态氮含量显著低于T1、T2处理,说明混合施加硝态氮和铵态氮更有利植物根系对土壤氮素的吸收利用[41]。图1C T1处理的硝态氮含量显著高于对照组,说明施入土壤的铵态氮很可能被转化为硝态氮,从而导致土壤硝态含量升高。施入土壤中的铵根离子为阳离子,容易与土壤胶粒吸附结合,从而被硝化微生物硝化为硝酸根或亚硝酸根离子存在于土壤中[42]。
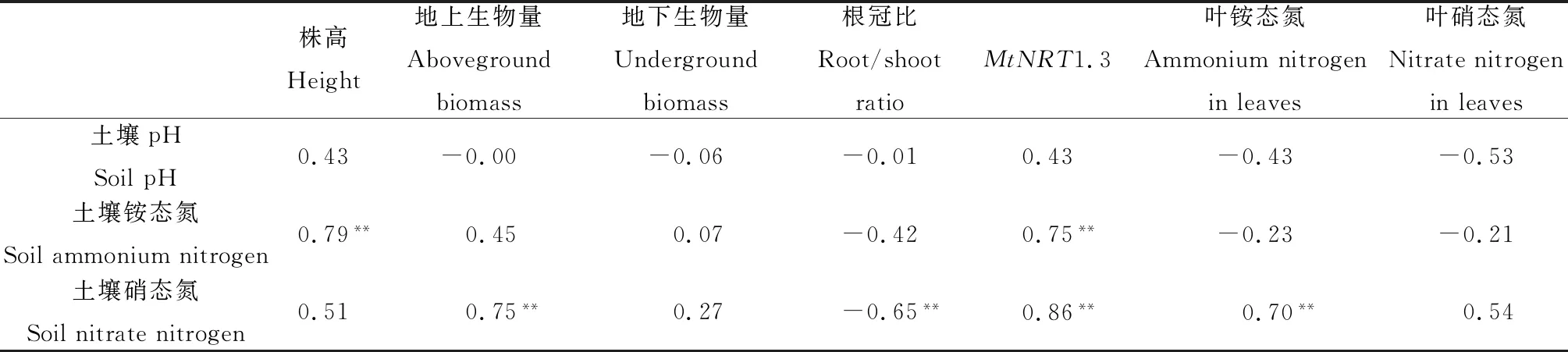
表2 紫花苜蓿生理特征及MtNRT1.3与土壤氮含量的关系
注:表中数值为Pearson相关系数,**表示相关性显著,P<0.01
Note:The values are Pearson correlation coefficients in the table. ** Significant correlation,P< 0.01
3.2 紫花苜蓿的生长及对不同形态氮素的吸收利用
植物的生长离不开氮素,施加氮肥能够提高植物产量。本试验如图2A所示单施硝态氮肥提高了紫花苜蓿的株高,说明硝态氮与铵态氮相比更有利促进紫花苜蓿的高度生长。由图3B,3C可知施氮处理明显提高了紫花苜蓿地上、地下生物量,这结果与Hojjati等[43]研究结果一致。单施铵态氮肥使得植株地上、下生物量最高,说明铵态氮更容易被紫花苜蓿吸收利用。根系是植物吸收利用养分的关键部位,根冠比的大小反映了植物干物质积累方向及地上和地下的相互关系。有研究[44]表明,养分供应不足时,根系的侧根数量和根毛会增加来寻找更多的养分供应植物生长,光合产物会优先配送到根部,根冠比增大,本试验的结果与其一致,说明施加氮肥能够降低植物的根冠比,有利于植物地上物质的积累。本试验还发现,单施硝态氮肥处理根冠比最低,结合图3B T2处理与T1处理地下生物量数据得出硝态氮可能抑制了紫花苜蓿根系的生长,光合产物优先向地上部分运输。
测定紫花苜蓿中铵态氮和硝态氮含量时,本试验发现(图4A,4B)混合氮处理组的植株的铵态氮和硝态氮含量均较高,且两者含量都呈现一种趋势,Con<处理T1<处理T2<处理T3处理。本研究结果表明施肥能够增加植株内2种氮素的含量,单一施铵态氮和硝态氮并不会引起植物内单一氮素含量增加,可能是因为2种氮素的含量在植物体内是相对平衡的,铵态氮和硝态氮之间存在相互转化的过程。有研究[45]表明,植物液泡中累积的硝酸盐可以作为内源养分,在外源氮素不足时会被植物体吸收转化利用。由图4可以得出,2种氮素配合施加更有利于氮素在体内的积累,且硝态氮处理比铵态氮处理更有利氮素在植物体内积累,施用硝态氮肥不仅能使紫花苜蓿吸收更多的硝态氮,还能较快地将其转化为铵态氮积累在体内。本研究结果显示,紫花苜蓿宜混合施用铵态氮和硝态氮肥且以硝态氮比例较大为佳。
3.3 不同形态氮素对紫花苜蓿硝酸盐转运蛋白基因MtNRT1.3的影响
不同形态氮素对紫花苜蓿根的刺激反应也不同,植物为了更好地吸收利用氮素资源,形成了特定的硝酸盐吸收同化途径。由图5可以看出,不同施肥处理上调了硝酸盐转运蛋白基因MtNRT1.3的表达,其中单施硝态氮肥T2处理该基因的表达量最高,说明硝酸盐诱导了MtNRT1.3的表达,该基因编码的硝酸盐转运蛋白参与了紫花苜蓿根对硝酸盐的吸收转运。同时,在T2处理中,紫花苜蓿叶片中的硝态氮含量最高,说明该基因表达量的增加与植株对氮的吸收密切相关。此外,T1处理下MtNRT1.3的表达量也显著高于对照组,可能是由于部分铵态氮转化成硝态氮,从而促进了该基因的表达。在研究豆科模式植物蒺藜苜蓿NRT1.3基因的试验中,发现MtNRT1.3参与了氮素限制反应,提高了植株在氮素限制条件下获得NO3-的能力[34]。Anthoni Pellizzaro等[46]发现,MtNRT1.3受脱落酸的刺激,并参与对蒺藜苜蓿主根生长的调节。上述试验虽然都发现MtNRT1.3与硝酸盐转运有关,但是其结果与本试验结果不同,本试验发现在高浓度外源氮素条件下,施加不同形态氮肥使该基因的表达量显著增加;与已有结论[34,46]相似的是,硝态氮肥可能会抑制植物地下部分的生长,这可能与氮肥来源、植物生长环境、土壤氮含量等因素有关。
3.4 紫花苜蓿生理特征、MtNRT1.3表达与土壤氮含量的关系
植物和土壤两者在自然环境中存在着特定的有机联系,当外界环境发生变化时,植物与土壤之间会产生不同响应。如本试验表2所示,紫花苜蓿MtNRT1.3基因的表达与土壤中铵态氮、硝态氮呈正相关性,这说明当土壤中铵态氮和硝态氮诱导了紫花苜蓿MtNRT1.3基因的表达,有研究[28-29]证实MtNRT1.3类似于拟南芥的AtNRT1.1,AtNRT1.1已被证明参与双亲和性硝酸盐转运系统,在硝酸盐感应系统中发挥了作用,该系统通过促进根尖中生长素的流动来刺激根系的生长[27,28],但是本试验发现土壤中铵态氮含量却与其具有正相关性,可能是因为土壤中过多的铵态氮在土壤硝化细菌的作用下转化为硝态氮,从而影响MtNRT1.3的表达。所以,当紫花苜蓿根中MtNRT1.3基因的表达量增加时,植物可以通过根系更有效地分配和利用土壤中的氮素,从而提高植株株高,增加地上生物量。通过相关分析还发现,土壤硝态氮的含量与植物根冠比呈负相关性,与地上生物量呈正相关性,说明硝态氮肥更有利于紫花苜蓿把光合产物优先向地上组织中运送。
4 结论
施氮处理提高了紫花苜蓿植株中的氮含量,施加不同形态氮肥均提高了紫花苜蓿根中MtNRT1.3基因的表达量,且该基因的表达量与土壤中铵态氮和硝态氮含量呈正相关性;相比于铵态氮肥,施加硝态氮肥不仅增加了植株硝态氮含量,而且提高了植株铵态氮含量;相比于单施硝态氮和铵态氮肥,混合氮肥对提高植物氮含量效果最好;施加硝态氮肥更有利于紫花苜蓿地上部分生物量的累积;因此,对紫花苜蓿施加混合态氮肥,尤其是增加硝态氮肥的比例更有利于植株的生长和对氮素的吸收。
