柳枝稷TIFY基因家族的鉴定与分析
2019-11-07赵晓晓谢坤良张舒梦奚亚军孙风丽
赵晓晓,谢坤良,张舒梦,张 超,奚亚军,孙风丽
(西北农林科技大学农学院,陕西 杨凌 712100)
TIFY基因家族是植物中特有的转录因子超家族,因含有高度保守的TIF [F/Y]XG氨基酸序列而得名,依据结构特点及进化关系分为TIFY,PPD,ZIM/ZML(ZIM-like),JAZ四个亚家族[1-2]。TIFY家族成员可调控多种生长发育过程及胁迫防御反应:牵牛花(Pharbitisnil)的PnFL-2蛋白[3]含有TIFY家族典型的TIFY与CCT域,可能在花诱导中发挥作用;过表达水稻(Oryzasativa)OsTIFY11b[4]使得茎秆积累了更多的碳水化合物,进而促进种子大小与粒重增加;香蕉(Musaacuminate)MaTIFY1b[5]参与果实的成熟;拟南芥(Arabidopsisthaliana)PPD2[6]与NINJA共同调节叶片整齐度;野大豆(Glycinesoja)GsTIFY[7]参与碳酸氢盐胁迫反应;毛竹(Phyllostachysedulis)PeTIFY[8]在脱水及冷胁迫中起作用;木豆(Cajanuscajan) CcTIFY[9]调控植株在铜胁迫下的响应。TIFY基因家族全基因组分析自拟南芥[1]、水稻[10]、二穗短柄草(Brachypodiumdistachyon)[11]等模式作物以后,已分别在雷蒙德氏棉(Gossypiumraimondii)[12]、玉米(Zeamays)[13]、小麦(Triticumaestivum)[14]等植物中相继报道。
JAZ蛋白(JAZs)隶属TIFY基因家族的JAZ亚家族,是茉莉酸(jasmonic acid,JA)信号通路的转录抑制因子[15]。JAZs不含DNA结合结构域,必须依赖蛋白间的互作行使功能[1]:JAZ蛋白N末端弱保守的NT结构域可与DELLA蛋白互作[16],DELLAs主要作用是抑制赤霉素(gibberellin,GA)信号传递,两者的互作使得JA与GA信号通路联系起来,调控植物的生长-防御平衡;ZIM结构域保守的TIFY基序是JAZs形成同源或异源二聚物的基础[17],ZIM结构域与NINJA和TPL阻遏蛋白的互作抑制了JA信号通路中MYC转录因子的活性[18],JA应答基因的表达被关闭;JAZ蛋白C末端的Jas结构域十分保守,可与EIN3、EIL1[19]等转录因子互作,使得JA信号通路与乙烯(ethylene,Eth)信号通路交联,进而调控植株的发育及抗病性。研究报道JA介导的JAZs转录水平的变化与生长素(auxin,IAA)、Eth,GA及油菜素内脂(brassinolide,BRs)等激素信号的调节相关,这些激素形成复杂的调控网络,在植物的生长发育、激素应答及胁迫响应等方面发挥作用[20]。
柳枝稷(PanicumvirgatumL.)为禾本科黍属多年生C4草本植物,因具有生物质产量大、纤维素含量高、抗逆性强、可在边际土地生长、水肥需求少、对环境友好等优点,成为国际上公认的模式能源作物[21-22],TIFY基因家族具有多种的生物学功能,但在柳枝稷中尚未开展相关研究。本研究鉴定了柳枝稷基因组中的TIFY家族成员,并对其染色体定位、进化关系、基因结构、保守基序组成、启动子区顺式作用元件及时空表达模式等生物信息进行了分析,且通过定量实验验证了部分成员的激素应答及胁迫响应特性,从而为揭示TIFY基因家族在柳枝稷中的功能奠定基础。
1 材料与方法
1.1 柳枝稷TIFY基因家族的鉴定
从JGI数据库(http://jgi.doe.gov/)下载柳枝稷蛋白数据,同时在Pfam数据库(http://pfam.xfam.org/)提取TIFY(PF06200)的隐马尔科夫模型矩阵文件,然后利用HMMER搜索含有TIFY保守结构域的柳枝稷蛋白序列并通过结构域可视化及序列多重比对等方法再次确认其结构域是否完整,最终得到柳枝稷TIFY基因家族成员。
1.2 柳枝稷TIFY基因家族的分析
TIFY系统进化分析:将拟南芥AtTIFY[1]、水稻OsTIFY[10]及筛选到的柳枝稷TIFY蛋白序列提交到MEGA5.0进行序列多重比对,然后采用NJ(Neighbor-Joining)法绘制种间进化树,设定自举值为1000;
柳枝稷TIFY染色体定位分析:从JGI数据库(http://jgi.doe.gov/)下载的基因组数据中提取基因位置信息,结合柳枝稷染色体数目及长度等信息,利用MapDraw软件绘制基因的染色体定位图谱;
柳枝稷TIFY种内进化分析:将柳枝稷TIFY蛋白序列经MEGA5.0多重比对后采用NJ法绘制进化树,自举值1 000;
柳枝稷TIFY基因结构分析:将柳枝稷TIFY家族成员的CDS序列及Genomics序列提交至GSDS(http://gsds.cbi.pku.edu.cn/indx.php)在线软件,对每个成员的外显子与内含子分布情况进行分析;
柳枝稷TIFY保守基序分析:将柳枝稷TIFY蛋白序列提交至MEME(http://meme-suite.org/tools/meme),设定搜索motif的个数为6,其它选项为默认参数;
柳枝稷TIFY启动子区顺式作用元件分析:从JGI数据库(http://jgi.doe.gov/)提取基因上游2000bp片段,提交至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)。
柳枝稷TIFY时空表达模式分析:从JGI数据库(http://jgi.doe.gov/)获得各基因在不同组织的表达量数据,使用HemI软件制作组织特异性表达图谱。
1.3 部分成员的表达特性分析
植物材料及处理:挑选籽粒饱满、大小均匀的柳枝稷低地型品种“Alamo”种子,先后使用70%无水乙醇表面消毒1 min,10%次氯酸钠溶液灭菌5 min,然后使用无菌水冲洗3~4次,置于4℃条件下过夜,次日将处理过的种子置于带有滤纸的培养皿上,于27℃(16 h/8 h)光照培养箱中生长。待幼苗根长2 cm左右时,转移至水培容器内继续在光照培养箱内培养,每隔2~3 d换一次培养液,水培3周后用于激素与胁迫处理。激素处理参照水稻幼苗处理方式[10],胁迫处理参照二穗短柄草幼苗处理方式[11]。取材部位为叶片,经液氮处理后于—80℃保存。
RNA提取及荧光定量PCR:利用RNAiso Plus提取上述材料总RNA,参照PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)说明书进行反转录,使用Primer Premier 6.0设计基因特异引物;按照TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)说明书配置荧光定量PCR体系10 μl;使用QuantStudioTM3 Flex Real-Time PCR System进行PCR反应,两步法;利用SigmaPlot12.5软件处理数据、制作图表,相对表达量以2-△△CT法计算。引物序列如表1所示。

表1 荧光定量PCR引物列表
注:PviTIFY10aF与PviTIFY10aR同时扩增PviTIFY10e,PviTIFY10f与PviTIFY10a基因;PviTIFY10bF与PviTIFY10bR同时扩增PviTIFY10g,PviTIFY10h与PviTIFY10b基因;EF-1-alpha为柳枝稷实时荧光定量PCR的内参基因[23]
Note:PviTIFY10aFandPviTIFY10aRsimultaneously amplifiedPviTIFY10e,PviTIFY10fandPviTIFY10agenes;PviTIFY10bFandPviTIFY10bRsimultaneously amplifiedPviTIFY10g,PviTIFY10handPviTIFY10bgenes;EF-1-alphawas the internal reference gene of qPCR in switchgrass[23]
2 结果与分析
2.1 柳枝稷TIFY基因家族的鉴定
在柳枝稷基因组中共鉴定到48个TIFY序列,命名为PviTIFY(区别于菜豆(PhaseolusvulgarisL.)的TIFY序列PvTIFY[24]),命名顺序参照OsTIFY,分属ZML(7个)、TIFY(1个)、JAZ(40个)3个亚家族。其基本信息如表2所示,PviTIFY的CDS全长465~1 323 bp不等,编码蛋白的氨基酸数目154~440个不等,TIFY保守基序呈现多种形式。
2.2 TIFY基因家族的进化分析
将柳枝稷PviTIFY序列、水稻OsTIFY序列及拟南芥AtTIFY序列共计86个蛋白序列进行多重比对后利用MEGA5.0构建进化树,如图1所示,TIFY基因家族的4个亚家族成员构成及分布如下,PPD亚家族仅包含双子叶植物拟南芥的AtTIFY4a与AtTIFY4b;TIFY亚家族包含OsTIFY8、PviTIFY8a与AtTIFY8,但AtTIFY8与其他蛋白序列亲缘关系较远而同PviTIFY8b位于单独分枝;ZML亚家族由3个物种的TIFY1与TIFY2构成,共计14个成员;剩余其它蛋白序列分属JAZ亚家族,可分为以下3个类群,JAZⅠ,JAZⅡ,JAZⅢ,其中JAZⅠ仅包含PviTIFY与OsTIFY序列,共计19个;JAZⅡ含有最多的PviTIFY序列,占比为13/22;JAZⅢ包含的TIFY序列数目最多,计25个。
2.3 PviTIFY的染色体定位
依据基因组数据信息,对48个PviTIFY基因进行染色体定位,如图2所示,除PviTIFY5b与PviTIFY11s位于没有拼接到染色体的scaffolds上,其余46个PviTIFY分别定位于染色体1,2,4,5,6,7,8,9。在染色体9分布的PviTIFY数目最多,计24个,包含了PviTIFY11中除PviTIFY11s以外的所有成员,且形成了4个基因簇,9K与9N各两个;其次为染色体2与染色体7,分别含有9个PviTIFY与6个PviTIFY;染色体4与染色体6均含有2个PviTIFY;染色体1N、染色体5K及染色体8K则各含有1个PviTIFY,分别是PviTIFY9c,PviTIFY8b与PviTIFY8a。

表2 柳枝稷TIFY基因家族基本信息
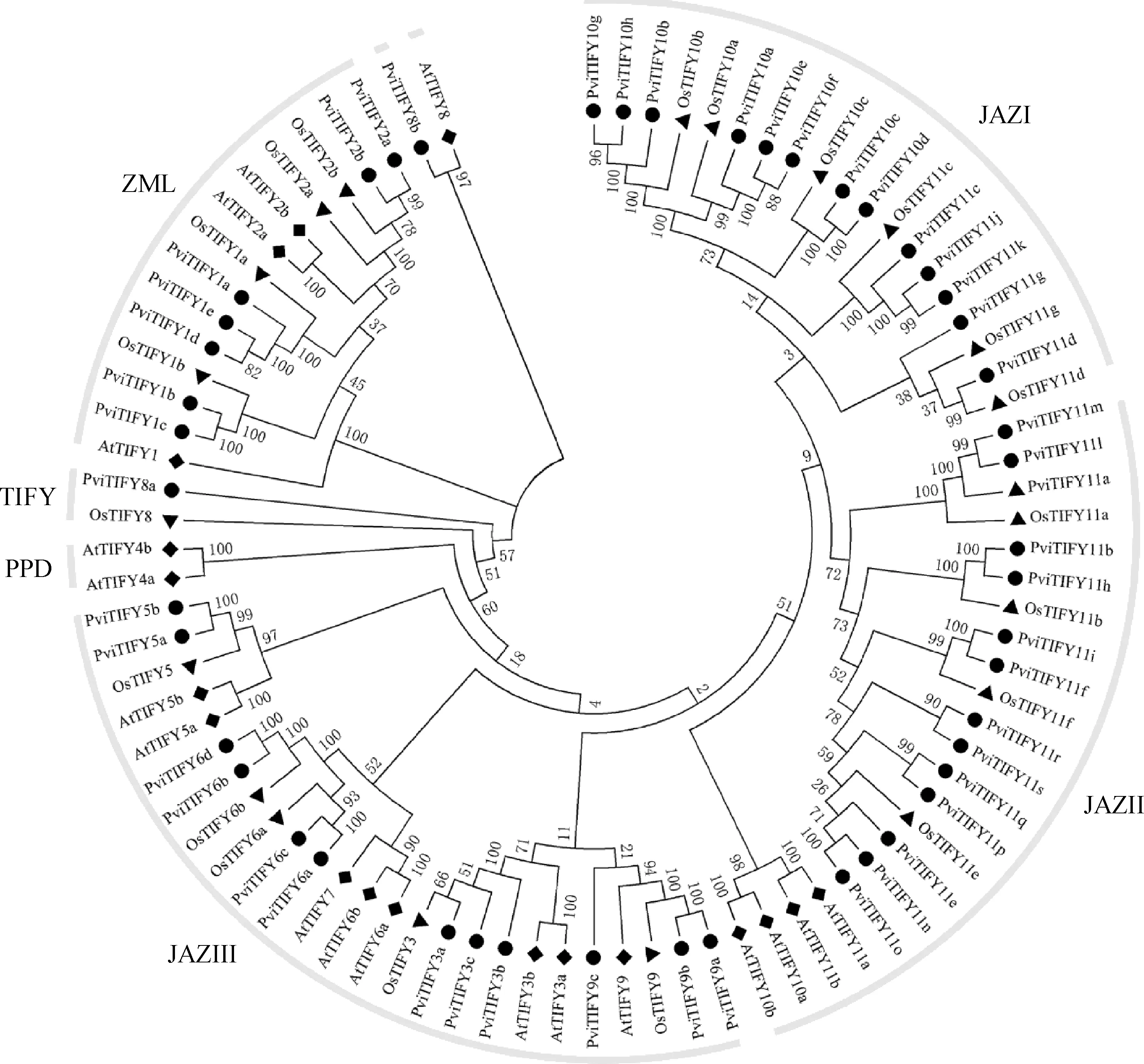
图1 拟南芥、水稻、柳枝稷中TIFY的系统发育树
2.4 PviTIFY的结构特点
按照PviTIFY的进化树顺序,分析了各成员的基因结构与保守基序组成,如图3所示:
PviTIFY10与PviTIFY11位于邻近的两个进化枝,含有相同的motif组成,即N-terminal,TIFY,Jas,归属JAZ亚家族。在8个PviTIFY10成员中,除PviTIFY10c外,其他PviTIFY10均由5个外显子与4个内含子组成,与PviTIFY10位于同一进化枝的PviTIFY11c,PviTIFY11d,PviTIFY11g,PviTIFY11j,PviTIFY11k,基因结构由3个外显子与2个内含子构成,而位于其邻近进化枝的剩余PviTIFY11成员均不含内含子。结合进化关系与结构特点将以上成员分属JAZⅠ组与JAZⅡ组。
PviTIFY3,PviTIFY5,PviTIFY6,PviTIFY9及PviTIFY8b虽位于不同进化枝,但保守基序均由TIFY motif与Jas motif组成,同属JAZ亚家族。其中PviTIFY6的外显子与内含子数目最多,含有7个外显子与6个内含子(PviTIFY6c含有6个外显子与5个内含子),其次为PviTIFY9与PviTIFY3a,由5个外显子与4个内含子组成,而PviTIFY3b与PviTIFY3c则由4个外显子与3个内含子构成,PviTIFY8b与PviTIFY5的外显子与内含子数目相对较少,且PviTIFY5a无3,UTR。以上成员划归JAZⅢ组。
PviTIFY8a仅含有TIFY motif,为TIFY亚家族成员,基因结构由3个外显子与3个内含子组成,归于TIFY组。
PviTIFY1与PviTIFY2含有其他亚家族成员没有的GATA Zn-finger结构域,为ZML亚家族成员。在PviTIFY1成员中,PviTIFY1b的内含子与外显子数目最多,由9个外显子与8个内含子构成,且其长度在48个PviTIFY中最长,其他成员则由8个外显子与7个内含子组成,PviTIFY2均含有7个外显子与6个内含子,且PviTIFY2b无5’UTR。以上成员归为ZML组
TIFY各成员在柳枝稷内的分组结果同其在物种间的划分结果(图1)一致,且每组内进化关系较近的成员间具有近乎相同的内含子/外显子组成及蛋白保守基序分布。


图2 PviTIFY在染色体的分布

图3 PviTIFY的进化树、基因结构及保守基序
2.5 PviTIFY启动子区顺式作用元件分析
柳枝稷TIFY基因启动子区顺式作用元件统计结果如表3所示,除PviTIFY11m与PviTIFY11s外,其他46个柳枝稷TIFY成员的启动子区都存在4~10种调控元件,其中大部分成员(60%以上)含有光响应、厌氧与缺氧胁迫及JA,ABA信号调控元件,半数成员包含干旱胁迫及GA,IAA信号调控元件,少部分成员含有低温胁迫及SA信号调控元件,另有极少部分成员包含生物钟、细胞周期及创伤应激调控元件。综上所述,柳枝稷TIFY基因启动区存在多种胁迫响应元件及激素信号调控元件,可能在柳枝稷抗逆反应及激素信号网络中发挥作用。

表3 PviTIFY启动子区顺式作用元件分析
2.6 PviTIFY时空表达模式分析
柳枝稷TIFY成员在各种组织及发育阶段的表达特性如图4所示,PviTIFY中表达量较高的是10b,10g,10h,10a,10e,10f与11j,11k,11c,11b,11h及6b,6d,这些成员均为JAZ亚家族成员(图3)。PviTIFY10的6个成员在刚出现的花序、授粉后25 d的小花与V3期的根中表达量最高,尤其是PviTIFY10b,它在各种组织与发育阶段的表达量均是最高的;PviTIFY11的5个成员在授粉后25 d与30 d的小花中表达量较高,且PviTIFY11b与PviTIFY11h在V1与V3期的根、整个地上部、E4期的维管束及刚出现的花序中也有较高表达;PviTIFY6的两个成员中PviTIFY6b在刚出现的花序、E4期的的茎与叶中表达量较高,在根与地上部也有表达。综上所述,这些表达量较高的PviTIFY10与PviTIFY11可能在花序与根的发育中发挥作用,还可能影响产量的形成,而PviTIFY6则可能在植株形态建成中发挥功能。

图4 PviTIFY时空表达模式
2.7 PviTIFY10各成员的表达特性
为验证柳枝稷TIFY成员的激素应答及胁迫响应特性,我们选取了表达量较高的PviTIFY10计8个基因进行定量实验。
各成员在不同激素处理下的表达特性如图5所示:PviTIFY10a,PviTIFY10e与PviTIFY10f在JA处理下表达量升高,在其他激素处理下表达量变化不大;PviTIFY10b,PviTIFY10g与PviTIFY10h在JA与IAA处理条件下表达量是升高的,而在其他激素处理条件下呈现不同程度的下调表达;PviTIFY10c在JA处理下表达量升高最明显,同时也受到其他激素不同程度的诱导作用;PviTIFY10d在JA处理条件下先下调表达后逐渐上调表达,对其他激素处理响应模式规律性较差。对每种激素来说,JA可诱导PviTIFY10各成员的表达,IAA对PviTIFY10各成员均无抑制作用;SA,Eth,GA,ABA均可诱导PviTIFY10c,但对PviTIFY10b,PviTIFY10g与PviTIFY10h的表达是抑制的。
各基因的胁迫响应模式如图6所示,PviTIFY10各成员在三种胁迫下的表达模式相同,即盐处理下各基因的表达量迅速升高,其中PviTIFY10d在盐胁迫下表达量升高最明显;干旱处理下各基因同样上调表达,且PviTIFY10c表达量最高;在冷胁迫中各基因表达量变化不明显,除PviTIFY10c外,其他成员呈现较低的敏感性。

图5 PviTIFY10各成员在不同激素处理下的表达模式
综上所述,PviTIFY10各成员在JA处理及盐与干旱胁迫下反应强烈,推测其可能在柳枝稷JA信号通路及盐与干旱胁迫防御反应中发挥功能。
3 讨论与结论
柳枝稷为异源四倍体,相对拟南芥、水稻、二穗短柄草等二倍体物种来说,所包含的TIFY基因家族成员数目较多,本研究共鉴定到48个PviTIFY,包含7个ZML、1个TIFY、40个JAZ,各成员TIFY motif的氨基酸序列除TIFYXG形式外包含多种类型,如TLSFXG,TLLFXG,TIVYXG等形式,与前人的报道一致[2]。TIFY蛋白在拟南芥、水稻、柳枝稷3个物种间分为6个类群:PPD,TIFY,ZML,JAZⅠ,JAZⅡ,JAZⅢ,从进化距离上看,PviTIFY同OsTIFY的亲缘关系较近。除PviTIFY5b与PviTIFY11s外,其它46个PviTIFY分布在染色体3以外的染色体上,其中半数成员集中分布在染色体9,并且PviTIFY11各成员在染色体9成簇排列,这些信息可为成员间的进化提供依据。
柳枝稷TIFY蛋白按照进化关系及结构特点可分为5组:JAZⅠ,JAZⅡ,JAZⅢ,TIFY,ZML,每组内进化关系较近的成员间具有近乎相同的内含子/外显子组成及蛋白保守基序分布,同水稻[10]与二穗短柄草[11]的TIFY基因家族成员结构组成规律相同。另一方面,不同分组的成员间基因及蛋白结构的组成差异为TIFY基因家族的进化提供了重要依据[25]。对于PviTIFY的基因结构,PviTIFY11成员中除与PviTIFY10位于同一进化枝的5个成员,剩余的14个成员都不含内含子,如PviTIFY11a与PviTIFY11b,同它们在水稻与二穗短柄草中的同源基因一样,可能在进化开始时就没有内含子,或者在进化中内含子丢失了[10-11];对于PviTIFY的保守基序,JAZ亚家族中仅PviTIFY10与PviTIFY11的N端含有NT motif,同水稻中的OsTIFY10与OsTIFY11[10,26]一样。此外,其成员PviTIFY10c与PviTIFY11s缺少了Jas domain。这些具有特殊结构的成员可能在柳枝稷的进化中具有独特性。柳枝稷中ZML亚家族成员的CCT domain分为了两部分,其N端与JAZ亚家族成员的Jas/CCT-2 motif相似性很高而无法区分,GATA domain也由两部分组成,其C端与JAZ亚家族成员N端的NT基序同样具有一定程度相似性,另外,在柳枝稷PviTIFY6,PviTIFY10,PviTIFY11保守基序中还存在motif5,其功能有待研究。

图6 PviTIFY10各成员在不同胁迫处理下的表达模式
JAZ亚家族的JAZ蛋白不仅是JA信号的关键因子,还是激素网络的调控枢纽:水稻OsJAZ9与OsSLR1的互作介导了JA与GA的拮抗作用,进而协调植株的胁迫响应与生长发育[27];棉花(Gossypiumhirsutum) GhJAZ3与GhSLR1的互作实现了JA与GA对表皮细胞分化及伸长的调控[28];黄丝瓜藓(Pohlianutans)PnJAZ1介导JA与ABA在盐胁迫下的信号交谈[29]。鉴于PviTIFY启动子区存在多种胁迫响应与激素应答元件(表3),本研究选定了表达量较高的JAZ亚家族的PviTIFY10成员进行定量实验来验证其在激素与胁迫处理下的表达特性,结果表明PviTIFY10对多种激素及胁迫有强烈反应(图5,6),推测其可能在柳枝稷胁迫防御反应与激素信号调控网络中发挥作用。
柳枝稷JAZ亚家族成员具有明显的时空表达特性,尤以PviTIFYI0各成员在花序、小花及根中的表达量最为显著(图4)。Hakata等[26]发现水稻TIFY基因过表达株系可通过JA信号途径促进植株生长,表现出小花数目增加,开花天数减少、小花育性降低等农艺性状,其中OsTIFY10b过表达株系小花育性降低最少,因而产量较高。在本研究中OsTIFY10b的同源基因PviTIFY10b,同样受到JA的诱导作用(图5),且在刚出现的花序及授粉后的小花中呈现较高表达(图4),结合基因的表达特性及同源基因在功能上的保守性推测PviTIFY10b很可能参与柳枝稷花序发育过程进而影响产量的形成。不仅如此,PviTIFY10b即Pavir.2NG586800(表2)为柳枝稷花逆转相关候选基因[30],本课题组曾对柳枝稷幼穗分化即花序发育这一生物学过程进行了显微观察[31],且在利用柳枝稷幼穗进行人工穗芽诱导时发现了柳枝稷花逆转现象[32-33],并经转录组测序筛选到与柳枝稷花逆转有关的候选基因[30],以上研究可为柳枝稷花序发育分子调控机制解析及分子育种奠定基础。
本研究利用TIFY结构域(PF06200)从柳枝稷基因组中搜索鉴定了48个TIFY家族成员,并且依据其系统进化关系和前人研究结果对家族成员进行了分类。通过对其染色体定位、基因结构、保守基序组成等生物信息学进行分析,进一步确定了柳枝稷TIFY基因家族的分类和进化关系。同时,通过分析TIFY基因家族的启动子顺式作用元件、时空表达模式以及PviTIFY10成员激素应答和胁迫响应的表达特性,初步证明了TITY家族参与激素调控、胁迫应答和花序发育等生长发育过程,为进一步研究柳枝稷TIFY基因家族成员的功能提供了一定的方向和基础。
