贮藏温度对高温高压海参体壁组织结构变化的作用
2019-11-07林琳孙霄侯虎
林琳,孙霄,侯虎
(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
海参属于棘皮动物门,是一种重要的无脊椎动物[1]。刺参(Stichopusjaponicus)是海参中比较知名的品种,在中国主要生长在北方地区的海域中[2]。刺参在中国北方已有较大范围的养殖,目前已经获得了较高的产量,带来了很大的经济价值[3]。
由于酶和微生物的作用,新鲜刺参从海水中捞出来后极易自溶[4]。这一特殊性质对新鲜刺参的贮藏和运输带来了极大的影响和挑战[5]。因此,实际工业生产上需要采取适当的加工方法,及时对新鲜刺参进行加工处理,从而延长贮藏期和货架期。目前,市场上的刺参加工产品主要有淡干刺参、冻干刺参、盐干刺参、即食刺参和刺参深加工产品[6]。其中,最受欢迎的是即食刺参。其优点是能较完整地保留刺参的营养物质和活性成分,并能保持刺参原有的风味和形态,不需发泡,食用方便;缺点是口感普遍较软,保质期较短[7]。在即食海参的加工过程中,内源酶和微生物已经完全灭活,然而在贮藏过程中,仍然出现软化、变黏的现象,这对产品的质量带来了很大的负面影响。
因此,研究贮藏过程中高温高压海参非酶凝胶劣化(由非酶非微生物因素引起的凝胶化结构逐渐破坏的现象)的过程对工业化生产具有重要意义。CHEN等[7]的研究结果发现,高温高压海参体壁在4 ℃贮藏过程中逐渐降解,组织结构和胶原纤维被明显破坏。PENG等[9]研究了高温高压海参在37℃贮藏过程中组织结构的变化情况。结果表明,高温高压海参体壁发生的非酶凝胶劣化现象是由水分迁移、胶原纤维断裂和胶原蛋白降解引起的。本论文在已有研究的基础上,研究4、20、37、50和60 ℃恒温贮藏过程中高温高压海参组织结构的变化规律。探究了不同贮藏温度对高温高压海参体壁组织结构变化的影响,以及贮藏过程中胶原纤维束和胶原蛋白分子结构发生的变化。从而为通过人工干预,有效地遏制组织结构的劣化速率提供理论依据,对延长刺参产品的货架期具有重大意义。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜刺参(Stichopusjaponicus),青岛南山水产品市场。
平板计数琼脂,青岛海博生物技术有限公司;NaCl、戊二醛、无水乙醇,国药集团化学试剂有限公司。
1.1.2 仪器与设备
TMS-PRO型质构仪,美国FTC公司;HD-3A型智能水分活度测量仪,无锡市华科仪器仪表有限公司;LDZX-50KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂;HPG-320H型人工气候箱,哈尔滨市东联电子技术开发有限公司;JSM-840型扫描电子显微镜、JEM-2000EX型透射电子显微镜,日本JEOL公司。
1.2 实验方法
1.2.1 样品处理
新鲜刺参去内脏后于60 ℃水浴处理3 min,然后在沸水浴中煮沸10 min。去掉头尾后按照“十字”进行4等分。单独包装后在121 ℃热处理15 min。热处理完成后,分别在4、20、37、50和60 ℃贮藏30 d,期间取样并分析。
1.2.2 菌落总数的测定
采用国标GB4789.2—2016的方法测定高温高压海参中的菌落总数[10]。
1.2.3 TPA参数的测定
将样品切割成小块后放到测试台上,采用5 kg的称重传感器。直径4 mm的圆柱型探头以50 mm/min的速度下压,将样品压缩至原始高度的70%,循环操作2次[11]。分析样品的硬度、弹性、黏聚性、咀嚼性、恢复性[12]。
1.2.4 水分含量的测定
采用恒温干燥法(GB5009.3—2010)测定高温高压海参中水分含量。
1.2.5 水分活度的测定
将样品剪碎后置于水分活度仪中,在25 ℃待平衡后读取数据,测量时间为20 min[13]。仪器使用前用过夜放置的饱和NaCl溶液进行校正。
1.2.6 SEM图像的测定
将样品在2.5%(体积分数)的戊二醛溶液中4 ℃固定2 h[14]。梯度乙醇脱水后用临界点干燥法进行干燥。离子溅射喷金后在扫描电子显微镜下观察和拍照。
1.2.7 TEM图像的测定
将样品放入2.5%(体积分数)的戊二醛溶液中4 ℃固定3 h。包埋后用LKB超显微仪进行切片(70 nm),用醋酸铀酰和柠檬酸铅染色后在透射电子显微镜下观察和拍照[15]。
2 结果与分析
2.1 贮藏过程中菌落总数的变化情况
由表1可知,高温高压热处理过程中,微生物已完全失活;在不同温度贮藏0~30 d,均未检测到微生物。证明本实验采用的处理条件和贮藏时间内,微生物已经被完全灭活。前期的研究结果表明,内源酶也已完全失活。因此,本实验中高温高压海参组织结构的变化均是由非酶非微生物因素引起的。赵园园等[16]的研究结果发现类似的灭菌条件可以灭活仿刺参中的微生物,侧面证明了此灭菌条件确实可以完全灭活微生物,排除了微生物对贮藏过程中仿刺参组织结构变化的影响。基于以上前提,本论文将进一步分析非酶非微生物因素对高温高压海参体壁组织结构变化的影响。
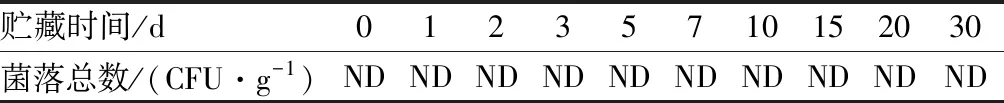
表1 高温高压刺参组织在不同温度贮藏过程中菌落总数的变化Table 1 Changes of the total number of colonies of high temperature and high pressure sea cucumber during storage at different temperatures
注:ND表示未检出。
2.2 贮藏过程中TPA参数的变化情况
由图1-a和图1-b可知,在不同温度贮藏0~30 d时,各组的硬度和咀嚼性均呈逐渐减小的趋势,表明贮藏温度的差异并不能改变高温高压海参体壁组织非酶凝胶劣化的过程。然而,硬度和咀嚼性减小的速率与贮藏温度呈显著性正相关。推测原因是贮藏过程中高温高压海参体壁的组织结构逐渐被破坏和降解,且贮藏温度的升高加速了组织被破坏的速率[17]。夏培浩等[18]研究了即食海参在25 ℃贮藏30 d过程中刺参品质的变化情况,结果表明,硬度和咀嚼性均呈下降的趋势。马桂兰等[19]研究了刺参在4、20和37 ℃贮藏过程中TPA参数的变化情况。实验结果证实贮藏过程中各组的硬度和咀嚼性均呈下降趋势,且下降的速率与贮藏温度呈正比。一阶动力学方程:y=aebx,已经被广泛应用于研究组织劣化的动力学过程[20-21]。采用此劣化模型,对不同温度贮藏过程中高温高压海参的硬度和咀嚼性进行方程拟合,结果如表2所示。通过计算半数衰减周期(T50),发现硬度和咀嚼性的T50值均随着贮藏温度的升高而显著性下降,证明了硬度和咀嚼性的贮藏稳定性与贮藏温度呈显著性负相关。以上实验结果表明贮藏温度是影响高温高压海参硬度和咀嚼性的重要因素,且贮藏温度与硬度和咀嚼性下降的速率呈显著性正相关。
由图1-c可知,当4 ℃贮藏时,高温高压海参组织的弹性并没有发生明显的变化;当20~60 ℃贮藏时,弹性随贮藏时间的延长而减小,且减小的速率与贮藏温度呈正比。由图1-d和图1-e可知,贮藏温度与黏聚性和恢复性的变化没有明显的相关性;在整个贮藏过程中,黏聚性和恢复性的变化没有规律性。ZHANG等[22]研究了高温高压海参组织在37 ℃贮藏过程中弹性和黏聚性的变化规律,得出结果与本文一致。
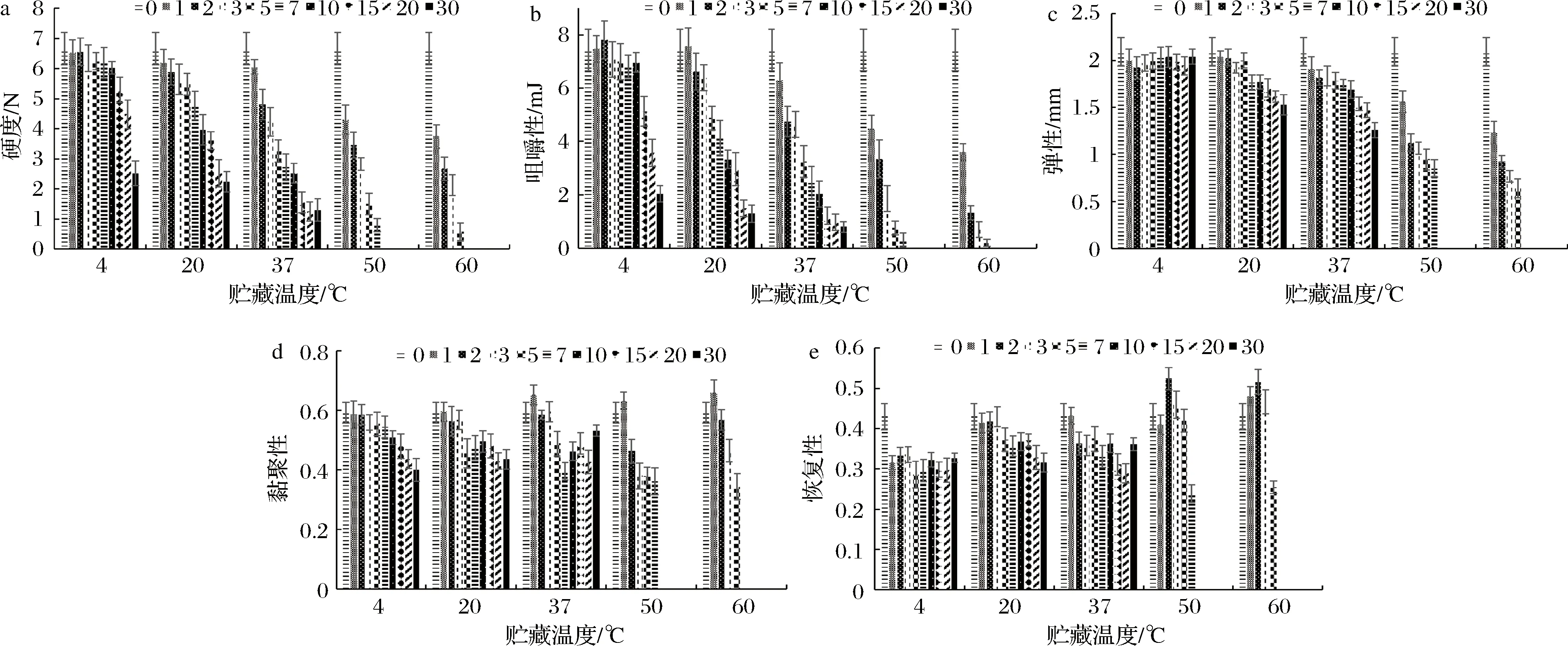
a-硬度;b-黏聚性;c-弹性;d-黏聚性;e-恢复性图1 高温高压刺参组织在不同温度贮藏时TPA参数的变化Fig.1 Changes of TPA parameters of high temperature and high pressure sea cucumber during differentstorage temperatures
表2 高温高压刺参组织在不同温度贮藏过程中硬度和咀嚼性的拟合结果Table 2 The fitting results of the hardness and chewiness of high temperature and high pressure sea cucumber during storage at different temperatures
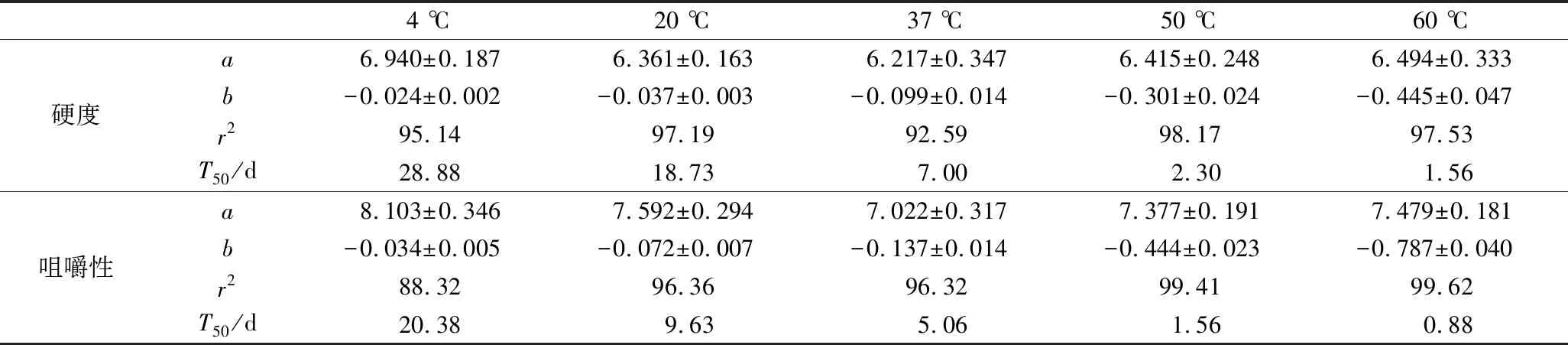
4 ℃20 ℃37 ℃50 ℃60 ℃硬度a6.940±0.1876.361±0.1636.217±0.3476.415±0.2486.494±0.333b-0.024±0.002-0.037±0.003-0.099±0.014-0.301±0.024-0.445±0.047r295.1497.1992.5998.1797.53T50/d28.8818.737.002.301.56咀嚼性a8.103±0.3467.592±0.2947.022±0.3177.377±0.1917.479±0.181b-0.034±0.005-0.072±0.007-0.137±0.014-0.444±0.023-0.787±0.040r288.3296.3696.3299.4199.62T50/d20.389.635.061.560.88
以上实验结果表明贮藏温度是影响高温高压海参质构特性的关键性因素。因此,可以通过降低贮藏温度而显著性减缓TPA参数的变化速率。
2.3 贮藏过程中水分含量和水分活度的变化情况
由图2-a可知,在贮藏0~30 d的过程中,各组样品的水分含量均呈先增大后基本不变的趋势,且增大的速率与贮藏温度呈显著性正相关。在贮藏过程的后期,水分含量不再发生明显变化且各组的水分含量之间并没有显著性的差异。原因可能是贮藏过程中,在高温高压灭菌过程中失去的水分子又重新回吸到高温高压海参的胶原纤维束中[23]。随着贮藏温度的升高,复水过程的速率显著加快,因此水分含量增加的速率也显著加快。当复水过程完成后,各组的水分含量不再发生显著性变化。PENG等[9]研究了高温高压海参组织在37 ℃贮藏过程中水分含量的变化情况,研究结果同样发现水分含量呈先增大后基本不变的趋势。
水分活度反映了高温高压海参组织中水分子的存在状态以及自由水与结合水的比例[24]。由图2-b可知,随着贮藏时间的延长,各组的水分活度均呈增大的趋势,且增大的速率与贮藏温度呈正比。推测原因是贮藏过程中高温高压海参组织不断地从包装袋内回吸水分,且贮藏温度的升高加速了回吸速率。另一方面,高温高压海参的组织结构在贮藏过程中发生了非酶凝胶劣化现象,部分机械水和结合水转化为自由水[25]。CHEN等[8]研究了高温高压海参在4 ℃贮藏过程中水分活度的变化情况,同样发现各组的水分活度均随着贮藏时间的延长而呈现增大的趋势。
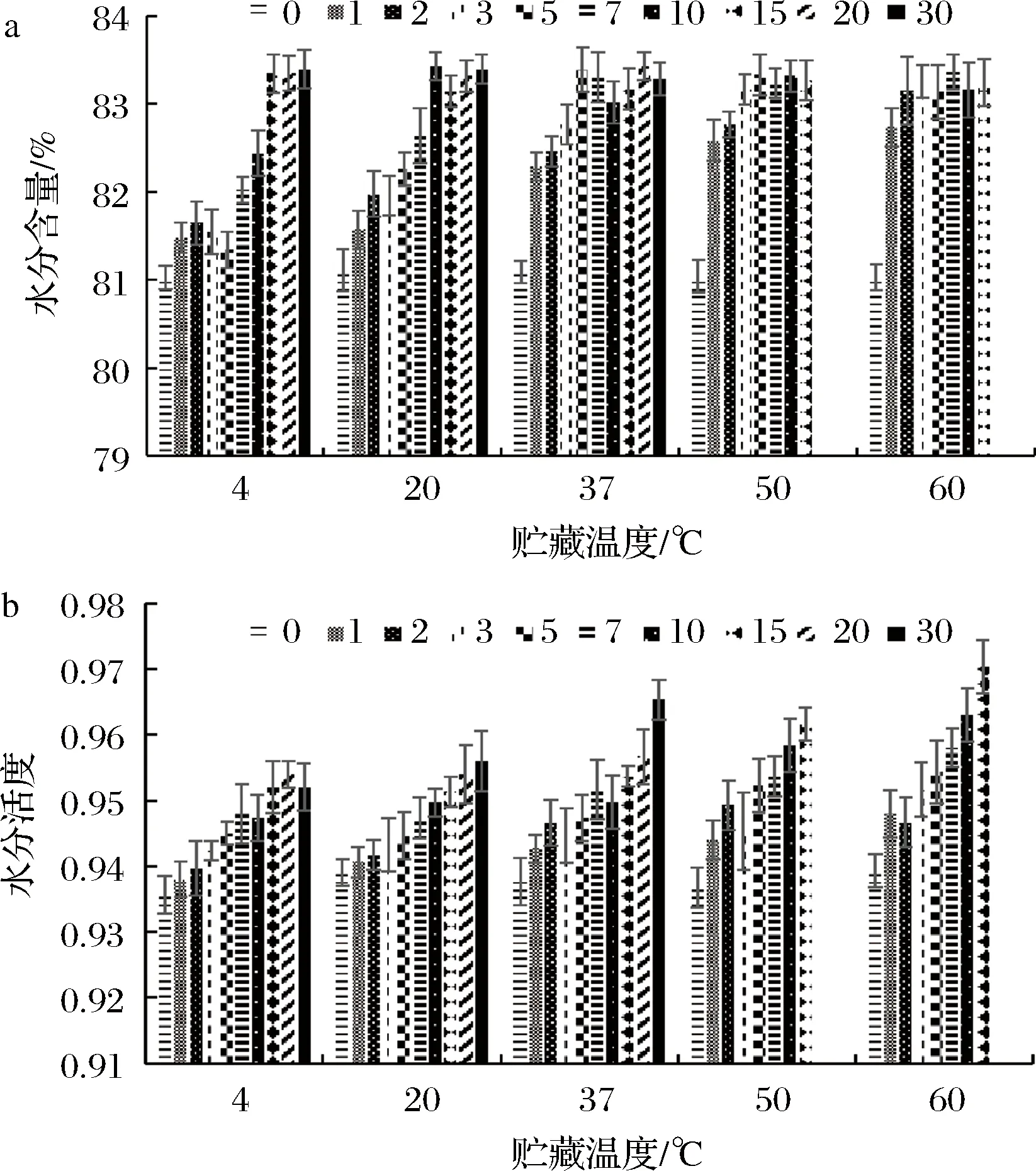
a-水分含量;b-水分活度图2 高温高压海参组织在不同温度贮藏时水分含量和水分活度的变化Fig.2 Changes of moisture content and water activity of high temperature and high pressure sea cucumber during different storage temperatures
2.4 贮藏过程中SEM图像的变化情况
由图3可知,高温高压海参在不同温度贮藏过程中,组织结构均发生了非酶凝胶劣化现象。当在4 ℃和20 ℃贮藏时,体壁组织排列较为致密,结构较为完整,图中未观察到明显的断裂情况。当贮藏温度升高到37 ℃时,组织结构被大程度地破坏。图中可以观察到明显的断裂现象,组织结构呈片层状结构。在60 ℃贮藏过程中,片层状结构被进一步破坏和降解,体壁组织呈现出泡沫状结构。以上实验结果表明胶原纤维束结构在贮藏过程中被逐渐破坏,且被破坏的程度与贮藏温度呈正相关,并且不同的贮藏温度并不能改变非酶凝胶劣化的过程。赵圆圆等[16,26]研究了即食刺参在25 ℃贮藏过程中微观结构的变化情况,同样发现刺参体壁中胶原纤维束的结构逐渐变得混乱。ZHANG等[22]采用VG染色法,研究了高温高压海参组织在37 ℃贮藏过程中胶原纤维束结构的变化情况,也发现胶原纤维束的结构被逐渐破坏和降解。
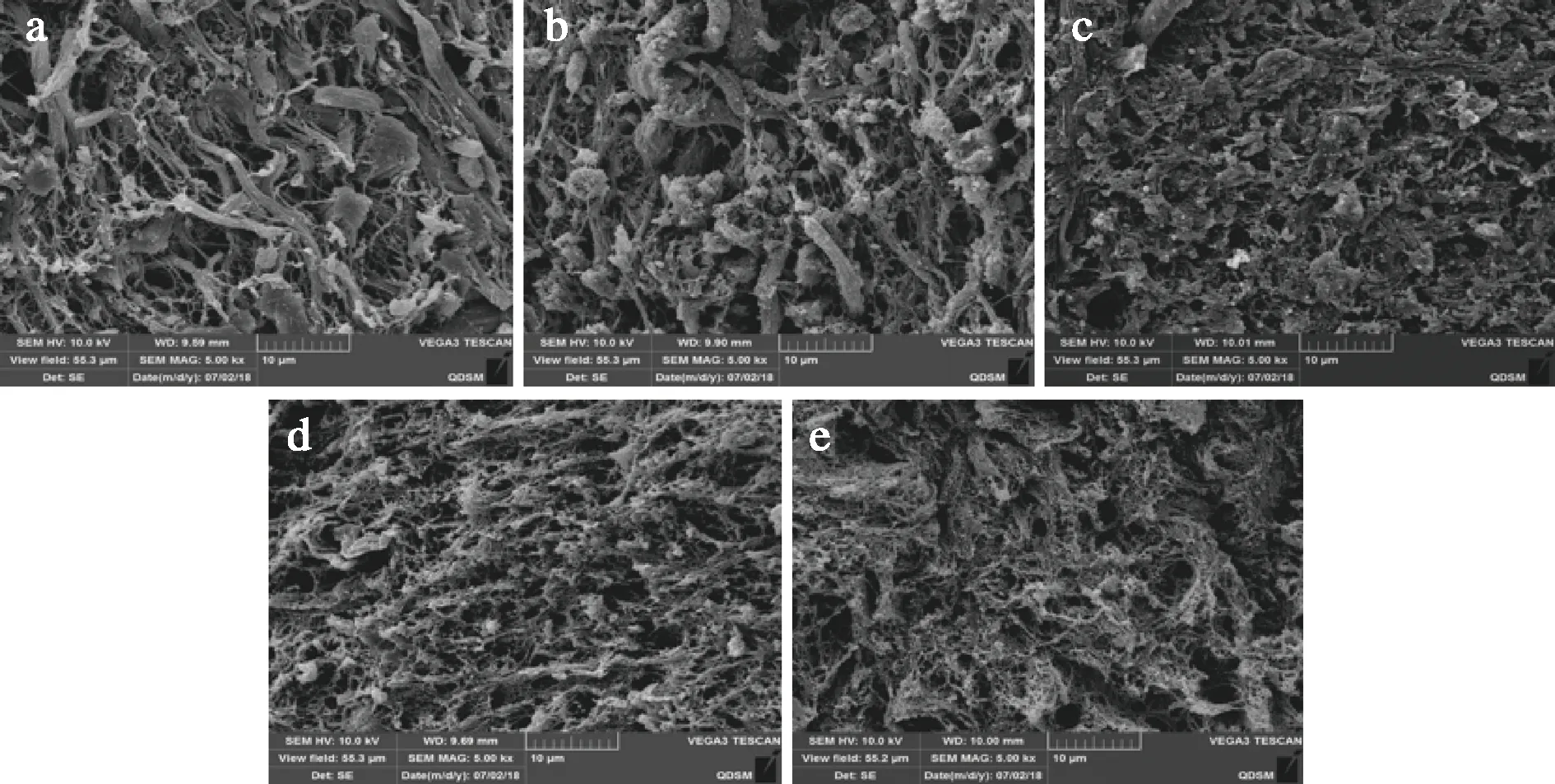
a-4 ℃;b-20 ℃;c-37 ℃;d-50 ℃;e-60 ℃图3 高温高压海参组织在不同温度贮藏5 d时SEM(×5 000)图像的变化Fig.3 Changes of SEM (×5 000) images of high temperature and high pressure sea cucumber during different storage temperatures for 5 days
2.5 贮藏过程中TEM图像的变化情况
新鲜的刺参组织在透射电镜下可以观察到明暗相间的D-周期结构,这是由胶原纤维的1/4错位排列而引起[27]。由图4可知,在不同的温度贮藏5 d后,各组高温高压海参的微观结构均发生了显著性变化。在TEM图像中均没有观察到D-周期结构,证明胶原纤维的结构已经被较大程度地破坏了。图中仅能观察到条带状结构,这是D-周期结构部分降解后的产物。在贮藏过程中,条带状结构被逐渐破坏和降解,且被破坏的程度与贮藏温度呈显著性正相关。当贮藏温度升高到60 ℃时,图中已经观察不到条带状结构。组织结构发生了较大程度地断裂和降解,呈现出片段化结构。由以上的实验结果可知,随着贮藏温度的升高,高温高压海参组织被破坏的程度逐渐加重。
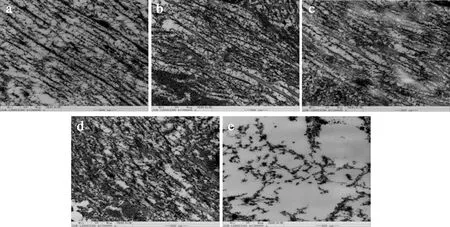
a-4 ℃;b-20 ℃;c-37 ℃;d-50 ℃;e-60 ℃图4 高温高压海参组织在不同温度贮藏5 d时TEM(×50 000)图像的变化Fig.4 Changes of TEM (×50 000) images of high temperature and high pressure sea cucumber during different storage temperatures for 5 days
3 结论
高温高压海参组织在不同温度贮藏过程中,均发生了非酶非微生物因素引起的劣化现象。微观结构被破坏程度与贮藏温度呈显著性正相关,因此,可以通过降低贮藏温度而有效地减小高温高压海参体壁结构的破坏程度,从而延长高温高压海参产品的货架期。
