葛花解酒活性与成分
2019-11-07陈花徐德平
陈花,徐德平
(江南大学 食品学院,江苏 无锡,214122)
葛花为豆科植物野葛(Puerarialobata(Willd.)Ohwi)或甘葛藤(PuerariathomsoniiBenth)的干燥花[1]。《神农本草经》记载其性甘、味凉[2],具有解酒护肝、抗肿瘤、降压、降血脂等功效,长期以来主要被用作治疗酒毒引发的呕吐、发热烦渴、不思饮食、吐血等不适症状,素有“千杯不醉葛花汤”的美名[3-6]。刘建书[7]等证实饮料中添加葛花醇提物可以显著预防小鼠酒精急性中毒。葛花中主要化学成分有黄酮类、挥发油、皂苷类等,且异黄酮类为解酒的主要功效组分之一[8-10],刘莹等[11]研究表明葛花醇粗提物与葛花总异黄酮有良好的解酒效果;姚美村等[12]研究制备了葛花水提物、乙醇提取物,发现其中的异黄酮提取物对于酒精性肝损伤具有很好的保护作用。可见葛花的解酒功效研究还在处粗提物上,其解酒的功效成分及机理还未见相关的实验证实。近年来,由于醉酒导致的社会和健康问题[13-14]引起了社会各界广泛关注,解酒产品的需求越来越大,葛花因其价廉、高效、安全的优势在解酒产品的开发上有更广阔的前景。
本文采用小鼠急性酒精中毒模型,对葛花解酒功效成分进行系统筛选和分离研究,旨在明确葛花解酒的功效成分、以便对葛花进行更加充分,高效地开发利用。
1 实验材料
1.1 材料与试剂
葛花,安徽亳州中药市场;雄性ICR小鼠(体质量18~22 g),上海斯莱克动物实验动物有限公司;GF254型硅胶板,南京金留化玻璃仪器公司; AB-8型大孔吸附树脂,天津南开大学化学工厂;ODS填料,Nacalai Tosoh Inc;MCI GEL填料,Mitsubishi Chemical Corporation;ADH、ALDH试剂盒,南京建成生物工程有限公司。
1.2 主要仪器设备
安捷伦7890B型气相色谱仪,美国安捷伦科技有限公司;YF8-5型磨粉机,浙江省瑞安市永历制药机械有限公司;RAT-100 型萃取罐,无锡申科仪器有限公司;HH-2型数显恒温水浴锅,上海市力辰科技有限公司;RE-52A旋转蒸发器,上海亚荣科技有限公司; KB600型恒流泵,福建省新自立电机有限公司;ZF-90 型暗室紫外投射仪,上海顾顺电光仪器厂;Avance 500 MHz型核磁共振仪,bruker公司。
2 实验方法
2.1 葛花提取物的制备与粗分离
称取10 kg葛花粉碎后过40目筛,置于100 L萃取罐中,按1∶10(g∶mL)料液比加入体积分数为80%的乙醇,60 ℃条件下搅拌提取3 h,过滤取滤液,滤渣按上述方法重复提取2次,合并3次滤液进行减压浓缩得到醇提物。滤渣继续按1∶10(g∶mL)料液比加入去离子水,60 ℃条件下重复搅拌提取1次,合并滤液减压浓缩得葛花水提物(E)。
将葛花醇提物上AB-8型大孔树脂(10 cm×150 cm),用水、体积分数为30%、60%、95%的乙醇进行梯度洗脱,薄层色谱法(TLC)跟踪检测洗脱液中的成分,分别得到水洗脱物(A)、体积分数为30%乙醇洗脱物(B)、体积分数为60%乙醇洗脱物(C)、体积分数为95%乙醇洗脱物(D),将各组分与水提物分别减压浓缩并冷冻保存。
2.2 水提物和醇物解酒活性
取4周龄ICR雄鼠(25.0 g)60只,随机分成6组,每组10只,适应性喂养5 d。于第6天经口给药,每天1次,共7 d,各实验组按1.0 g/(kg·d)剂量灌胃相应的提取物,空白组小鼠灌胃等体积饮用水[15-16]。于给药的第7天进行小鼠行为学实验[17-19]:实验前12 h禁食不禁水,末次给药(给水)后,30 min后空白组和各实验组灌胃45°白酒,灌酒剂量0.17 mL/10 g,记录给药、给酒时间。
(1) 翻正反射实验,观察记录各组小鼠翻正反射消失及恢复时间,计算醉酒潜伏期(自给酒至翻正反射消失时间)及醉睡时间(自翻正反射消失至恢复时间),记录醉酒动物数。翻正反射消失时间以小鼠背部向下保持30 s为标准;当小鼠活动自如、精神、灵活,即为翻正反射恢复。
(2) 攀附实验,小鼠给酒后立即挂在垂直金属网上,以小鼠掉落3次为终点,记录小鼠在网上的攀附时间,反映小鼠酒后肌肉力量情况及醉酒状态。
2.3 大孔树脂洗脱活性组分的分离
将大孔树脂洗脱物中有效解酒组分B上样MCI柱(5 cm×100 cm),用体积分数分别为20%、30%、40%、50%乙醇洗脱,结合TLC法显色反应,分别得到B1、B2和B3、B4 4个部分。
2.4 MCI不同洗脱组分的解酒活性检测
按2.2方法将MCI柱分离得到的B1、B2和B3、B4,进行小鼠翻正反射实验和攀附实验,检测各组分的解酒功效。
2.5 解酒活性组分的分离与结构鉴定
将2.4中有解酒活性的B2组分经ODS-D(3 cm×100 cm)、ODS-AQ(3 cm×100 cm)色谱柱进行分离,用体积分数为20%乙醇溶剂梯度洗脱,TLC薄层法跟踪检测洗脱液,将Rf值和显色反应一致的洗脱液合并,分离得3个单体化合物Ⅰ、Ⅱ、Ⅲ,用氘代二甲亚砜溶解进行1H NMR和13C NMR等光谱测定。
2.6 单体化合物的解酒功效研究
2.6.1 单体化合物解酒功效的行为学测定
将3个单体化合物按2.2的方法进行翻正反射实验,观察记录醉酒潜伏期及醉睡时间,判定3个单体化合物的解酒功效。
2.6.2 小鼠血液乙醇浓度及ADH、ALDH活性的测定
(1)血液乙醇浓度的测定。小鼠按2.2中的方法给药,末次给酒1 h后,眼眶取血,置肝素抗凝试管中,GC法进行血醇浓度的检测,色谱条件[20-21]为:N2流速2.0 mL/min;柱温柱温起始温度75 ℃,以8 ℃ /min升到120 ℃,保持2 min,再以10 ℃/min升到150℃,保持2 min。顶空条件80 ℃,加热时间300 s。
(2)ADH、ALDH活性的测定。在眼眶采血后,解剖小鼠取出肝脏,用生理盐水浸洗,从每只小鼠肝脏左叶边缘切下一小块组织,用滤纸吸干后电子天平称重。按照ELISA方法测定乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(acetaldehyde dehydrogenase, ALDH)的活性。
2.7 数据处理
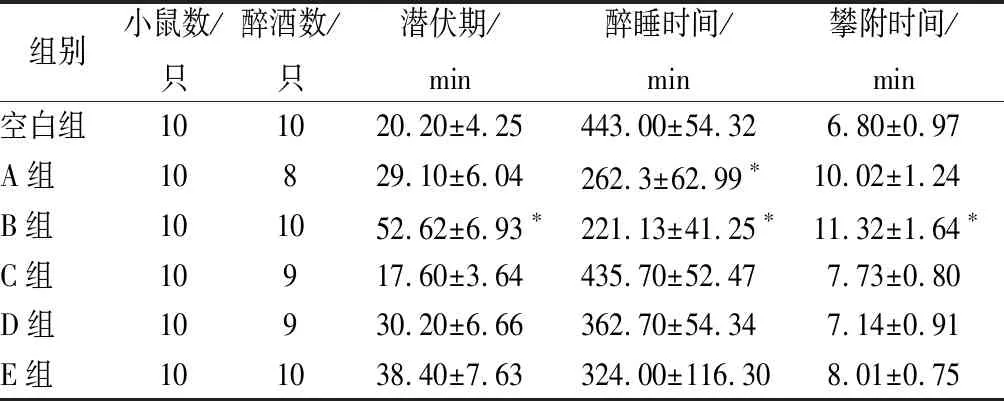
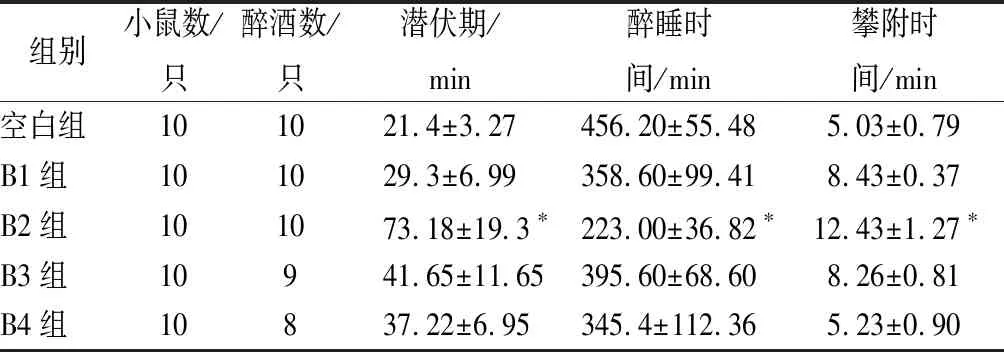
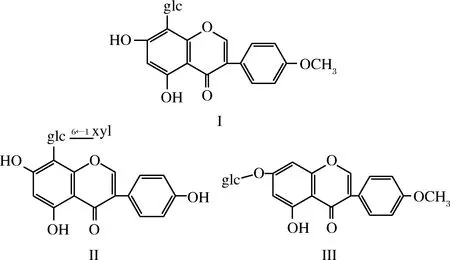
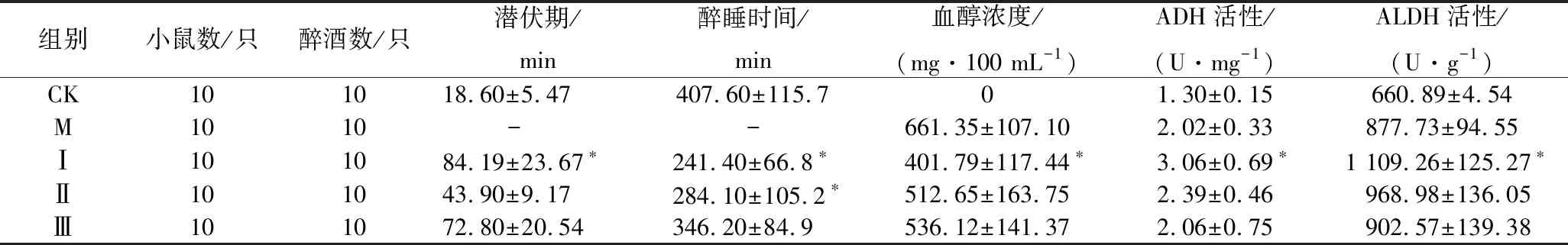
采用SPSS 24.0软件进行处理,数据用(mean±SD)表示,采用单因素方差分析,0.01 水提物与大孔树脂分离的不同洗脱组分对小鼠醉酒时间的影响如表1所示。 表1 葛花不同提取物对小鼠醉酒的影响Table 1 Effects of different extracts of Pueraria lobata on drunkenness in mice 注:*表示与空白对照组比较差异显著(P<0.05)。下同。 由表1可知与空白组相比,A组醉睡时间差异显著,但小鼠耐受时间较差(P>0.05),B组醉酒潜伏期为(52.62±6.93)min,醉睡时间为(221.13±41.25)min,攀附时间为(11.32±1.64)min,具有显著性差异(P<0.05);C、D、E醉酒潜伏期与空白组相比无显著性差异;说明葛花醇提物中体积分数为30%乙醇洗脱物对于缓解小鼠急性酒精中毒的效果最好。 葛花醇提物经大孔树脂分离得到的体积分数为30%乙醇洗脱物具有显著地缓解小鼠急性酒精中毒的效果,该部分经MCI分离后得到B1、B2和B3、B4,4个部分薄层色谱图如图1所示,4个部分的解酒作用见表2,从表2可见,B2组醉酒潜伏期、攀附时间最长,醉睡时间显著缩短,与空白组有显著性差异(P<0.05);B1、B3、B4三组与空白相比效果没有明显提升,说明葛花解酒的功效成分主要集中在MCI柱层析体积分数为20%乙醇洗脱物中。 图1 B1、B2、B3、B4薄层色谱Fig.1 TLC of B1, B2, B3 and B4 表2 MCI不同分离部分对小鼠醒酒时间的影响Table 2 Effects of different extracts of pueraria on intoxication in mice 组别小鼠数/只醉酒数/只潜伏期/min醉睡时间/min攀附时间/min空白组101021.4±3.27456.20±55.48 5.03±0.79B1组101029.3±6.99358.60±99.418.43±0.37B2组101073.18±19.3∗223.00±36.82∗12.43±1.27∗B3组10941.65±11.65395.60±68.60 8.26±0.81B4组10837.22±6.95345.4±112.365.23±0.90 MCI柱层析分离得到具有解酒活性的B2组分,经进一步分离得到3个主要化合物的单体。化合物I为白色结晶,可溶于水,易溶于甲醇、乙醇。从1HNMR(DMSO-d6,500 MHz)可见,δ8.49(1 H,s)、δ7.50(2 H,d,J=8.5)、δ7.43(1 H,s)、δ6.95(1 H,s)、δ5.10(1 H,s),其中δ8.40处单峰H表明为异黄酮化合物,δ5.20为糖端基质子,δ3.20~3.70为糖上的H。从13C-NMR可见,该化合物共有22个碳信号,糖上含有6个C,1个—OCH3,剩下15个碳信号,可以认定化合物为黄酮化合物,结合135DEPT可知δ152.9为—CH信号,因此可得化合物为异黄酮类,通过以上分析并参照相关文献[22-25]得出化合物为8-C-葡萄糖-鹰嘴豆素甲,化学结构见图2。 图2 化合物I、II、III的化学结构Fig.2 The chemical structures of compounds I, II and III 化合物II为浅褐色结晶,可溶于水,易溶于乙醇、甲醇。从1HNMR(DMSO-d6,500 MHz)可见,δ8.40(1 H,s)、δ7.43(2 H,d,J=8.5)、δ6.97(1 H,s)、δ6.87(2 H,d,J=8.5)、δ5.50(1 H,s)、δ5.20(1 H,s),该化合物和化合物1相似,也为黄酮糖类成分,不同的是该化合物含有δ5.20和4.90两个端基质子,说明含有二糖基。从13C-NMR可见,该化合物共有26个碳信号,糖上含有11个C,从碳信号来看一个为葡萄糖,一个为木糖。通过以上分析并与相关文献[22-25]对比得出化合物为8-C-葡萄糖-O-木糖-染料木素,化学结构见图2。 化合物III为不定性浅黄色粉末,可溶于水,易溶于甲醇、乙醇。从1HNMR(DMSO-d6,500 MHz)可见,δ8.40(1 H,s)、δ7.50(1 H,s)、δ7.43(2,d,J=8.5)、δ7.34(1 H,s)、δ6.87(2 H,d,J=8.5)、δ5.20(1 H,d,J=7.0)、δ3.91(3 H,s),其中δ7.43和δ6.87中的4个H组成一个AA′BB′,表明该化合物有苯环对位取代,δ8.40处单峰H表明为异黄酮化合物二位上的H;δ7.50与δ7.34处2个H分别为黄酮A环上C6、C8位;δ5.20为糖端基质子,从偶合常数为7的数值看应为β连接;δ3.91处为甲氧基质子信号,δ3.20~3.70为糖上的H。13C-NMR数据见表3,从表3可见,该化合物共有22个碳信号,其中糖上含有6个C,1个—OCH3,余下15个碳信号,是黄酮类化合物,结合135DEPT可知δ153.0为叔碳信号,可以推断化合物为异黄酮。通过以上分析并参照相关文献[22-25]判断该化合物为印度黄酮苷,化学结构见图2。 表3 化合物I、II、III 的13C核磁共振数据Table 3 13C NMR spectroscopic data of compoundI,II and III 注:“-”表示不存在此位。下同。 各单体化合物解酒作用见表4,从表中可以看出与空白组相比,化合物Ⅰ组的醉酒潜伏期和醉睡时间均有显著差异(P<0.05);化合物Ⅱ组的醉睡时间与空白组有显著差异(P<0.05),但耐受时间没有显著提高;化合物Ⅲ组的醉酒潜伏期与醉睡时间均无显著差异(P>0.05)。表明化合物Ⅰ为葛花中解酒的主要功能成分,化合物Ⅱ也能较好地缩短醉酒时间,化合物Ⅰ、Ⅱ是否具有协同作用还需进一步研究。 在小鼠血醇浓度方面,化合物Ⅰ组血醇浓度与模型组相比大幅下降且具有显著差异,其余2组有所降低但无显著效果。在ADH、ALDH活性方面,模型组2种酶活性略有升高,化合物Ⅰ组与空白组及模型组相比均具有显著差异,其余2组酶活性提升方面无显著效果。ADH、ALDH是体内参与乙醇代谢的主要酶,能在氧化型辅酶存在下将乙醇氧化为乙醛,再由乙醛分解成乙酸,从以上结果可以得出化合物Ⅰ通过提高肝脏ADH、ALDH活性,加速酒精的分解,降低机体血醇浓度达到解酒作用。 本文筛选到3个化合物,其中化合物Ⅰ解酒效果最好,化合物Ⅱ有一定效果,化合物Ⅲ无作用,从三者的化学结构来看都为异黄酮类,其中化合物Ⅰ与Ⅲ的C4′位都为—OCH3,但化合物Ⅰ、Ⅲ的糖链分别连在C8位和C7位,推测C8位的糖链影响了解酒作用的有无;化合物Ⅰ与Ⅱ C8位都存在糖链,但化合物Ⅱ C4′位为—OH,推测C4′位的基团影响了解酒活性的大小。 表4 单体化合物的解酒功效Table 4 Antidrunk effect of monomer compounds 葛花经乙醇提取,大孔树脂、MCI柱、ODS层析柱分离,结合解酒活性筛选,得到3种单体化合物,分别为8-C-葡萄糖-鹰嘴豆素甲、8-C-葡萄糖-O-木糖-染料木素、印度黄酮苷。其中化合物Ⅰ能显著延长醉酒潜伏期、缩短醉酒时间,提高ADH和ALDH的活性,降低机体血醇浓度,具有极好的解酒效果;化合物Ⅱ有一定程度解酒作用;化合物Ⅲ在解酒方面则无作用。 本文首次分离并明确8-C-葡萄糖-鹰嘴豆素甲为葛花中解酒的功效成分,且由化合物的解酒效果及基团连接的不同分析推测该化合物中C8位和C4′位基团影响了解酒功效,而该位置的基团是直接决定或是通过和主环的相互作用影解酒效果还需要进一步科学验证。且该化合物提高ADH和ALDH水平的机理也需进一步研究。3 结果与讨论
3.1 葛花醇提物分离组分和水提物对小鼠醉酒时间的影响
3.2 MCI不同分离部分的解酒作用

3.3 单体化合物的鉴定

3.4 单体化合物的解酒功效
4 结论
