南美对虾主要过敏原检测样品的快速简便预处理方法
2019-11-07林昕梁田田卢瑛
林昕,梁田田,卢瑛,2,3*
南美对虾主要过敏原检测样品的快速简便预处理方法
林昕1,梁田田1,卢瑛1,2,3*
1. 上海海洋大学 食品学院, 上海 201306 2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306 3. 农业部水产品贮藏保鲜质量安全风险评估实验室(上海), 上海 201306
为了开发一种适合于试纸条法快速检测南美白对虾主要过敏原原肌球蛋白(Tropomyosin,Tm)的简单快速的样品前处理方法。本实验设计了8种预处理方法,并通过BCA蛋白定量、十二烷基硫酸钠聚丙烯酰胺凝胶电泳、免疫印迹和层析试纸条检测比较分析了8种方法的可行性。结果发现,采用方法8制备的样品提取液蛋白质浓度适中(2.5 mg/mL),杂蛋白较少且对磁性纳米探针标记的免疫层析检测干扰少,较适合于现场快速检测。本研究优化的虾类过敏原Tm的样品前处理方法为:用丙酮抽提虾肉至无色,加入20 mM Tris-HCl(pH 9.2)匀浆30 s,超声处理10 min,加热5 min,冷却后用迷你离心机离心10 min,所得上清液即为样品。
原肌球蛋白; 南美白对虾; 预处理
食物过敏(Food allergy,FD)作为一类常见的过敏性疾病,近年来发病率逐渐升高,几乎5%的成人和8%的儿童有食物过敏的症状,已严重影响了人们的生活健康[1-3]。南美白对虾()是我国人群最常食用的,也是极易引起过敏的特有的甲壳类动物之一[4],其肉味鲜美,营养丰富,是我国虾类养殖的重要对象,远销日本及东南亚国家。原肌球蛋白是南美白对虾中引起过敏的主要过敏原[5],广泛存在于各种鲍、海螺、蛤蜊、竹蛏、贻贝、牡蛎和章鱼等软体动物中以及蟹、龙虾和虾等甲壳类水产品,并且具有较高的同源性[6]。原肌球蛋白是一种过敏性糖蛋白,含糖量为4%左右,分子质量在38~40 kDa之间,等电点为4.5[7]。
目前市场上原肌球蛋白的检测方法主要有质谱、ELISA、PCR等检测手段。质谱方法检测灵敏度高,检测性能稳定,但存在着实验操作费时、所用仪器昂贵、检测费用相对较高等缺点[8]不宜进行现场快速检测;ELISA方法检测灵敏度高,检测限可以达到ng级、特异性高、稳定性好,但存在操作耗时、需要特定环境等缺点,不合适进行现场快速检测[9]。PCR方法稳定性好,既能定性也可以定量,但检测过程易因操作不当受到污染而产生假阳性结果,存在操作要求技术性强、费时等缺陷[6,10],也不适合进行现场快速检测。由于质谱技术、ELISA和PCR方法在便捷程度、检测速度等方面的局限使其难以满足市场应用的需求,因此,除了加强食品的加工、销售过程管理外,建立快速、高效、精确的原肌球蛋白检测方法也显得尤为重要。磁性纳米探针标记免疫层析检测技术是近十几年来迅速发展的一种新型的免疫标记分析技术,其优点是简单快速、无需检测仪器[10],且成本低、无污染[11]、无需专门培训,适合于现场快速检测[12],具有广阔的市场前景及应用价值[13]。磁性纳米免疫层析试纸条可以对南美白对虾中的主要过敏原进行快速检测,但其前处理方法复杂且耗时长,不利于进行现场检测。
目前常用的蛋白质分离纯化方法主要有透析和超滤法,沉淀法(硫酸铵沉淀、等电点沉淀、有机溶剂沉淀等),层析法(离子交换层析、凝胶层析、亲和层析等)[14-18]。Lasekan AO[19]用40%~60%的硫酸铵来纯化虾中的主要过敏原原肌球蛋白。Gámez C和Rahman AMA[20]等将虾制成了丙酮粉然后利用等电点的方法纯化了虾中的主要过敏原。傅玲琳等[21]利用硫酸铵沉淀分离纯化方法纯化了凡纳对虾主要过敏原—原肌球蛋白,虽然这些方法可以得到纯度较高的Tm,但耗时长,浓度较低,并且不易回收利用,仪器复杂,对操作人员的技术要求高,不适合于现场快速检测。
本研究简化了前处理步骤,缩短了时间,运用简易设备快速提取原肌球蛋白,以期与免疫层析检测技术相配套,为过敏原原肌球蛋白的快速现场检测提高技术支撑。
1 材料与方法
1.1 实验材料与仪器
新鲜的南美白对虾购自上海市浦东新区农工商超市。甘氨酸购买于ABCONE公司,HRP标记的羊抗鼠IgG购买自上海威奥生物公司;十二烷基硫酸钠(SDS)、Tween-20、Tris、四甲基乙二胺(TEMED)等均购自美国Sigma公司。MES(2-吗啉乙磺酸,Alafa公司);EDC[1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐],NHS(N-羟基琥珀酰亚胺)购自美国PIERCE公司。磷酸氢二钠、丙酮、氯化钠、碳酸钠、BCA蛋白定量检测试剂盒、磷酸二氢钠、购于上海生工生物工程技术服务有限公司。180 nm羧基磁珠、2 mL磁力架购买自上海奥润微纳新材料科技有限公司;硝酸纤维素膜(CN140)、样品垫、结合垫、吸水垫、购买于上海捷宁生物科技有限公司。垂直板型电泳槽、半干式转膜仪、凝胶成像系统、聚偏二氟乙烯(PVDF)膜(美国Millipore公司);组织匀浆器购自上海苏宁易购;垂直混合器(HS-3)购买于宁波新芝生物科技股份有限公司;迷你离心机购(D1008E)购于江苏海门其林贝尔仪器制造有限公司;高速冷冻离心机(Centrifuge 5810 R)购于德国Eppendorf公司;恒温磁力搅拌器(08-2G)购于上海驰久仪器有限公司。
1.2 方法
1.2.1 虾的过敏原样品提取和制备样品前处理方法前处理方法1是将虾去壳去头去虾线处理,然后按质量和体积比1:5的比例加入10 Mm/L PBS,用电动匀浆器匀浆30 s,将所得混合液进行磁力搅拌10 min,加热5 min后冷却,再用迷你离心机离心(3000 rpm)10 min后取上清作为样品备用。前处理方法2是在方法1的基础上,增加了在匀浆前先用丙酮将虾肉处理至无色措施;前处理方法3是将方法1中将混合液进行磁力搅拌变成了超声处理,其它处理过程同方法1。前处理方法4在方法1的基础上,增加了在匀浆前先用丙酮将虾肉处理至无色措施,并用高速离心机进行离心(12000 rpm)。前处理方法5在方法1的基础上将混合液进行超声处理,离心时用的是高速离心机(12000 rpm)。前处理方法6相较于方法1增加了在在匀浆前先用丙酮将虾肉处理至无色措施,匀浆时加的是含0.5 M NaCl的20 mM Tris-HCl。方法7相比较于方法1匀浆用的缓冲液是含0.5 M NaCl的20 mM Tris-HCl。前处理方法8是在方法1的基础上先用丙酮将虾肉处理至无色用的匀浆缓冲液是含0.5 M NaCl的20 mM Tris-HCl,所得的匀浆液进行的是超声处理。其区别如表1所示:

表1 8种前处理方法
1.2.2 BCA蛋白质含量分析利用BCA蛋白定量试剂盒对样品的蛋白质含量进行定量检测。
1.2.3 SDS-PAGE分析蛋白组分对不同方式提取的蛋白粗提液组分进行SDS-PAGE电泳分析,浓缩胶和分离胶分别是5%和12%,上样缓冲液和待分析样品以1:1的比例混合,沸水煮沸5 min,每孔上样量为每孔8 μL,先是80 V电压跑20 min之后120 V电压跑50 min,当溴酚蓝指示到达底部后电泳结束。之后用染料考马斯亮蓝R-250进行染色2 h,最后经脱色液进行充分洗脱拍照。
1.2.4 Western-blotting分析过敏原组分对不同方式提取的蛋白粗提液组分进行SDS-PAGE电泳后,干转膜仪90 mA电流下60 min转到PVDF膜上,再对膜用5%脱脂奶粉封闭60 min。用PBST洗涤3次后加入实验室自制的Tm过敏原特异性抗体5G5E[22](1:1000),该单抗对甲壳类水产品中的主要过敏原肌球蛋白具有特异性发应,室温孵育1 h。再用PBST洗涤3次后,加入HRP标记的羊抗鼠二抗(1:2500),室温摇床孵育60 min。最后用PBST洗涤3次后加入10 mL去离子水溶解的DAB底物显色反应1 min,用去离子水洗涤后烘干拍照。
1.2.5 免疫层析试纸条检测免疫磁珠纳米探针和免疫层析试纸条的制备参考郑诚等[23]的方法。采用EDC/NHS化学偶联法将Tm的特异性单抗5G5E偶联到超顺磁性磁性纳米微球表面制备免疫磁珠纳米探针。然后将60 μg/mL的Tm富集液和2 mg/mL羊抗鼠IgG包被在硝酸纤维素膜(简称NC膜)上,分别作为检测线T线(Test line)和质控线C线(Control line);再依次将底板、(CN140)、吸水纸、结合垫、样品垫和NC膜进行组装,裁切成0.5 cm宽的试纸条待用。层析检测时,准确移取待测样本105 μL和0.4 μg免疫磁珠、15 μL层析体系(含5%(V/V)Tween-20和2%(w/v)BSA的5 mM硼酸溶液)混合均匀,再缓慢滴加在试纸条的样品垫处层析15~20 min,肉眼观察试纸条的T和C线颜色变化。因层析试纸条采用的是竞争反应原理,因此阴性样本在T线和C线区域有明显的颜色反应,而阳性样本则只有C线有颜色反应,T线无颜色反应。
2 结果与分析
2.1 BCA蛋白定量结果分析
对8种方法处理提取的样品进行BCA蛋白定量分析(表2)。由表可见,方法5和方法7的提取液样品,其蛋白质含量最高,同其他方法存在显著性差异,而方法1~4的提取液样品中的蛋白质含量较少。方法6和8的提取液样品蛋白质含量适中(2.2~2.5 mg/mL)。因为样品取液中有较高浓度的水溶性蛋白质存在,这会改变层析速度,降低层析效果[24],而蛋白质含量太低则意味着目标过敏原Tm的含量很低,容易降低层析检测灵敏度。故此,前处理方法6和8较为适合于免疫层析检测。
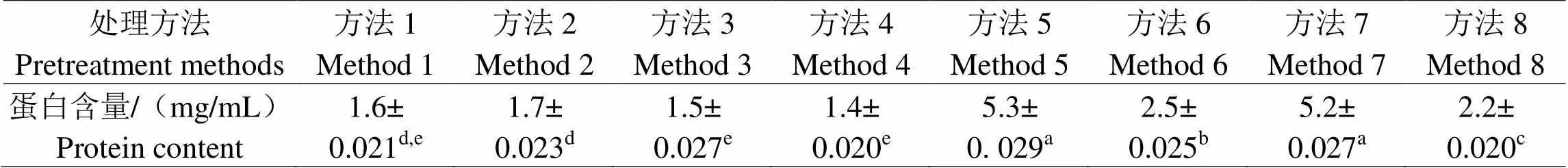
表2 8种不同前处理方法蛋白含量
注:表中不同字母代表同行不同方法中提取蛋白量存在显著性差异,<0.05;字母从大到小代表蛋白含量从高到低。
Note: The different letters in the table represent significant differences in the amount of extracted protein in different methods, P<0.05; letters from large to small represent high to low protein content.
2.2 SDS-PAGE蛋白组分结果分析
8种前处理方法的样品经SDS-PAGE和考马斯染色后的结果如图1所示。由图可知,方法1、2、3和4的提取液样品中Tm目的蛋白(~35kDa)的条带很浅,表明其含量很少。而方法5、6、7和8的提取液样品中Tm目的蛋白条带既粗又宽,表明其含量很高;但是方法5和7样品在分子量66.2~116 kDa时含有较多的杂蛋白。在层析检测时,高分子量蛋白质容易造成堵塞从而影响检测结果。方法6样品在分子量45 kDa和19 kDa时含有杂蛋白。
因此相较于方法5、6和7,方法8的提取液样品更为适合于免疫层析检测。
2.3 Western- blotting分析过敏原组分结果
图2是Western- blotting分析过敏原组分的结果。由图可知,八种方法提取出的原肌球蛋白都具有免疫活性,但1、2、3、4方法提取的原肌球蛋白反应条带很浅,表明其含量很少,与SDS-PAGE的结果相符合。方法5和7在分子量110和45 kDa时出现了非特异性反应条带,方法6和8则没有非特异性反应并且Tm目的条带反应很强。由免疫印迹和SDS-PAGE反应结果可以看出,两处理方法8更适合于免疫层析检测。

图1 8种前处理方法的SDS-PAGE分析结果

图2 8种前处理方法的过敏原性组分
2.4 免疫层析检测的应用可行性分析
将不同前处理方法制备的样品滴加到磁性纳米探针标记的免疫层析试纸条上所得检测结果如图3所示。由图3可以看出,方法1、2、3和4在磁性纳米探针标记的免疫层析试纸条上呈现假阴性结果。SDS-PAGE结果显示这两种方法的Tm含量很少,因此我们推测很可能是因为Tm目标蛋白含量过低导致试纸条未能检测出来从而呈现假阴性结果。5、6和7因在提取的过程中的提取出较多的水溶性杂蛋白,所以在磁性纳米探针标记的层析试纸条检测中出现了堵塞现象,从而导致T和C线颜色很浅。方法8的提取液样品在层析检测中显示出正常的阳性结果。综合考虑蛋白质组分分析结果,我们认为方法8最为适合于免疫层析检测。
由表3可知,方法1、3、5、7提取时间较短,方法1、2、6、7、8提取所用设备简单,易操作,可应用于现场操作,但只有方法8可应用于磁性纳米探针免疫层析试纸条的检测。综合以上分析方法8是最好的样品前处理方法。
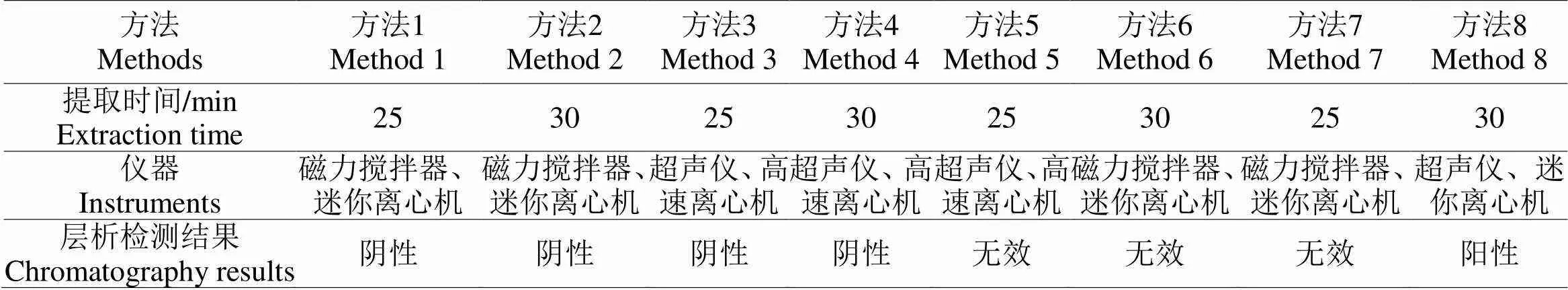
表3 8种前处理方法比较
3 结论
基于磁性纳米探针标记的免疫层析检测技术具有简便、快速,可肉眼判定等优点。但目前提取原肌球蛋白常用的是用硫酸铵的方法,该方法要先制作丙酮粉耗时长操作复杂,不适宜进行现场快速检测。本文中不同的Tm样品前处理方法制备的样品,在应用于磁性纳米探针标记免疫层析检测时产生不同的检测结果。经优化和评价,本研究建立了一种适合于层析检测的虾类主要过敏原原肌球蛋白的样品前处理方法:先用丙酮抽提虾肉至无色,然后按1:5(w/v)的比例加入20 mM Tris-HCl (pH9.2)电动匀浆器匀浆30 s,所得混合液再进行超声处理10 min后加热5 min,冷却后用迷你离心机离心10 min后取上清。该方法耗时短(~30 min),操作简便,可满足现场检测对前处理的要求,今后可作为免疫层析检测技术的配套样品处理方法进行应用,具有较好的应用前景。
[1] Gupta RS, Springston EE, Warrier MR,The prevalence,severity,and distribution of childhood food allergy in the United States[J]. Pediatrics, 2011,128(1):9-17
[2] Castellazz AM, Valsecchi C, Caimmi S,. Probiotics and food allergy[J]. Journal of Pediatrics, 2013,39:47
[3] Sicherer SH, Sampson HA. Food allergy: Epidemiology,pathogenesis,diagnosis,and treatment[J]. J Allergy Clin Immunol, 2014,133(2):291-307
[4] 朱黎娜,侯丽英,张盈莹,等.不同方法提取和处理中华绒螯蟹组织蛋白的过敏原组分分析[J].中国免疫学杂 志,2014(12):1652-1657
[5] Leung NY, Wai CY, Shu S,. Current immunological and molecular biological perspectives on seafood allergy:A comprehensive review[J]. Clinical Reviews in Allergy & Immunology, 2012,46(3):180-197
[6] Kobayashi Y, Yang T, Yu CT,. Quantification of major allergen parvalbumin in 22 species of fish by SDS–PAGE[J]. Food Chemistry, 2016,194:345-353
[7] Huang RF, Li ZX, Lin H,. Determination of microheterogeneous substitution in shrimp tropomyosin and its effect on IgE-binding capacity[J].European Food Research & Technology, 2014,239(6):941-949
[8] Rosalía A, Galina G,Ibáṅez MD,Sarcoplasmic calcium-binding protein is an EF-hand-type protein identified as a new shrimp allergen[J]. Journal of Allergy & Clinical Immunology, 2009,124(1):114-120
[9] 徐晓巍,崔正权,卢瑛,等基于磁性纳米探针的乙肝前S1抗原的快速磁性免疫层析方法的建立[J].生物学杂 志,2016,33(1):98-103
[10] Hiroyuki KA, Yako K, YukihiroK,. Reduction in IgE reactivity of Pacific mackerel parvalbumin by heat treatment[J]. Food Chemistry, 2016,206:78-84
[11] Cai QF, Wang XC, Liu GM,. Development of a monoclonal antibody-based competitive enzyme linked immunosorbent assay (c-ELISA) for quantification of silver carp parvalbumin[J]. Food Control, 2013,29(1):241-247
[12] Ratanasumawang S, Hagiwara T, Sakiyama T. Effect of Sodium Chloride on the Adsorption of Proteins from Pink Shrimp () onto Stainless Steel Surfaces[J]. Food Science & Technology Research, 2015,21(3):327-331
[13] Wu LS, LinHX, Wang GY,. Comparative Study on the Allergenicity of DifferentExtract Solutions[J]. Journal of Ocean University of China, 2014,13(1):157-162
[14] Yu CJ, Lin YF, Chiang BL,. Proteomics and immunological analysis of a novel shrimp allergen, Pen m 2[J]. The Journal of Immunology, 2003,170(1):445-453
[15] Liu GM, Cheng H, Nesbit JB,. Effects of Boiling on the IgE-Binding Properties of Tropomyosin of Shrimp ()[J]. Journal of Food Science, 2010,75(1):T1-T5
[16] Shen HW, Liu YY, Chen F,. Purification, characterization and immunoreactivity of tropomyosin, the allergen in[J]. Process Biochemistry, 2014,49(10):1747-1756
[17] 张轶群,林洪,李振兴,等.虾过敏原蛋白纯化中硫酸铵沉淀法的改进[J].食品与药品,2008,10(6):50-52
[18] 胡志和,张晴青,吴子健,等.超高压处理对凡纳滨对虾原肌球蛋白构象的影响[J].食品科学,2016,37(23):25-31
[19] Lasekan AO, Nayak B. Effects of buffer additives and thermal processing methods on the solubility of shrimp () proteins and the immunoreactivity of its major allergen[J]. Food Chemistry, 2016,200(1):146-153
[20] AbdelL RAM, Lopata AL, O'hehir RE,. Characterization and de novo, sequencing of snow crab tropomyosin enzymatic peptides by both electrospary ionization and matrix-assisted laser desorption ionization QqToF tandem mass spectrometry[J]. Journal of Mass Spectrometry, 2010,45(4):372-81
[21] 傅玲琳,富舒洁,王彦波,等.凡纳对虾原肌球蛋白硫酸铵沉淀分离纯化方法的优化[J].食品科学,2017,38(18):187-192
[22] Lu Y, Ohshima T, Ushio H,. Immunological characteristics of monoclonal antibodies against shellfish major allergen tropomyosin[J]. Food Chemistry, 2007,100(3):1093-1096
[23] Zhen C,Wang XC, Lu Y,. Rapid detection of fish major allergen parvalbumin using superparamagnetic nanoparticle-based lateral flow immunoassay[J]. Advanced Materials Research, 2010,311-313(11):436-445
[24] 方国锋,王锡昌,梁田田,等.基于免疫层析检测的河豚毒素快速样品前处理方法研究[J].生物学杂志,2017,34(1):94-97
A Rapid and Simple Method Pretreating Samples offor Detecting Major Allergens
LIN Xin1, LIANG Tian-tian1, LU Ying1,2,3*
1.201306,2.201306,3.()201306,
We designed eight pretreatment methodsto develop the sample pretreatment method suitable for rapid detection of primary allergen tropomyosin ofmajor allergen tropomyosin (Tm) ofby the test strip method, the application feasibility of eight pretreatment methods was compared and analyzed byBCA Protein Assay Kit, SDS-PAGE, Western Blot, and magnetic immunoblotting chromatographic test. As a result, it was found that the sample prepared by the eighth method had a moderate protein concentration (2.5 mg/mL), less miscrine proteinand less immunochromatography detection interference of the magnetic nano-probe mark,this is suitable for field rapid detection. The optimized sample pretreatment method of shrimp allergen Tm was as follows: the shrimp was extracted with acetone until colorless, 20 mM Tris-HCl (pH9.2) homogenate was added for 30s, ultrasonic treatment for 10min and heated for 5 min. After cooling, it was centrifuged by mini centrifuge for 10 min, the supernatant was the sample.
Tropomyosin(Tm);;pretreatment
Q81
A
1000-2324(2019)05-0796-05
10.3969/j.issn.1000-2324.2019.05.012
2018-02-28
2018-03-28
上海市科技兴农重点攻关项目(沪农科攻字(2016)第4-4号)
林昕(1990-),女,硕士研究生.研究方向为水产品过敏原的检测. E-mail:2273662895@qq.com
Author for correspondence. E-mail:y-lu@shou.edu.cn
