贝参特牌西洋参三七胶囊对氢化可的松所致免疫低下小鼠的影响
2019-11-07袁小平蒲学明于晓风李沅耕睢大筼
袁小平,谢 勇,刘 焱,蒲学明,于晓风,李沅耕,睢大筼*
(1.吉林省北域西洋参研究有限公司,长春130000;2.吉林大学药学院,长春130021)
贝参特牌西洋参三七胶囊(APC)是利用西洋参提取物、三七粉和灵芝破壁孢子粉组方研制的一种用于提高免疫力的保健食品。西洋参(PanaxquinquefoliumL.)为五加科人参属植物,原产于美国和加拿大,国内多个地区已广泛种植。研究表明,西洋参茎叶皂苷通过增强T淋巴细胞转化,具有免疫增强与调节作用,可能与促进T淋巴细胞产生IL-2、IFN-γ表达有关[1]。西洋参水煎液可显著提高小鼠迟发型超敏反应的强度和单核吞噬细胞能力[2]。 三七 [Panax notoginseng(Burk.)F.H.Chen]为五加科植物三七的干燥根和根茎。研究表明,三七水煎剂可提高单核巨噬细胞系统的活性,对SRFC和PFC均有促进作用[3]。三七皂甙在细胞免疫功能、体液免疫功能和NK细胞等方面具有明显的增强作用[4]。破壁灵芝孢子粉能提高细胞免疫力和体液免疫力,提高免疫球蛋白和补体的含量,诱导干扰素的生成,激活自然杀伤细胞和巨噬细胞活性,增强免疫器官胸腺、脾脏、肝脏的重量,从而增强人体对各种疾病的抵抗能力[5,6]。本文观察APC对小鼠特异性及非特异性免疫功能的调节作用,为其开发利用提供科学依据。
1 实验材料
1.1 动物
清洁级ICR雄性小白鼠,体重18.0~22.0g,吉林大学白求恩医学院动物实验中心提供,生产许可证号:SCXK-(吉)2007-0003。实验温度为 24℃, 湿度为60%。
1.2 药品与细胞
西洋参三七胶囊由吉林省北域西洋参研究有限公司提供,批号:20190815;氢化可的松(2mL/支),河南润弘制药股份有限公司生产,批号:1704171;Yac-1小鼠淋巴瘤细胞系细胞,购自武汉普诺赛生命科技有限公司。
2 实验方法
2.1 分组给药及模型建立
200只清洁级ICR雄性小鼠随机分为对照组、模型组及西洋参三七胶囊(APC)低、中、高剂量组,每组40只。对照组及模型组每日灌胃给予0.5%羧甲基纤维素钠20ml/kg,药物组分别灌胃给予APC 0.25、0.5、1.0g/kg,每日1次,连续灌胃30天。除对照组外,各组均于给药第24、26、28、30天皮下注射氢化可的松40 mg/kg,建立小鼠免疫功能低下模型。
2.2 观测指标
2.2.1 小鼠抗体生成能力实验
于给药第27天,各组10只小鼠腹腔注射5%(v/v)鸡红细胞悬液0.2mL进行免疫,第31天,眼球取血,1500 r/min离心5min,取血清,用生理盐水稀释100倍,取稀释后的血清0.5mL与5%(v/v)鸡红细胞悬液0.25mL,10%(v/v)补体 0.25mL 混匀,于恒温箱中 37°C孵育30min,置4°C冰箱中30min终止反应。1500 r/min离心5min,取上清液200μL加入平底96孔板中,在酶标仪540nm下测OD值。另设不加血清的空白孔作为对照孔,以OD值作为判定血清溶血素水平的指标。
2.2.2 小鼠T淋巴细胞转化能力实验
于第31天,各组10只小鼠眼球取血,2000 r/min离心10 min,取血清,按ELISA试剂盒说明书测定血清中TNF-α、IL-6含量。无菌取脾,用含10%小牛血清的1640培养液制成细胞浓度为1×107/ml脾细胞悬液。在平底96孔培养板中每孔加入100μl上述细胞悬液。每只小鼠设3副孔,加100μl 1640培养液。另设ConA刺激3副孔,每孔加入100μl上述脾细胞悬液及100μlConA(终浓度为 5μl/ml)。 置于 37°,5%CO2培养箱中孵育44h后每孔加入MTT 10μl(终浓度5mg/ml),继续置于37℃,5%CO2培养箱中孵育4h。弃上清,每孔加入DMSO 100μl,微型震荡器震荡至结晶完全溶解。酶标仪570nm长下测量OD值,计算刺激指数SI。SI=刺激孔OD值/对照孔OD值。
2.2.3 小鼠NK细胞活性实验
于第31天,各组10只小鼠无菌取脾,制成脾细胞悬液。取处于对数生长期的靶细胞Yac-1细胞,用含10%胎牛血清的RPMI1640培养液调整细胞浓度为2×105个/mL。U型96孔板中,试验孔加入细胞浓度为1×106个/mL脾细胞悬液100μL,每只小鼠设3复孔,加入靶细胞Yac-1细胞悬液100μL。另设效应细胞对照孔3复孔,加入细胞浓度为1×106个/mL脾细胞悬液100μL及RPMI1640培养液100μL。设靶细胞Yac-1细胞对照孔3复孔,加100μL靶细胞悬液及RPMI1640培养液,37℃孵育4 h后,1000 r/min离心5 min,每孔弃上清液100μL,加入MTT溶液10 μL,置于37℃,5%CO2的二氧化碳培养箱中孵育4 h。孵育结束后2500 r/min离心5 min,弃上清。每孔加入DMSO 100μL,微型振荡器振荡至结晶完全溶解,酶标仪570 nm下读数,计算NK细胞活性,以杀伤率表示。杀伤率(%)=[1-(实验组OD值-效应细胞OD值)/靶细胞 OD 值]×100%。
2.2.4 小鼠巨噬细胞吞噬功能实验
于第31天,各组10只小鼠尾静脉注射用生理盐水稀释10倍的印度墨汁0.1 mL/10g,分别于注射后1 min及5 min从小鼠内眦静脉采血20μL,溶于2 mL 0.1%碳酸钠溶液中,以酶标仪680 nm处测量OD值。并于第二次采血后脱臼处死小鼠,取胸腺、脾脏和肝脏准确称重,以胸腺、脾脏和肝脏重量(mg)/体重(10g)计算胸腺、脾脏和肝脏系数,按下列公式计算吞噬指数k和吞噬活性a。

2.3 统计方法
数据的统计处理采用SPSS 13.0统计软件中单因素方差分析进行均值比较,实验数据以±S表示,采用组间比较t检验,P<0.05表示差异具有显著性。
3 结果
3.1 APC对氢化可的松致免疫低下小鼠脏器系数及巨噬细胞吞噬功能的影响
与对照组比较,模型组小鼠脏器系数及巨噬细胞吞噬能力均明显降低 (P<0.01)。与模型组比较,APC 0.5、1.0g/kg均能明显提高小鼠胸腺和脾脏系数,增强吞噬指数K和吞噬活性α(P<0.05 或P<0.01),0.25g/kg组对小鼠胸腺、肝脏和脾脏系数,吞噬指数K和吞噬活性 α 均无明显影响(P>0.05),结果见表 1、2。
表1 APC对氢化可的松致免疫低下小鼠脏器系数的影响(±s,n=10)
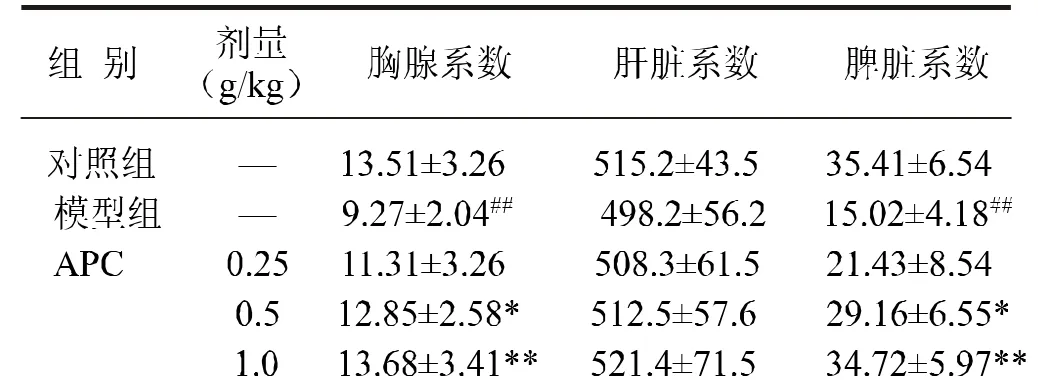
表1 APC对氢化可的松致免疫低下小鼠脏器系数的影响(±s,n=10)
与对照组比较 ##P<0.01;与模型组比较 *P<0.05,**P<0.01
images/BZ_5_1636_2264_1656_2283.pngimages/BZ_5_1891_2264_1909_2283.pngimages/BZ_5_2123_2264_2142_2283.pngimages/BZ_5_1621_2314_1640_2333.pngimages/BZ_5_1897_2314_1917_2333.pngimages/BZ_5_2120_2314_2139_2333.pngimages/BZ_5_1636_2364_1656_2383.pngimages/BZ_5_1892_2364_1911_2383.pngimages/BZ_5_2123_2364_2143_2383.pngimages/BZ_5_1633_2414_1653_2433.pngimages/BZ_5_1888_2414_1907_2433.pngimages/BZ_5_2123_2414_2143_2433.pngimages/BZ_5_1633_2464_1653_2483.pngimages/BZ_5_1888_2464_1907_2483.pngimages/BZ_5_2123_2464_2142_2483.png
表2 APC对氢化可的松致免疫低下小鼠巨噬细胞吞噬功能的影响(±s,n=10)

表2 APC对氢化可的松致免疫低下小鼠巨噬细胞吞噬功能的影响(±s,n=10)
与对照组比较 ##P<0.01;与模型组比较 *P<0.05,**P<0.01
?
2.2 APC对氢化可的松致免疫低下小鼠淋巴细胞转化、NK细胞活性及血清溶血素的影响
与对照组比较,模型组小鼠T淋巴细胞刺激指数,NK细胞杀伤率及血清溶血素生成OD值均明显降低(P<0.01)。 与模型组比较,APC 0.5、1.0g/kg 能明显提高小鼠T淋巴细胞刺激指数,NK细胞杀伤率及血清溶血素生成OD值 (P<0.05或P<0.01),0.25g/kg对小鼠T淋巴细胞转化、NK细胞活性及血清溶血素生成均无明显影响(P>0.05),结果见表3。
表3 APC对氢化可的松致免疫低下小鼠淋巴细胞转化、NK 细胞及溶血素的影响(±s,n=10)

表3 APC对氢化可的松致免疫低下小鼠淋巴细胞转化、NK 细胞及溶血素的影响(±s,n=10)
与对照组比较##P<0.01;与模型组比较*P<0.05,**P<0.01
images/BZ_6_552_1054_572_1074.pngimages/BZ_6_798_1054_817_1074.pngimages/BZ_6_1054_1054_1073_1074.pngimages/BZ_6_554_1104_573_1124.pngimages/BZ_6_799_1104_818_1124.pngimages/BZ_6_1051_1104_1071_1124.pngimages/BZ_6_552_1154_571_1174.pngimages/BZ_6_792_1154_811_1174.pngimages/BZ_6_1048_1154_1067_1174.pngimages/BZ_6_554_1204_573_1224.pngimages/BZ_6_790_1204_809_1224.pngimages/BZ_6_1046_1204_1066_1224.pngimages/BZ_6_555_1254_574_1274.pngimages/BZ_6_793_1254_813_1274.pngimages/BZ_6_1053_1254_1072_1274.png
2.3 对氢化可的松致免疫低下小鼠血清TNF-α及IL-6含量的影响
与对照组比较,模型组小鼠血清中TNF-α及IL-6水平均明显降低(P<0.01)。与模型组比较,APC 0.5、1.0g/kg均能明显提高免疫功能低下小鼠血清TNF-α及 IL-6 水平(P<0.05 或P<0.01),0.25g/kg对小鼠小鼠血清TNF-α 及IL-6水平均无明显影响 (P>0.05),结果见表4。
表4 APC对氢化可的松致免疫低下小鼠血清TNF-α 及IL-6含量的影响 (±s,n=10)

表4 APC对氢化可的松致免疫低下小鼠血清TNF-α 及IL-6含量的影响 (±s,n=10)
与对照组比较##P<0.01;与模型组比较*P<0.05,**P<0.01
images/BZ_6_549_2079_570_2104.pngimages/BZ_6_598_2079_617_2104.pngimages/BZ_6_648_2181_668_2201.pngimages/BZ_6_968_2181_988_2201.pngimages/BZ_6_650_2231_669_2251.pngimages/BZ_6_968_2231_988_2251.pngimages/BZ_6_646_2281_666_2301.pngimages/BZ_6_966_2281_986_2301.pngimages/BZ_6_642_2331_661_2351.pngimages/BZ_6_965_2331_984_2351.pngimages/BZ_6_644_2381_664_2401.pngimages/BZ_6_967_2381_987_2401.png
3 讨论
免疫系统主要由免疫器官、免疫细胞和免疫分子组成。中枢免疫器官包括胸腺和骨髓,外周免疫器官包括脾脏、淋巴结和黏膜免疫系统。胸腺、脾脏可最直观地体现机体的免疫功能。当病原体进入并攻击人体后,巨噬细胞及自然杀伤细胞等固有免疫细胞会释放细胞因子来刺激适应性免疫的激活[7]。在适应性免疫应答中,抗原特异性淋巴细胞增殖并分化成能够消除病原体的T淋巴细胞和B淋巴细胞,这样免疫系统可以在病原体再次攻击时产生更快速、有效的反应[8]。NK细胞是参与固有免疫的重要成员,无需预先致敏即可破坏受损的细胞和某些肿瘤细胞,应答速度快,在免疫应答早期即可发挥作用[9]。在抗原进入机体并被免疫系统识别后,可从淋巴细胞抗原受体库中将结构与其互补的细胞克隆挑选出来,并进一步激活,从而产生特异性抗体,而通过对抗体生成能力进行检测,即可评价相应的体液免疫功能[10]。当T淋巴细胞受ConA刺激后部分小淋巴细胞转化为不成熟的母细胞,进行有丝分裂发生母细胞增殖反应,可使用MTT比色法检测母细胞的增殖率来表示T淋巴细胞的转化率,进而评价细胞免疫功能[11]。本研究结果表明,APC可明显提高氢化可的松致免疫功能低下小鼠脾脏和胸腺的脏器系数,增强免疫功能低下小鼠巨噬细胞的吞噬能力,提高NK细胞的杀伤活性、T淋巴细胞转化率及血清溶血素和TNF-α和IL-6细胞因子水平,提示其可有效增强固有免疫、适应性免疫应答强度,提高细胞因子水平,对小鼠非特异性及特异性免疫功能均具有增强作用。
