基于热转换元素分析同位素比质谱法研究水样中有机物对氢稳定同位素比值的影响
2019-11-06郝新丽韩思航杨磊戴忆竹黄璐瑶王竞铮
郝新丽, 韩思航, 杨磊, 戴忆竹, 黄璐瑶, 王竞铮
(1.河北地质大学水资源与环境学院, 河北 石家庄 050031;2.河北省水资源可持续利用与开发重点实验室, 河北 石家庄 050031;3.河北省水资源可持续利用与产业结构优化协同创新中心, 河北 石家庄 050031)
氢稳定同位素广泛应用于水文水资源、环境地质、地球科学等领域的研究,特别是在研究地下水补径排、地表径流、水体循环等方面有着重要意义[1-7]。因此,水样氢稳定同位素含量的变化规律是研究者们密切关注的课题[8-11]。为了提高氢稳定同位素比值测定的准确性,氢稳定同位素的检测技术也迅速发展。目前,水中氢稳定同位素比值(δ2H)的测定方法主要有:激光同位素光谱法、离线流铂催化H2-H2O同位素平衡反应(GasBenchⅡ-IRMS)、传统的离线双路进样同位素比质谱法(Dual-inlet IRMS)和热转换元素分析同位素比质谱法(TC/EA-IRMS)[12-18]。张琳等[19]研究发现应用Dual-inlet IRMS与GasBenchⅡ-IRMS法测试氢氧同位素的精密度与准确度高,但Dual-inlet IRMS操作复杂,实验流程长,而应用GasBenchⅡ-IRMS分析氧同位素组成,样品量少,实验效率高,在微量水样氧同位素分析技术方面具有一定优势。袁红朝等[20]应用TC/EA-IRMS和GasBenchⅡ-IRMS两种方法分析微量水样中氢氧同位素组成,经比较认为TC/EA-IRMS测定系统更具优势。张琳等[21]也比较了GasBenchⅡ-IRMS、TC/EA-IRMS与激光光谱法测定氢氧同位素的不同,认为激光光谱法的精密度及准确度更优于质谱法,但对于含有有机物的水样,其中的有机物会造成光谱干扰,因此在测定含有有机物的水样时采用TC/EA-IRMS法更适合。TC/EA-IRMS法的主要原理是利用H2O和C在高温条件下发生裂解反应产生H2和CO;通过测定H2的δ2H值,从而得到H2O中H的δ2H值[21]。但是,当分析复杂水体时,特别是水中含有水溶性有机物时,由于有机物同样在该条件下可以产生H2,并与H2O反应产生的H2混合,使最终测定的δ2H值为H2O与有机物的总δ2H值。研究者们虽然证实了TC/EA-IRMS法适合测定含有有机物的复杂水体,但并没有探究水体中有机物含量对H2O的δ2H值的影响情况以及修正δ2H值的方法。
本文主要内容是利用TC/EA-IRMS法研究复杂水体中有机物的含量与其对测定δ2H值的影响。研究过程以乙醇为例,通过测定不同乙醇含量水样的δ2H值,建立水体中有机物含量与δ2H值之间的关系,探究δ2H值的修正方法,并将理论结果应用于有机物溯源。
1 实验部分
1.1 仪器和装置
有机元素分析仪(EA):型号Flash 2000,美国ThermoFisher公司产品。参数要求:陶瓷反应管温度设置为1380℃,色谱柱温度85℃,载气He气流速100mL/min,参考气流速10mL/min,稳定24h以上。
气体稳定同位素比质谱仪(IRMS):型号MAT253,美国ThermoFisher公司产品。参数要求:参考气δ2H值精度小于0.5‰。
ConfloⅣ接口,美国ThermoFisher公司产品。
1.2 材料和主要试剂
氢氧同位素国家一级标准物质:GBW04458、GBW04459、GBW04460,由中国地质科学院水文地质环境地质研究所研制。
水样品:采自石家庄地下水。
无水乙醇:分析纯(纯度大于99.7%),由天津市光复科技发展有限公司生产。
1.3 样品制备
实验所用国家一级标准物质成分主要是:青藏高原贡嘎雪山雪水(GBW04460,δ2H=-144.0‰)、河北正定地下水(GBW04459,δ2H=-63.4‰)、南海海水(GBW04458,δ2H=-1.7‰)。由此三种标准物质建立的校正曲线可以确定δ2H值在-1.7‰到-144‰范围之间的水样。
待测水样的配制:主要是由乙醇与经0.22μm滤膜过滤的石家庄自来水配制而成。待测水样标记为S1、S2、S3、S4、S5、S6、S7,其中乙醇的体积比值(r)和具体配制方法见表1。其中,S1(r=0)为过滤后的石家庄自来水,该水源主要是石家庄地区地下水,其δ2H值为-50.9‰;S7(r=1)为无水乙醇,本项目组采用TC/EA-IRMS法测得其δ2H值为-223.5‰;两者δ2H值相差较大,混合后对δ2H值影响明显,有利于结果的讨论和研究。
表1不同乙醇体积比水样的配制
Table 1 Detailed information of samples with different concentrations of ethanol
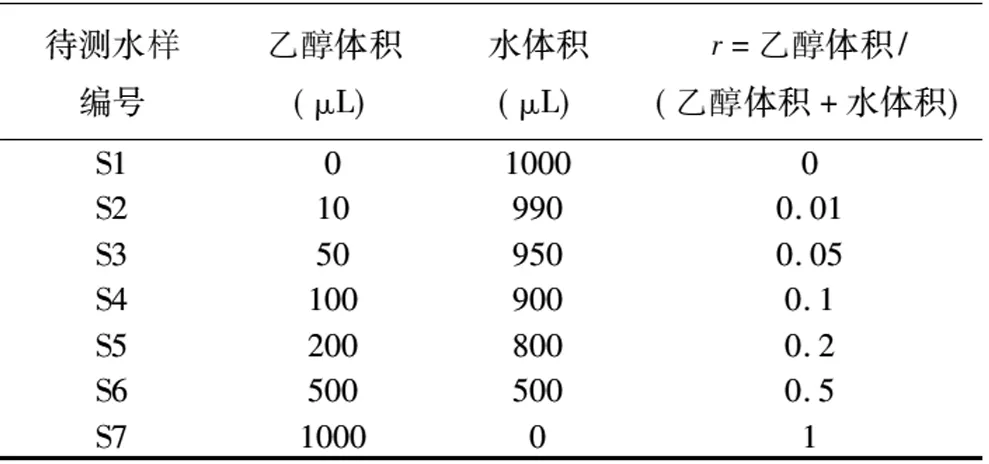
待测水样编号乙醇体积(μL)水体积(μL)r=乙醇体积/(乙醇体积+水体积)S1010000S2109900.01S3509500.05S41009000.1S52008000.2S65005000.5S7100001
1.4 实验方法
本实验方法在文献[12]的基础上进行改进,进样量为0.1μL;反应管温度由1350℃变为1380℃;色谱柱温度由90℃变为85℃。待测水样加入进样瓶内,随自动进样器取样并进入元素分析仪裂解管中,与碳粒发生裂解反应,产生H2和CO气体;经过干燥井除水、色谱柱分离,H2和CO气体依次进入气体稳定同位素比质谱仪进行检测。
1.5 数据处理
同位素的绝对比值(R),通常表示为重同位素(mX)与轻同位素(nX)摩尔数含量之比。
R=mX/nX(m>n)
在实际应用中,由于R值计算繁琐,数值也很低,因此多采用同位素相对比值δ值来表示样品的同位素组成。同位素的相对比值(δ,‰)是指实际样品的R值(Rsmpl)相对于标准样品的R值(Rst)的偏差,采用以下关系式:
TC/EA-IRMS测试分析结果均以δ2H表示,但是质谱仪直接测定的是反应产生的H2同位素比值,水样D/H比值需要通过标准物质校正求得[22]。将氢氧同位素标准物质GBW04458(δ2Hst=-1.7‰)、GBW04459(δ2Hst=-63.4‰)、GBW04460(δ2Hst=-144.0‰)与待测样品同时进行分析检测。通过三点标准曲线校正法求得水样的氢氧同位素比值。
2 结果与讨论
2.1 标准曲线的绘制
水中的氢稳定同位素比值变化范围较大,分析测试中一般要求待测样品的结果不能与标准物质的真值相差太大,否则会引起测试系统误差,因此本实验选取涵盖大部分自然水的氢稳定同位素比值的三个标准物质GBW04458、GBW04459、GBW04460进行分析,依据分析结果建立实验室校正方程[22]。利用TC/EA-IRMS法分别对三个标准物质平行测定5次并求平均值,所得数据列于表2。表中数据显示δ2H测定值的STDEV均小于1‰,说明所得测定结果精密度好、重现性好[19]。将测试结果的平均值δ2Hst-s(x)与水标准物质H的标准值δ2Hst(y)建立线性关系,获得线性方程为:y=0.8415x-230.71,R2=0.9998。说明通过TC/EA-IRMS法测得水样的δ2H测定值与δ2H真值之间存在良好的线性关系;通过该线性关系可求得待测水样δ2H真值。
表2标准水样δ2H的测试结果
Table 2 Measruedδ2H values of standard samples
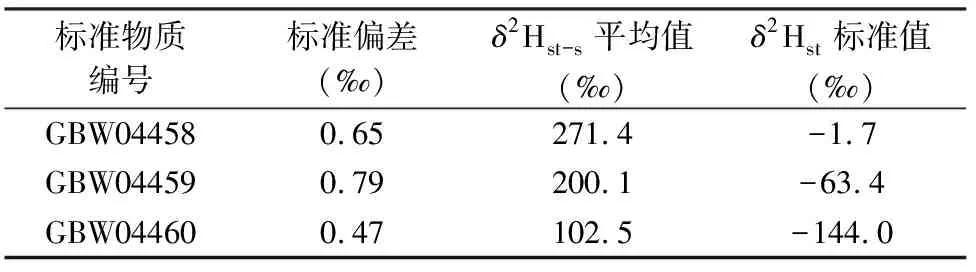
标准物质编号标准偏差(‰)δ2Hst-s平均值(‰)δ2Hst标准值(‰)GBW044580.65271.4-1.7GBW044590.79200.1-63.4GBW044600.47102.5-144.0
注:标准偏差和δ2Hst-s是由5次平行测定结果求得。
2.2 水样中乙醇含量与δ2H值的关系
根据TC/EA-IRMS测定氢稳定同位素的原理[18,21]可知,当水样中含有有机物时,经过与碳粒的高温裂解反应生成的H2混合在一起,最终质谱检测结果是混合H2的δ2H值。水中有机物占比越大,混合H2气中来自有机物的H2含量就越大,对最终δ2H值的影响也越大。为了研究水中有机物含量与水样通过TC/EA-IRMS方法测得δ2H值的关系,本实验以乙醇为例,配制不同体积比的乙醇溶液,通过测定其δ2H值,讨论r与δ2H值之间的关系。
配制的乙醇溶液(S1~S7),通过TC/EA-IRMS方法得到的测定结果列于表3。从表3的数据可以看出样品测试结果的精密度较好,标准偏差均小于1‰。根据绘制的标准曲线方程,计算求得不同乙醇含量水样的δ2H计算真值(δ2Hsam)。样品S1(r=0)为原水样(过滤后的石家庄自来水),其δ2Hsam=-50.9‰;S7(r=1)为无水乙醇,其δ2Hsam=-223.5‰。从S1~S7测试结果可以看出,随着乙醇含量的增加,δ2Hsam值逐渐减小。
表3不同乙醇体积比(r)水样δ2H的测试结果
Table 3 Measruedδ2H values of water samples with different ethanol volumetric ratios (rvalue)
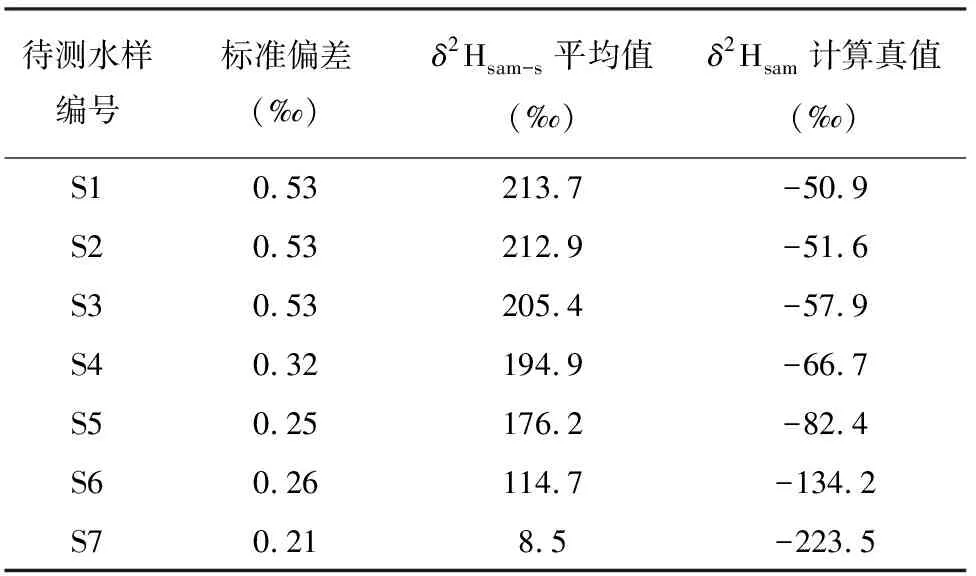
待测水样编号标准偏差(‰)δ2Hsam-s平均值(‰)δ2Hsam计算真值(‰)S10.53213.7-50.9S20.53212.9-51.6S30.53205.4-57.9S40.32194.9-66.7S50.25176.2-82.4S60.26114.7-134.2S70.218.5-223.5
注:标准偏差和δ2Hsam-s是由3次平行测定结果求得。
将水样中乙醇的体积比r与δ2Hsam建立曲线关系,绘制曲线如图1所示。从图1中可以看出r(x)与δ2Hsam(y)值之间存在良好的线性关系,线性方程y=-173.03x-49.336,R2=0.9996。当乙醇含量较低时(r=0.01)其δ2Hsam与原水样的δ2Hsam的STDEV值小于1‰,说明该乙醇添加量下,对水样的δ2Hsam值影响不大,可以忽略;当r>0.05时,其δ2Hsam值减幅明显。由此可以说明,水样中有机物的含量与TC/EA-IRMS法最终测得δ2H值存在线性关系,随着有机物含量的增加,测得δ2H值逐渐向有机物δ2H值方向偏移。但在水样中存在微量有机物时,这种偏移并不明显。

图1 乙醇体积比(r)与待测水样氢稳定同位素比值δ2Hsam的线性关系Fig.1 Linear relationship of ethanol volumetric ratio (r) and δ2Hsam of water samples
2.3 水样中有机物含量与δ2H值线性关系的应用
基于上述讨论结果可知,复杂水体中有机物含量与水样利用TC/EA-IRMS法测定的δ2H值存在线性关系。利用该线性关系既可对水源δ2H真值进行修正,也可对复杂水体中有机物进行溯源。
自然界的水在蒸发、凝结、运移过程中易造成氢稳定同位素分馏[23-25],基于氢稳定同位素的分馏现象和原理,其广泛应用于水文地质和环境地质领域的研究[26-27]。在研究过程中,水中氢稳定同位素比值测试结果直接影响研究结果。在利用TC/EA-IRMS法测定水体δ2H值时,水中含有有机物势必会影响其准确度。在已知有机物δ2H值及其含量(例如体积比r)时,利用有机物含量与水样δ2H值之间线性关系可以推算出水体中H2O的δ2H真值。以上述乙醇实验为例,当r=1时,即无水乙醇的δ2H为-223.5‰,水样中r=0.05,测得δ2H值为-57.9‰,可以计算出该水样中H2O的δ2H=-49.2‰,与其真值-50.9‰的相对误差仅有1.7%。修正后的数据可以真实地表现水样中氢稳定同位素含量的变化规律,为研究者们在水文环境地质、水循环等方面的研究提供可靠的数据支持。
除此之外,利用水样中有机物含量与δ2H值线性关系也可以对水样中的有机物进行溯源。随着时代的发展和科技的进步,与之而来的环境污染问题凸显。水资源污染问题尤为严重,其中有机污染物是水资源污染的主要来源之一[28]。而解决水污染的根本方法之一是对其溯源,从根本上断绝污染来源。目前,最高效的方法就是利用同位素比值的检测对污染物进行溯源[29-30]。传统方法中,主要通过测定碳、氮同位素对污染物进行溯源[31]。本文的研究结果表明对于水样中的多氢的有机物也可以利用氢稳定同位素进行溯源。当利用TC/EA-IRMS法对某水域δ2H值监测时,其值出现逐渐递增或递减的情况,说明水体中可能出现了有机污染物。通过检测污染物的含量和水样的δ2H值,建立两者的线性关系可以对该污染物进行溯源。同样,以上述乙醇实验为例,当已知乙醇体积比r分别为0.05和0.1时测定的δ2H值为-57.9‰和-66.7‰,通过建立线性方程可以计算出乙醇的δ2H=-225.1‰,与其真值-223.5‰的相对误差仅为0.4%。因此,当利用碳氮同位素无法准确溯源有机物时,监测氢稳定同位素变化可以作为溯源的一种新方法。
3 结论
本文主要采用热转换元素分析同位素比质谱法测定水样,分析在该法下测得复杂水样的氢稳定同位素比值与有机物含量的关系。通过对不同体积比的乙醇-水溶液δ2H值的检测,建立了乙醇体积比与水样δ2H值之间的曲线关系,确定了水体中有机物含量与δ2H的线性关系。利用该线性关系,可以准确修正含有机物水样的δ2H值,同时在有机物溯源方面也具有较好的应用潜力。在以乙醇为例的实验中,水样中δ2H值的修正结果与真值相对误差仅有1.7%;在对水中有机物溯源方面,得到的有机物的δ2H计算结果与真值相对误差仅为0.4%。
探究影响氢元素溯源水体有机物的主要因素将是一个值得深入研究的课题。在污染物的溯源方面,本文研究表明了氢稳定同位素体现出较好的单一污染物溯源应用结果,但并不适于作为主流的溯源方法,可以辅助其他元素同位素(如碳同位素)对多源有机物进行溯源。
