加速器质谱14C分析石墨制备技术研究进展
2019-11-05刘圣华史慧霞蒋雅欣徐胜刘冰冰
刘圣华, 史慧霞, 蒋雅欣, 徐胜, 刘冰冰*
(1.中国地质大学(北京)地球科学与资源学院, 北京 100083; 2.中国地质科学院水文地质环境地质研究所, 河北 石家庄 050061; 3.天津大学表层地球系统科学研究院, 天津 300072)
自1946年Libby等[1]提出并建立14C测年方法以来,经过近70年的发展,该测年方法取得长足的进展,被认为是理论最清楚、技术最成熟、精度最高的测年方法,被广泛应用于地质、海洋、气候、环境、地下水以及考古等研究领域[2-4]。它不仅在建立高精度地质年代学标尺方面发挥了关键作用,而且在重建地质历史时期大气CO2浓度、碳的生物地球化学循环、大气污染物“指纹”、生命科学和医学诊断等同位素示踪研究中也起到了至关重要的作用。特别是在20世纪80年代,随着加速器质谱(AMS)的逐步完善极大地拓展了14C的应用范围。但高精度、低本底的AMS-14C测量严重依赖于石墨样品靶的性能,而后者主要取决于石墨制备方法和真空系统的可靠性。因此探讨如何搭建性能优良的样品制备真空系统和建立可靠的样品制备方法是加速器质谱技术应用的基础研究课题之一。
国际上广泛利用石墨作为AMS-14C分析的常规靶材,其制备方法主要为催化还原法,包括H2/Fe法[5]、Zn/Fe法[6-7]和Zn-TiH2/Fe法[8]。在催化还原法中,石墨性能(束流性能、石墨产率、同位素分馏以及化学流程本底)主要受到还原剂用量、催化剂性质及其用量、反应温度以及采用的碳污染控制技术等众多因素的影响。当前催化还原法制备石墨样品靶的研究工作也主要围绕以下几个方面开展:①提高石墨产率,降低同位素分馏效应。对于微量或超微量样品,石墨产率低是主要问题,而对于采用离线δ13C校正在线14C/13C同位素分馏的实验室,如果石墨制备实验过程中出现明显同位素分馏时,将导致测试精密度极其恶化。②探索有效的碳污染控制技术,不断改善本底,提高测年上限。③探讨微量样品中石墨性能严重依赖于样品量的现象,探索微量样品石墨制备技术。④积极发展石墨制样自动化和联用技术。上述研究工作主要聚焦在如何合理优化影响石墨性能的控制因素,以达到满足Polach[9]提出的石墨靶性能。虽然国内外在这方面都进行了有益探索,也取得了长足进展,建立了特点各异的样品制备真空系统和制备方法技术,但关于加速器质谱14C分析石墨制备技术的系统性总结分析工作的报道较少。
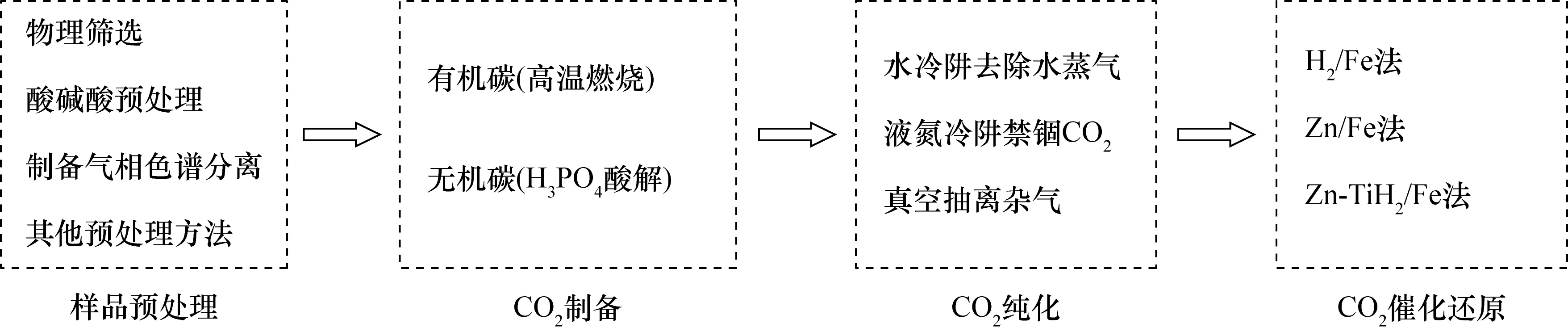
图1 催化还原法石墨靶制备方法原理图Fig.1 Schematic diagram of graphite target preparation by catalytic reduction method
本文在阐述AMS-14C石墨制备技术发展现状的基础上,着重探讨了还原剂、催化剂、温度等石墨制备实验条件对石墨性能的影响,阐述它们与石墨产率、同位素分馏、束流性能之间的内在联系,探索碳污染来源及合适的实验处理技术和数学校正技术以降低制样过程中引入的碳污染,试图分析和回答优化选择影响石墨性能控制因素的问题。同时还重点阐述了微量样品制备技术的发展现状及存在的问题,展望了制样真空设备的自动化以及AMS联用技术的发展趋势。旨在为国内外同行搭建石墨制备真空装置和建立样品制备技术提供基础参考资料,为进一步拓宽14C年代学和同位素示踪的应用范畴提供思路。
1 石墨制备技术发展过程
在AMS-14C分析中,要求将样品制备成离子源中的靶样品,然后使用铯离子轰击靶样品表面将碳转化成C-离子和分子离子。因此,多种含碳物质被作为靶物质,包括含碳气体(CO2、CO等),含碳固体物质(碳酸盐、碳化物或碳化物与金属粉末的混合物、类脂化合物)以及元素碳(无定形碳或无定形碳与金属粉末的混合物、石墨)[9]。依据Polach[9]提出的合格靶物质的性质,判定石墨是最佳的靶物质;而其他的碳化物或碳化物与金属粉末的混合物、无定形碳或无定形碳与金属粉末的混合物或熔融物等,不仅制备过程复杂,而且靶物质的导热性差,离子转换率低,不能提供稳定的离子束流,均被认为不适于作为AMS-14C分析的常规靶物质[9-10]。石墨作为现阶段AMS-14C分析的常规靶材,其制备方法很多,如高温高压法、高压法、高温法、裂解法和催化还原法[9],但是由于设备复杂、昂贵且效率低下,多数方法被弃用,而催化还原法相比于其他方法具有较多优势,被认为是较为理想的石墨靶制备方法。
Vogel等[5]首先使用铁粉作为催化剂,H2作还原剂将CO2还原成石墨的研究方法应用于石墨制备。其后各实验室研制并建立了独具特色的石墨制备装置和方法。总的来说,Fe催化还原法石墨靶制备方法原理如图1所示,包括CO2制备、CO2纯化以及CO2催化还原三个基本步骤。但各方法采取的实验方案不尽相同,研究的热点也主要聚焦在CO2还原成石墨的实验过程上。目前常用的CO2催化还原方法可以归纳为H2/Fe法和Zn/Fe法。在H2/Fe法中,使用H2作为还原剂,铁粉作为催化剂,将纯化后的CO2用冷阱转移到石墨化单元中,按照一定比例混入H2。加热到550~650℃时开始发生反应(表1),首先CO2被H2还原成CO,后者再经催化剂作用还原成石墨,生成的石墨附着在铁粉表面。因为反应过程中有水蒸汽产生,大部分研究者用冷阱或MgClO4使水蒸汽脱离反应体系。其基本化学反应式为表2中的(1)和(3)[5],该方法的石墨化单元基本装置如图2b所示。Zn/Fe法与H2/Fe法基本相同,不同的是使用了安全性更高的锌粉替代了H2作为还原剂,有效避免了反应体系中水蒸汽的生成,其基本化学反应为表2中的(2)和(3)[6-7],反应过程中分别在锌粉和铁粉部位采用不同温度加热(表1),促使化学反应(2)和(3)循环进行,最终所有的CO2被还原成石墨并沉积在铁粉表面,该方法的石墨化单元基本装置如图2c所示。
表1石墨化条件及流程本底
Table 1 Summary of different graphitization conditions applied in prior studies and their corresponding procedure background
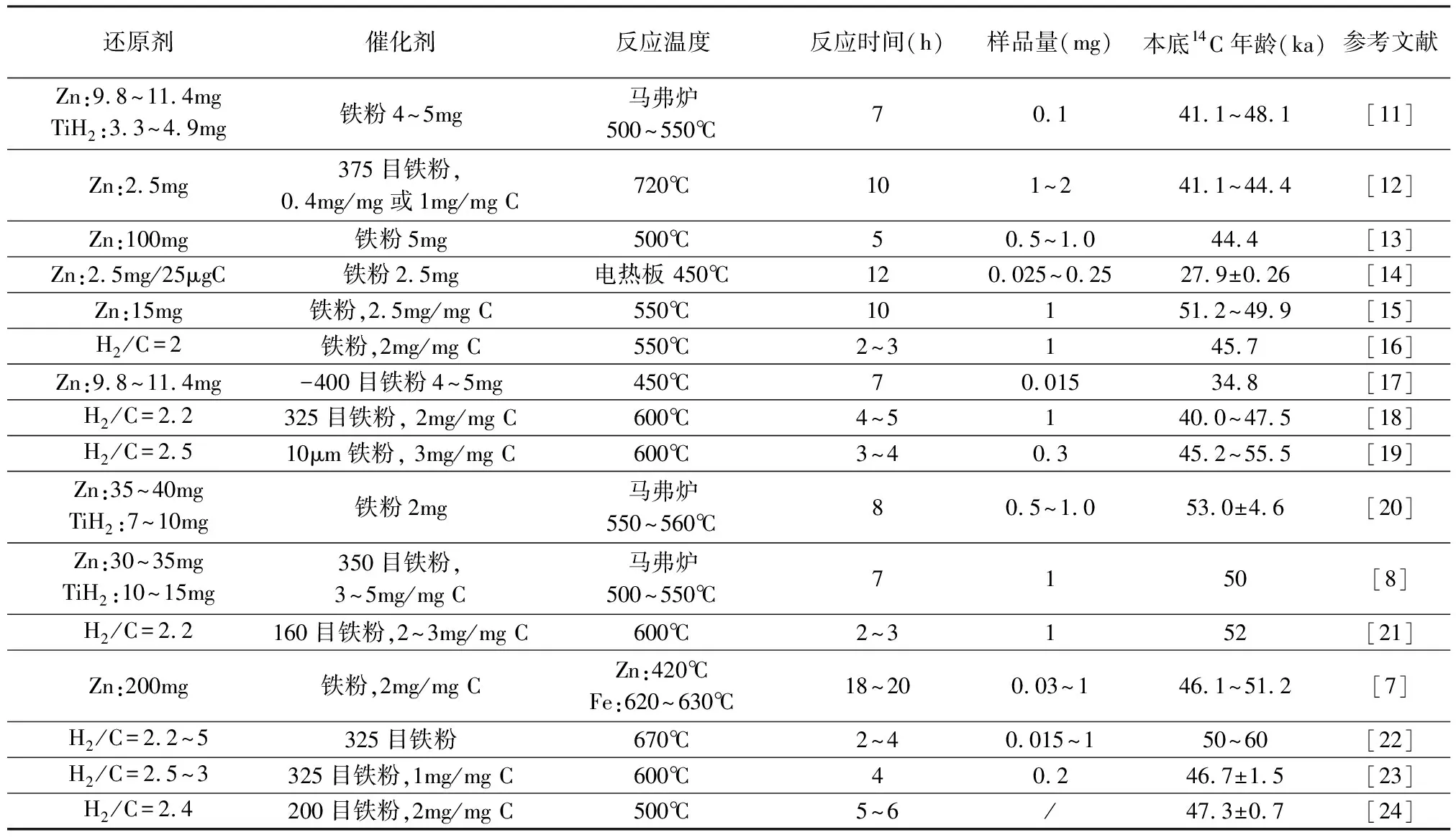
还原剂催化剂反应温度反应时间(h)样品量(mg)本底14C年龄(ka)参考文献Zn:9.8~11.4mgTiH2:3.3~4.9mg铁粉4~5mg马弗炉500~550℃70.141.1~48.1[11] Zn:2.5mg375目铁粉,0.4mg/mg或1mg/mg C720℃101~241.1~44.4[12] Zn:100mg铁粉5mg500℃50.5~1.044.4[13] Zn:2.5mg/25μgC铁粉2.5mg电热板 450℃120.025~0.2527.9±0.26[14] Zn:15mg铁粉,2.5mg/mg C550℃10151.2~49.9[15] H2/C=2铁粉,2mg/mg C550℃2~3145.7[16] Zn:9.8~11.4mg-400目铁粉4~5mg450℃70.01534.8[17] H2/C=2.2325目铁粉, 2mg/mg C600℃4~5140.0~47.5[18] H2/C=2.510μm铁粉, 3mg/mg C600℃3~40.345.2~55.5[19] Zn:35~40mgTiH2:7~10mg铁粉2mg马弗炉550~560℃80.5~1.053.0±4.6[20] Zn:30~35mgTiH2:10~15mg350目铁粉,3~5mg/mg C马弗炉500~550℃7150[8] H2/C=2.2160目铁粉,2~3mg/mg C600℃2~3152[21] Zn:200mg铁粉,2mg/mg CZn:420℃ Fe:620~630℃18~200.03~146.1~51.2[7] H2/C=2.2~5325目铁粉670℃2~40.015~150~60[22] H2/C=2.5~3325目铁粉,1mg/mg C600℃40.246.7±1.5[23]H2/C=2.4200目铁粉,2mg/mg C500℃5~6/47.3±0.7[24]
注:部分文献中并没有直接给出14C年龄,而是给出了现代碳污染量和死碳污染量的数据。为了统一和便于读者比较,此表中的部分14C年龄是经过文献中的公式进行换算而来的。14C年龄=-8033ln(Fm),Fm=Mdc/(Ms+Mmc+Mdc)Rmc,Ms代表典型样品量,Mmc代表现代碳污染量,Mdc代表死碳污染量,Rmc代表现代碳14C浓度。
虽然上述两种方法都能获得性能良好的石墨靶,但是或多或少都会受到其方法固有技术本身的限制。例如,①水蒸汽和CH4问题:H2/Fe法制备真空系统设备昂贵,且体系中存在水蒸汽的问题[8],而水蒸汽需要采用冷凝或化学吸附的方式使其脱离反应体系。如H2和C的比例控制不当则易生成CH4,造成石墨产率的降低和同位素分馏加剧。但Zn/Fe法中不存在此类问题;②反应速率:Zn/Fe法反应时间约为8~12h,甚至有的报道中反应时间长达24h,很明显Zn/Fe法化学反应缓慢;③同位素分馏:研究发现H2/Fe法的同位素分馏系数仅为0.995[8,25],而Zn-TiH2/Fe法的同位素分馏系数为0.9868[8],Zn-Mn/Fe法的同位素分馏系数甚至达到了0.972[26],证实H2/Fe法的同位素分馏小,Zn/Fe法的同位素分馏较大;④石墨靶束流性能:Zn/Fe法中石墨靶达到稳定束流所需的时间要长于H2/Fe法[8],而束流强度只有H2/Fe法的50%~90%[27]。
为了克服上述方法的技术限制,提出了Zn-TiH2/Fe法[8]。其石墨化单元装置包括如图2d所示的火焰封管法以及图2e所示的隔膜封管法,前者为常用装置,而后者用于处理生物医学样品。基本化学反应方程式为表2中的(1)、(3)和(10)。该方法的基本观点认为体系中存在两种还原剂(H2和锌粉),类似H2/Fe法和Zn/Fe法的组合,能够克服彼此缺点和发挥各自优势,并且上述反应循环加快了化学反应速率。但是该方法还存在如下三方面问题:①体系中TiH2或H2比例不好控制,大大增加了生成CH4的可能性,可能造成石墨产率降低且不稳定,对于微量样品其影响会更加明显;②体系中Zn与H2O循环反应生成H2的过程不可控[15];③在Zn-TiH2/Fe法中,由于TiH2的热分解特性,试剂无法进行高温去除碳污染(如金属碳化物)处理,故其本底通常要高于Zn/Fe法和H2/Fe法。上述问题将会导致样品与样品之间、样品与标样之间的同位素分馏效应不一致,从而降低了测试精度。
表2不同石墨合成方法中可能发生的化学反应
Table 2 Potential chemical reactions during the graphitization process by H2/Fe and Zn/Fe or Zn-TiH2/Fe method
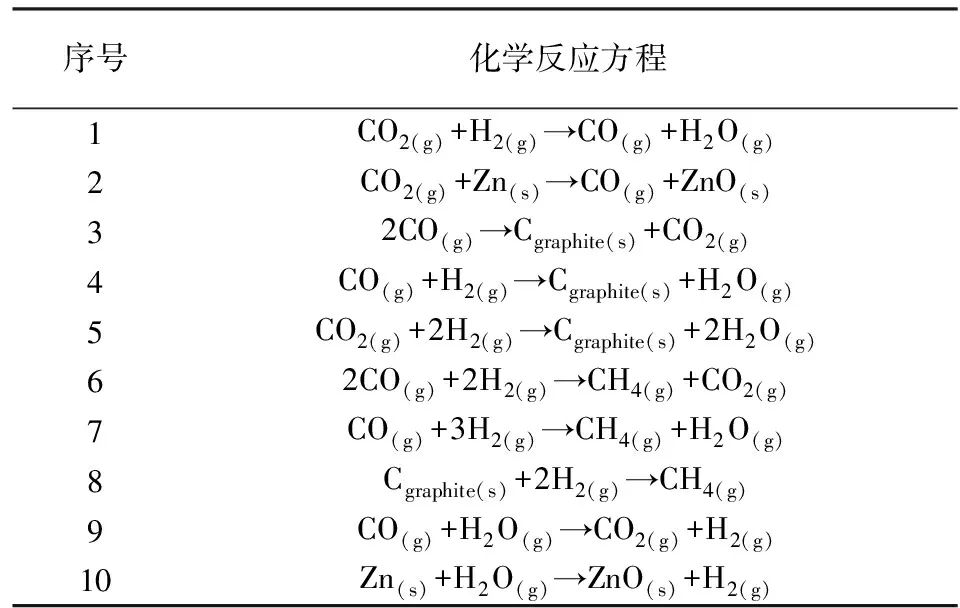
序号化学反应方程1CO2(g)+H2(g)→CO(g)+H2O(g)2CO2(g)+Zn(s)→CO(g)+ZnO(s)32CO(g)→Cgraphite(s)+CO2(g)4CO(g)+H2(g)→Cgraphite(s)+H2O(g)5CO2(g)+2H2(g)→Cgraphite(s)+2H2O(g)62CO(g)+2H2(g)→CH4(g)+CO2(g)7CO(g)+3H2(g)→CH4(g)+H2O(g)8Cgraphite(s)+2H2(g)→CH4(g)9CO(g)+H2O(g)→CO2(g)+H2(g)10Zn(s)+H2O(g)→ZnO(s)+H2(g)
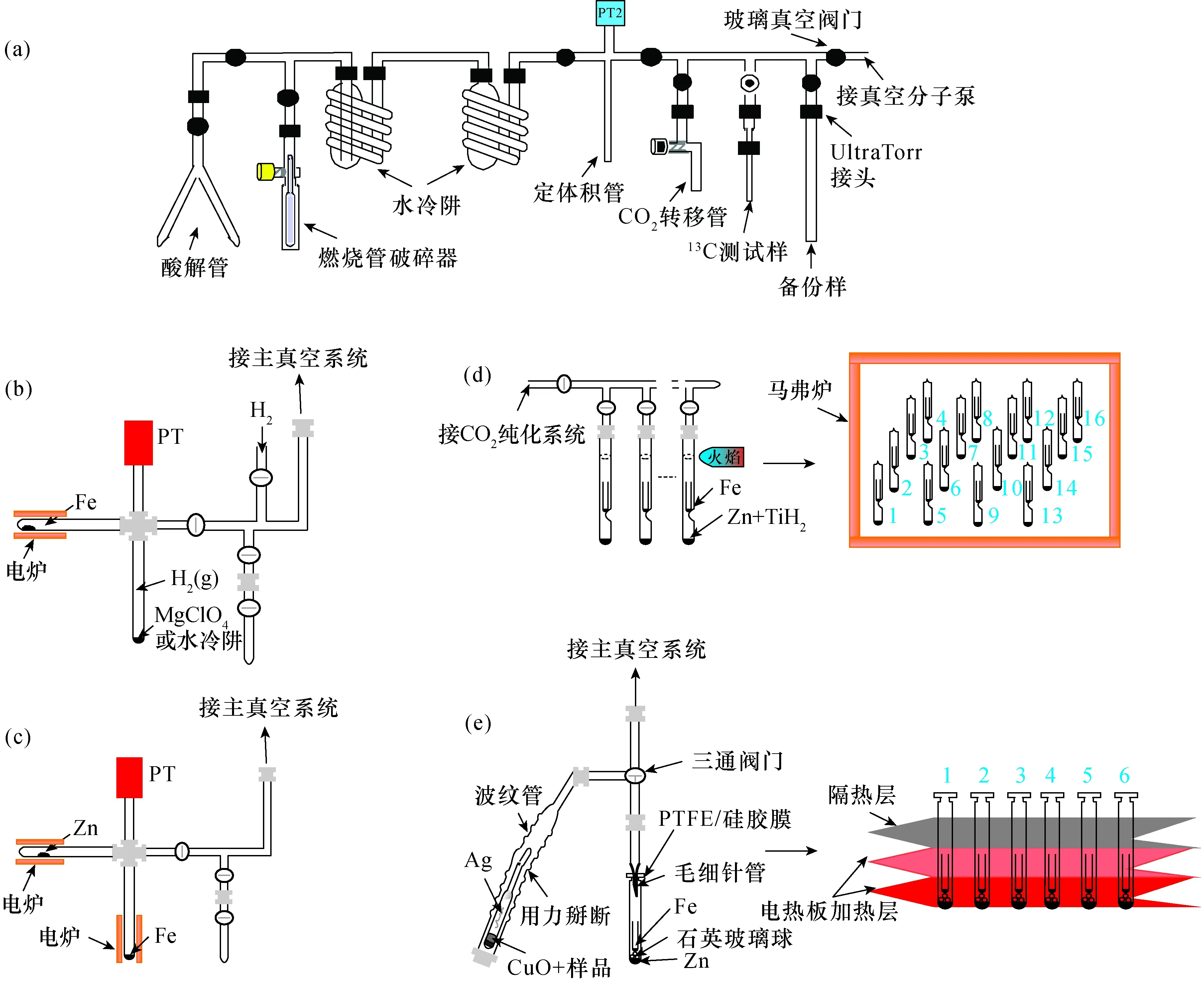
(a)14C石墨制靶CO2纯化真空系统;(b)H2/Fe法石墨化单元;(c)在线Zn/Fe法石墨化单元;(d)Zn+TiH2/Fe或Zn/Fe火焰封管法石墨化单元;(e)Zn/Fe隔膜封管法石墨化单元。PT为压力传感器。图2 各制样方法真空系统图Fig.2 Schematic diagrams of vacuum line for different graphite preparation methods: (a) The CO2 purification vacuum system; (b) Graphitization unit by H2/Fe method; (c) Graphitization unit by online Zn/Fe method; (d) Graphitization unit by Zn+TiH2/Fe or Zn/Fe flame-sealed method; (e) Graphitization unit by Zn/Fe septa-sealed method. PT denotes pressure transducer
为了降低Zn-TiH2/Fe法中的CH4产率和改善本底,又提出了弃用TiH2改为仅用锌粉作还原剂的火焰封管法和隔膜封管法,采用管式炉或电热板梯度加热进行反应合成石墨[13-15,28-29]。事实上,Zn/Fe火焰封管法或隔膜封管法本质上仍为Zn/Fe法,但由于采用的是密封后离线反应的方式,因此不受反应速率限制(即日样品处理量不受反应时间长的限制),同位素分馏也可以通过同位素分馏校正得到改善,还可通过高温加热的方式去除碳污染以达到降低本底的目的,同时又避免了形成CH4的风险以增加石墨产率。需要注意的是,石墨靶质地较硬,其束流性能不如H2/Fe法。
依据还原剂的种类,可将上述石墨合成方法归纳为H2/Fe法、Zn/Fe法以及Zn-TiH2/Fe法。在还原剂中存在H2的情况下,还原体系中就可能存在H2比例控制不当生成CH4的风险,同时存在使用易燃易爆品H2的危险,但Zn/Fe法中不存在这些问题。在Zn-TiH2/Fe法中,反应试剂因TiH2的热分解特性而无法高温去除碳污染,其本底水平难以控制。依据石墨化单元装置结构,可将上述石墨合成方法归纳为在线法和火焰封管法。由于石墨合成反应时间长,在线法中的石墨化真空单元均可能存在大气泄漏的风险,但火焰封管法反应体系始终处于真空密闭状态。受石墨化真空单元数量和反应时间长的限制,在线法的制样效率低,而火焰封管法不受上述因素制约,制样效率可大大提高。可以认为Zn/Fe火焰封管法的出现克服了上述H2/Fe法和在线石墨化真空装置的缺陷,但还需要更多研究工作来加强对其认识和改进。
2 实验条件优化选择
在众多石墨制备方法中,催化还原法是被广泛采用的石墨化方法。还原剂、催化剂、试剂配比以及反应温度等实验条件严重影响着石墨产率、束流强度、同位素分馏、碳污染量和最终的测试精度。在微量样品石墨制备时,这种影响表现得尤为突出。而这种影响可通过优化选择实验条件和实验操作步骤加以抑制和克服。
2.1 还原剂对实验结果的影响
催化还原体系中,还原剂的量对实验成功与否起到至关重要的作用。按照化学反应计量关系,在H2/Fe法中理论上应该提供2倍于CO2体积的H2就能保证反应完全进行。但在实际工作中,通常情况下H2/CO2略高于化学计量系数,为2~2.5(表1)。虽然过量H2(H2/CO2> 3)能增加反应体系中反应物H2的分压,促进反应向正方向进行而有利于提高反应速率,缩短反应时间[30],但是实验发现过量H2会促使CO2向CH4转化(因为实验发现石墨的质量产率远小于压力产率,而CH4的生成能降低压力而不增加石墨质量)[31],且CH4产率为无H2体系的4~5倍[26],这将导致相应的石墨产率明显偏低,同位素分馏现象明显[26-27,32]。因此,提供合适比例的H2(体积比H2/CO2=2~2.5),既可以保障反应完全,也有利于提高石墨产率和降低同位素分馏。
在Zn/Fe法中,锌作为还原剂,其量的大小将直接影响石墨产率、同位素分馏情况以及本底值和束流强度。按照化学反应计量关系,10.88mg锌恰好能将1mg碳样品完全还原成石墨。在反应体系中,若锌量不足以将CO2完全还原成CO,则将导致反应不完全,石墨产率降低,同时碳同位素在残留气相和固相中产生严重的分馏行为。实验表明,随着Zn/C质量比值的增加,石墨产率增加,束流强度快速上升,同位素分馏逐渐减小,但Macario等[33-34]认为少量锌粉(Zn/C=20)有利于减小δ13C的离散程度;当达到最佳比值(Zn/C值约50)时,石墨产率最高,相应的束流强度最大;但过量的锌粉(Zn/C>50)不仅带来本底值和同位素分馏效应升高的风险,还将使束流强度逐步下降[8,15,28,35-36]。
2.2 催化剂对实验结果的影响
催化剂不仅加快了化学反应速率,还为石墨生长提供了场地,同时也是石墨靶的导电导热剂和粘连剂。因此,催化剂的性质(种类、粒径、含量等)对石墨样品的影响备受关注。Wild等[37]、McNichol等[30]深入比较了钴粉和铁粉对反应速率的影响,实验结果表明以钴粉作催化剂,反应完全的平均时间为6~7h,而以铁粉作催化剂,反应完全则只需3~4h,且铁粉催化形成的石墨较蓬松,更容易压入靶锥[8],由此认为铁粉比钴粉更适合作为石墨化过程中的催化剂。但Vogel等[38]曾用钴粉或镍粉替换铁粉作为催化剂,发现铁粉中的羰基碳和吸附态碳含量要明显高于钴粉和镍粉,导致钴粉催化生成的石墨能给出比铁粉更低的本底值。除此之外,两者催化得到的石墨靶束流性能并没有明显差异[8,37]。上述差异的出现不仅与金属种类有关,更与催化剂的颗粒大小有关[30,38]。催化剂的粒径过细(1~5μm),在高温反应时容易出现熔融烧结现象,反而导致反应接触面剧减,反应缓慢;并且由于细粒颗粒物(如纳米铁粉)具有较强的表面吸附能力,易吸附较多的碳质化合物,造成实验本底不易控制,同位素分馏明显。但粒径过大时,其比表面积较小,也会导致反应速率明显降低[38]。故在催化剂选择上,大多数实验室均选择-325目球粒、源自氢还原单质铁粉作为催化剂使用。
铁粉作为石墨靶样品中的粘连剂和导热剂,其量的大小将会明显影响石墨靶的导电导热性和石墨的相对含量。纯石墨或金属含量少的石墨由于导热性差,导致Cs离子轰击时样品表面温度不均,易引起同位素热分馏效应增大,同时束流强度过高且束流不能持续稳定,从而不利于获得高精度的测试结果,因此不适于直接作为AMS测试的样品靶。但当催化剂金属粉末过量时,在高温催化还原反应过程中易形成金属碳化物,降低了石墨靶中石墨的相对含量,导致束流强度低和同位素分馏增大。另外,试剂量较大时,通常碳污染也较大。譬如每增加1mg 铁粉用量,样品碳污染增加0.35μg碳[39]。实验发现束流强度与Fe/C质量比值(Fe/C=0~1)呈显著负相关,当Fe/C从4~5降至2时,束流强度至少增加15%,但当Fe/C比值从1上升到20,束流强度降低了6倍(这是因为过量铁粉混入降低了靶样品中石墨的相对含量)。当Fe/C值为 2.5~3时,束流强度高且持续稳定,同位素比值稳定[15,19,25,28,38]。从石墨生长形态来看,随着Fe/C值从1~5升高到10~15,石墨形态从GCIP(graphite coated iron powder)变为GCI(graphite coated iron),而前者较后者更松散均一,且石墨产率较高[28,40-41]。因此,需要综合考虑各因素(反应速率、同位素分馏、本底以及AMS测试对束流的要求)以寻求合适的Fe/C比例,一般为每毫克碳添加2~5mg铁粉较为合适(表1)。
2.3 温度对实验结果的影响
反应温度不仅控制着反应速率,而且直接决定反应方向,影响石墨产率和同位素分馏情况,因此选择合适的反应温度至关重要。从化学反应的吉布斯自由能随温度的变化来看,除表2中的反应(1)外,几乎所有的反应吉布斯自由能均随温度的升高而升高,即高温有利于CO2和H2反应转化成CO,而低温则有利于CO2和Zn反应转化成CO,同时也有利于CO向石墨和CH4转化[28]。在H2/Fe法中,当反应温度<530℃时,CH4产率最高且在反应的早期阶段就达到浓度的最大值,证实了低温更有利于CH4的形成[30]。当反应温度为250℃时,反应缓慢且不完全,随着反应温度上升石墨产率逐渐增大,当温度升高到450℃后反应速率明显加快,在500~580℃之间反应速率最快,石墨产率也最大,但高温650℃反应速率要慢于500℃[24,31]。这是因为温度升高加快了反应体系中的分子运动速率,增加了分子发生碰撞反应的概率,加快了CO2转化成CO的反应速率,但高温又不利于CO吸附在催化剂表面,且催化剂易烧结而失去活性,导致反应速率减缓,甚至阻止反应发生[30,39]。
而在Zn-TiH2/Fe法中,Xu等[17]则认为在微量样品制备过程中,将还原温度550℃降低至450℃,有利于提高石墨产率(从约60%升高到90%~100%)[17,42]。其原因可归结于低温450℃有利于CO2与Zn反应转化成CO和石墨合成反应,此时CH4产率也较低,但当温度低于400℃时,X射线衍射分析显示无石墨产生[41]。由于温度影响化学反应进程以及石墨的产率,因此将在不同程度上影响到石墨合成过程中的同位素分馏情况。事实上,Macario等[34]发现在低温460℃时石墨化过程中的同位素分馏不稳定,而在520~550℃时却能够产生-5‰的相对稳定的同位素分馏,可以准确校正。Marzaioli等[20]也得到了相似的实验结果,其研究显示将还原温度从530~550℃升高到550~560℃,虽然没有改变同位素分馏的趋势,但是明显提高了同位素分馏的稳定性。
对于常规Zn/Fe法,由于锌粉和铁粉部位所进行的化学反应不同而需对其施加不同温度。锌粉部位主要进行的是反应(2),其所加温度(450℃)略高于其气化温度(419℃),而铁粉部位主要进行的是反应(3),其所加温度与H2/Fe法相似。但需要注意的是无论采用Zn/Fe火焰密封法还是Zn/Fe薄膜密封法,如果采用马弗炉加热,反应管始终处于一个温度,反应生成的ZnO将持续参与循环反应,氧始终未脱离反应体系,将导致反应缓慢进行,甚至石墨合成失败。据此,已有学者提出了采用管式炉或电热板加热的方法,他们认为管式炉或电热板温度分布呈一定梯度,反应生成的ZnO在反应外管的上部凝结而脱离石墨合成反应的最佳温度部位,将氧带离反应体系,促进CO向石墨方向转化[13-15,28]。需要指出的是,本文所讨论的温度条件为化学反应所需温度的最佳区间及变化趋势,而最佳反应温度会因各实验室所用加热炉的性能而异,在实际实验工作中需要各实验室在制靶设备上进行条件优化选择。
2.4 碳污染及其有效控制技术
碳污染包括现代碳(现代含碳物质)和死碳(14C完全衰变的含碳物质)污染,来源于样品物理化学预处理、高温燃烧或酸解、石墨化、石墨储存以及压靶等实验操作过程[43-46]。表3清晰地列出了碳污染来源及其污染量。Vogel等[43]认为在2.2±1.1μg总现代碳污染中,其中的0.7±0.3μg来源于样品准备阶段,1.5±1.0μg来源于样品高温燃烧阶段,0.36±0.19μg来源于石墨化阶段,少量来源于石墨储存阶段和压靶阶段(均<0.2μg)。Aerts-Bijma等[44]实验数据显示本底值从高到低依次为无烟煤、大理石>化石源CO2气体>石墨粉>石墨棒,表明在石墨压靶操作、石墨化过程、高温燃烧和酸解过程中都不同程度地引入了一定量的现代碳污染。实际上这些实验操作过程中引入的碳污染主要来自于玻璃等材料的吸附、化学试剂的吸附以及以化合物形式存在的死碳,和储存过程中石墨的吸附、压靶操作中引入的粉尘颗粒以及样品交叉污染。Verkouteren等[47]认为在2.2±0.5μg总现代碳污染中,由石英管引入的碳污染量为0.36±0.07μg,500mg CuO试剂引入的碳污染量为0.44±0.13μg。同样Ertunc等[7,48]均认为试剂(CuO、Fe以及Zn)和玻璃管路吸附是碳污染的主要来源。研究表明采用橡胶盖密封的玻璃管进行酸解制取CO2的过程中,由于磷酸和橡胶反应会引入死碳污染,导致年龄轻微偏老[49]。Paul等[50]比较了不同保存环境和时间对石墨靶的影响,其结果表明压靶后的石墨比未压靶的石墨更容易受到碳污染影响,碳污染的影响不仅存在于石墨靶表面,还能深入石墨靶内部。Steinhof等[46]认为随着保存时间的延长,现代碳污染以每月15~40ng的速度递增。通过质量守恒计算样品的Fm测试值(或pMC值)与1/m(m为样品质量)呈线性相关,也就是说对于已建立的特定石墨制靶真空系统和实验方法,其引入的系统碳污染是恒定的[19,22-23,42,51-53]。
基于以上碳污染源的分析,对进一步降低碳污染的方法归纳总结为以下两种。
(1)从碳污染源加以控制,降低碳污染的引入量。针对来源于玻璃管以及实验工具的碳污染,采用的主流方法为:900℃灼烧石英反应管,550℃灼烧耐热玻璃管以及所用的实验工具,加热带120℃加热真空管路放气,延长抽真空时间,采用无油真空泵组,缩小管路体积等[20,26,52,54-55]。针对来源于试剂的碳污染,采取的主流方法为:铁粉真空高温氧化还原活化,锌粉真空450℃灼烧,CuO、银丝等在空气氛围中高温灼烧等[23,47,54-55]。针对来源于石墨靶储存和压靶过程中的碳污染,采取诸如惰性气体氛围保存和真空封存、电子干燥箱(内放置1mol/L氢氧化钠溶液)保存、测试过程中预剥蚀(pre-sputtering)等方法[46,50]。
表3碳污染来源
Table 3 Sources of carbon contamination

碳污染来源污染量参考文献样品预处理阶段7.05±4.02μg现代碳[45]样品预处理阶段0.7±0.3μg现代碳[43]燃烧阶段3.01±2.0μg现代碳[45]燃烧阶段1.5±0.1μg现代碳[43]燃烧阶段0.36±0.07μg现代碳(玻璃管路吸附)[47]燃烧阶段每500mg CuO引入0.44±0.13μg现代碳[47]燃烧阶段每支玻璃管引入0.02~0.15μg现代碳[26]燃烧阶段每100mg CuO引入0.1±0.01μg现代碳[26]石墨化阶段0.36±0.19μg现代碳[43]石墨化阶段每10mg铁粉引入1.8±0.7μg现代碳[26]储存阶段<0.2μg现代碳[43]转移压靶阶段<0.1μg现代碳[43]仪器本底≤0.5μg现代碳[45]
(2)在上述控制碳污染来源的同时,对测试结果通过数学模型加以校正。
传统模型:基本原则是质量守恒原理[23,42,56],其重要假设为未知样品、本底样品以及标准样品中引入的碳污染量恒定不变,否则校正公式不成立。其校正公式:
(1)
式中:Fstd为标准物质(例如OXI)的推荐值,Fms、Fmb、FmOXI分别代表未知样品、本底样品和标准样品的测试值。
两组分混合模型:由Brown等[56]提出的基于质量守恒原理的校正方法,其重要假设为未知样品、本底样品以及标准样品中引入的碳污染量恒定不变,否则上述校正公式不成立。其核心思想认为样品的14C测试值是由样品真实14C信息和碳污染14C信息按照各自质量加权平均而得。其校正公式:
(2)
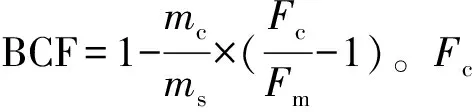
Donahue模型:由Donahue等[57]提出,其两个重要假设是:①碳污染仅来源于现代碳污染,无死碳污染;②未知样品、标准样品以及本底样品的量必须相当,否则模型公式不成立,造成校正误差较大。其校正公式:
F=Fm(1+f)-f
(3)
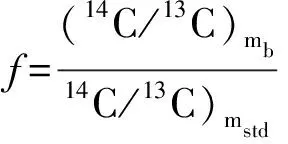
Brown等[56]将上述三种模型校正方法应用于校正标准ANU蔗糖样品和实际QL11658样品,其结果显示采用传统模型和两组分混合模型的校正结果比较一致,且与推荐值在误差范围内一致,而Donahue模型的校正结果与前两者有显著差异,表现为随样品量的降低校正结果明显偏低的趋势。Hua等[23]用上述三种模型校正FIRI-H和IAEA-C7时,得到了与Brown等相似的结果,只是差异没有Brown等那么明显。Santos等[42]和Yokoyama等[49]采用传统模型校正IAEA-C6、IAEA-C7、IAEA-C8和OXI均得到与推荐值一致的结果,尤其是微量样品也能得到满意的校正结果。
可以认为,大量实验已证实在特定的制样真空系统中,无论是未知样品还是标准样品或本底样品,其引入的碳污染量基本恒定。而传统模型和两组分混合模型正是基于此假设,因此采用这两种模型进行碳污染校正得到的结果比较满意。而实际石墨制靶中不仅有现代碳污染而且还存在死碳污染,且比较难于保证未知样品、标准样品以及本底样品的样品量相当,因此Donahue模型中的两个重要假设基本不成立,没有充分评估死碳污染所引入的大量13C,导致校正结果偏离推荐值,尤其是样品量越小偏离越大。
对于如何控制14C测试的目标组分易发生改变的这类特殊样品的本底水平,我们认为不仅需要加强实验室碳污染控制,更应该重视采样过程中引入的现代碳污染,实际上后者引入的碳污染量往往远大于前者,特别是14C含量接近本底水平(即14C年龄接近5万年)的样品尤为明显。如水样品中的溶解无机碳,该测年目标组分极易受到温度和压力、大气暴露时间、样品pH值等环境因素的影响。Aggarwal等[58]在对200m深度的碱性地下水进行14C样品采集的工作中,发现采用直接沉淀法采集样品测定的14C含量为13.3pMC,比采用吹气碱液吸收法采集样品的14C含量(1.3pMC)高,表明受现代碳污染程度高13倍。对碱性水样品暴露大气时间的实验证明,水样品暴露时间越长,引入的现代碳污染也就越大。作者实验室研究发现,相同的水样品采用AMS测试的年龄往往比液闪法测试的年龄偏年轻,这是因为液闪法样品量大而AMS样品量小,野外采样过程中明显的现代碳污染在AMS测试结果中表现得更加显著。但目前国内外就野外采样过程中如何控制碳污染的研究鲜有报道。因此我们认为此类特殊样品,除采用上文所述的两种实验室碳污染控制措施外,还应在野外采样和实验室溶解无机碳提取过程中更加重视封闭系统的设计和应用,以避免水样品暴露大气环境。
3 微量样品制样技术
近年来随着各学科研究的深入,均提出了对微量样品或超微量样品14C快速准确分析的迫切需求。在这些研究中由于受到样品性质和研究对象的限制,往往可供分析的样品量非常少或者碳含量非常低。虽然可以采用CO2气体源进行14C-AMS分析,但是由于受到记忆效应强、束流强度低以及精密度差等因素的限制,CO2气体源14C-AMS分析不能满足科学研究对数据精密度的要求。因此国际上对微量样品的分析仍然是以石墨固体源为主,而固体源14C-AMS技术的关键在于制备合格可靠的石墨样品靶。微量样品制样的最大特点就是能制备得到的CO2气体量少。受样品CO2气体量少的限制,微量样品制样过程会出现石墨产率和束流强度随样品量的降低而逐渐下降,同位素分馏和相对碳污染将逐渐加剧的问题。
由于样品量少,制备的CO2气体少,如仍在常规样品量石墨化单元中进行CO2催化还原,则会因为容器体积过大,降低了CO2分压,从而导致化学反应速率缓慢,不利化学反应向石墨生成的方向进行,继而出现了石墨产率低(甚至石墨合成不成功)、同位素分馏效应显著、碳污染严重等问题。Delqué-Kolicˇ等[19]和Yang等[59]的实验结果表明0.1~0.15mg碳的微量样品其石墨产率明显偏低(55%~100%),<0.1mg碳的微量样品其石墨产率(20%~80%)更低,且石墨产率波动范围也更大,石墨产率与样品量之间表现出明显的正相关性。束流强度与样品量之间同样有明显的正相关关系,表现为样品量越大,束流强度越大,譬如每毫克碳石墨的12C+束流产率约1μA[22,42,51-53]。另一个明显的现象就是微量样品的束流强度随时间出现明显波动的特征,观察到信号随时间快速“崩塌”[17,42,60]。也就是说,微量样品由于束流强度低,以及随时间的明显波动性,将直接导致测试的统计精度下降和可供测量的稳定时间缩短。由于化学反应不完全,即使石墨化产率达90%以上,也会因为样品量小而导致同位素分馏效应被放大[42,51,53]。实验证明在石墨化过程中,>500μg碳的常规样品的同位素分馏系数为0.988,<25μg碳的超微量样品的同位素分馏系数为0.970[53],而按照瑞利分馏理论计算的同位素分馏系数为0.990~0.991,由此可见同位素分馏效应与样品量之间表现出了强烈的依赖关系,即随样品量的降低,同位素分馏效应逐渐加大。由于特定的真空系统和石墨制备方法,其所引入的碳污染量基本恒定。对于样品量>100μg碳以上的样品,碳污染量占样品量的比例较小,还不足以明显改变样品的14C信息,表现出14C/12C比值随样品量的降低基本保持稳定。但是对于样品量<100μg碳以下的样品,微量碳污染就能完全掩盖样品的14C信息,因为现代碳污染带来的14C含量远远高于老龄样品中的14C含量。表现为14C/12C比值随样品量的降低呈逐渐上升的趋势,且测试精度变差[7,23,42-43,48,51]。
为了克服微量样品制样石墨产率低的问题,通常考虑缩小反应器体积,提高反应气体分压,加快化学反应速率,促使CO2气体尽可能向反应压力减小的石墨方向转化[11,17,42,52-53]。通用办法包括:缩小反应器内外径、缩短反应器长度;更换内腔室体积更小的高真空不锈钢管接头和压力传感器;采用套管火焰密封法等。这些通用办法只是发挥了一定程度的抑制作用,但尚未解决当样品量<100μg碳时,石墨产率、同位素分馏以及碳污染随样品量降低逐渐突出的根本问题。针对制样过程以及AMS测试过程中出现的同位素分馏效应,Santos等[42]根据标准OX-I在AMS上在线测试的δ13C值来进行同位素分馏效应校正;另一种方法是使用同位素比值质谱(IRMS)离线分析得到的δ13C值进行同位素分馏效应校正,但是此方法仅考虑到CO2制备和纯化过程中的同位素分馏,而未考虑石墨合成过程以及AMS测试过程中产生的同位素分馏。显然,利用在线δ13C值进行同位素分馏效应校正,更适用于微量样品的14C分析。
4 存在问题与展望
石墨制备技术是AMS-14C准确测年的关键。石墨制备方法选择和实验条件优化配置对获得高品质石墨样品至关重要,将直接影响最终的测试精度。在微量样品石墨制备时,这种影响表现得尤为突出。而这种影响可以通过优化选择实验条件和实验操作步骤,采用数学模型校正等方法加以扣除和抑制,但还需要更多详细的实验工作来加强现有认识,以期更好消除其对测试结果的影响。虽然如此,石墨制备技术仍然存在劳动强度大、效率低、碳污染影响大、方法稳定性差等问题。依据已有的研究成果,加速器质谱14C分析石墨制备技术未来还应该关注以下几点。
(1)半自动化-自动化样品制备真空系统。例如,采用电磁真空阀门实现气路自动控制,利用半导体制冷芯片或者激光冷却技术实现自动CO2物理纯化过程和去除反应体系中水蒸汽,利用激光加热技术或管式电炉实现自动加热。将这些技术集成,采用LabVIEW软件控制,可实现无人值守全自动化制靶,不仅提高了样品处理效率还降低了制样成本,而且石墨品质趋于一致,测试数据离差更小[32,59,61-66]。该全自动制样系统已在瑞士Ionplus公司实现了商品化[63,65,67-68],但其在微量样品(<0.1mg碳)和复杂基体样品等处理方面仍存在石墨产率低等诸多问题。
(2)GIS-AMS技术。AMS气体离子源(Gas Ion Source,GIS)的开发与应用,为降低本底、同位素分馏以及样品量,提升效率提供了新思路。将气相色谱、液相色谱、元素分析、激光离解、激光剥蚀等技术产生和分离的CO2气体直接引入AMS气体离子源,实现AMS快速准确的自动化分析[68-76]。例如,联用激光剥蚀技术可以实现固体碳酸盐样品高空间分辨率分析,联用色谱分离技术可以实现分子级单体化合物分析,联用元素分析技术(可以实现气溶胶在线有机碳和元素碳分析。但是由于GIS-AMS中CO2电离效率低、束流强度弱、精密度差以及记忆效应强等问题[15,40-41,77],使得GIS-AMS技术与新技术联用的应用范围受到了很大限制。因其具有特殊的技术优势,在分析精度要求不高的情况下仍有较大发展空间。
(3)特殊样品碳污染控制技术。对于14C测试的目标组分易发生变化的特殊样品,其野外样品采集技术目前在国内外鲜有报道。因此,在重视实验室碳污染控制的基础上,还应加强对野外采样和实验室溶解无机碳提取过程中碳污染来源的认识,重视封闭系统的设计和应用,以避免样品长时间暴露大气环境。
