川芎嗪对免疫介导骨髓衰竭小鼠肾脏氧化应激的影响
2019-11-06张小敏聂玲辉陈育尧莫志贤朱玲玲
张小敏,高 磊,2,胡 潇,聂玲辉,陈育尧,莫志贤,朱玲玲,2
(南方医科大学 1. 中医药学院、2. 南方医院中医科,广东 广州 510515;3. 广东省传统医学与运动伤害康复研究所,广东 广州 510317)
重型再生障碍性贫血(severe aplastic anemia,SAA)是以全血细胞减少、骨髓增生重度减低为特征的骨髓衰竭综合征,目前发病机制尚不完全清楚[1]。国内外大量实验研究证实,免疫介导骨髓衰竭小鼠模型是一个最接近SAA发病机制的动物模型[2]。在建立免疫介导的骨髓衰竭(bone marrow failure,BMF)小鼠模型过程中,亚致死剂量射线辐照是必需条件[3-4]。我们在处理模型小鼠时发现,肾、肝脏等多脏器苍白,与文献报道一致[4-5]。相关研究证实辐射会导致肾脏氧化应激反应[6],而贫血可进一步加重肾脏氧化应激损伤[7],但在建立免疫介导的BMF模型过程中诱导的肾脏氧化应激尚未见报道。
川芎嗪((tetramethylpyrazine,TMP)是从中药川芎中提取出来的活性生物碱,具有抑制血小板聚集、清除自由基、扩张血管、改善微循环等作用[8],并能减轻辐射诱导的DNA损伤、氧化应激反应及细胞凋亡[9],临床上广泛应用于心脑血管、呼吸系统、肾脏等疾病治疗,实验研究也证实了其治疗肾缺血/再灌注损伤及膜性肾病的有效性[10-11]。然而,TMP是否对BMF小鼠肾脏氧化应激具有保护作用尚不清楚。本研究旨在探讨川芎嗪对BMF小鼠肾脏氧化应激的影响及潜在机制。
1 材料与方法
1.1 材料
1.1.1实验动物 C57BL/6 ♀小鼠,SPF级,6周龄,体质量(15~18) g,共60只,购自南方医科大学实验动物中心,合格证号:SYXK(粤)2016-0167,在SPF级动物房内饲养。DBA/2 ♀小鼠14只,6周龄,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2016-0006。
1.1.2药物与试剂 川芎嗪单体(生产批号:18101001,成都曼思特生物科技有限公司);微量还原型谷胱甘肽(glutathione,GSH)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所,货号分别为:A006-2、A001-1、A005、A003-1);HIF-1α抗体(ab1,Abcam);VEGFA抗体(A17877,ABclonal Technology)。
1.1.3仪器 辐照仪(MultiRad);轮转石蜡切片机(Leica);血细胞计数仪(迈瑞BC-5000全自动血细胞分析仪);光学显微照相系统(日本Olympus)。
1.2 动物分组与处理按随机数字表法,将受体C57BL/6小鼠分为正常对照组、单纯辐照组、模型组、TMP低、中、高剂量组,每组10只。颈椎脱位法处死供体DBA/2小鼠,于体积分数75%乙醇中浸泡5 min,无菌操作取其颈部、腋下、肠系膜淋巴结及胸腺,加PBS缓冲液,轻轻研磨后,用200目筛网过滤,按胸腺细胞 ∶淋巴结细胞=1 ∶2制成淋巴细胞混悬液,配成细胞悬液浓度为2×1010·L-1。
1.3 免疫介导的BMF模型的建立受体C57BL/6小鼠经5.0 Gy X射线全身均匀照射后,4 h内经尾静脉输入DBA/2小鼠淋巴细胞混悬液0.2 mL,含4×106个淋巴细胞。14 d后处理各组小鼠,模型成功判定标准:①血细胞计数:全血细胞减少;②骨髓活检:骨髓多部位增生不良或低下,巨核细胞缺如,非造血细胞比例增多。
1.4 观察指标
1.4.1血细胞检测与骨髓有核细胞计数 在小鼠濒死状态或存活14 d后,采用摘眼球取血法采血,置于EDTA抗凝管中,检测各组小鼠血细胞计数。取右侧股骨,用PBS缓冲液反复冲洗骨髓腔直至股骨发白,留取骨髓细胞悬液,裂解红细胞后,计数骨髓有核细胞数量。
1.4.2骨髓与肾脏病理学检查 取左侧股骨,浸泡于脱钙液中至股骨软化后,用自来水浸泡2 h,置于10%中性甲醛固定72 h;取各组肾脏置于10%中性甲醛固定72 h。以上组织经乙醇梯度脱水、石蜡包埋、半薄切片及苏木精-伊红染色后,光学显微镜下观察正常对照组、单纯辐照组、模型组和给药组之间骨髓与肾脏病理学变化。
1.4.3肾脏氧化应激检测 取肾脏组织100 mg, 经冰冷PBS漂洗和裂解液匀浆后,于4 ℃、10 000×g离心15 min,取上清液,采用BCA蛋白定量试剂盒测定蛋白浓度。采用试剂盒检测MDA、SOD、GSH和GSH-Px活性水平,按照说明书操作。
1.4.4免疫组织化学法检测肾脏HIF-1α、VEGF蛋白表达 将肾组织石蜡切片经烤片和常规脱蜡至水后,经热修复抗原,于3%过氧化氢溶液中灭活内源性过氧化物酶及BSA封闭后,滴加一抗HIF-1α、VEGF,37 ℃烤箱中孵育0.5 h;室温下复温5 min,滴加二抗,37 ℃烘箱中孵育20 min,DAB显色2~5 min,于显微镜下观察显色情况,经苏木精复染和中性树胶封片,PBS代替一抗作阴性对照。结果判定:胞质呈棕黄色为阳性表达。应用ImageJ图像处理软件计算平均光密度来分析表达情况。

2 结果
2.1 外周血细胞检测与骨髓有核细胞计数Tab 1结果显示,与正常对照组相比,模型小鼠在濒死状态或存活14 d后,外周血三系红细胞、白细胞、血小板和骨髓有核细胞数量都明显下降(P<0.01),尤其白细胞下降最明显;与模型组相比,TMP给药组红细胞出现上升趋势,其中TMP高剂量组上升最明显(P<0.05);与模型组相比,TMP给药组血小板出现上升,其中TMP低剂量组增加最明显(P<0.01);与模型组相比,TMP高剂量组有核细胞明显上升(P<0.05)。
2.2 骨髓病理学改变Fig 1的骨髓病理可见,正常对照组造血组织结构完整,造血细胞分布均匀,造血细胞增殖旺盛;而模型组有核细胞明显减少,巨核细胞缺如,大量脂肪空泡代替造血细胞。TMP给药各组骨髓有核细胞增加,随TMP给药剂量的增加,骨髓有核细胞增加越明显。
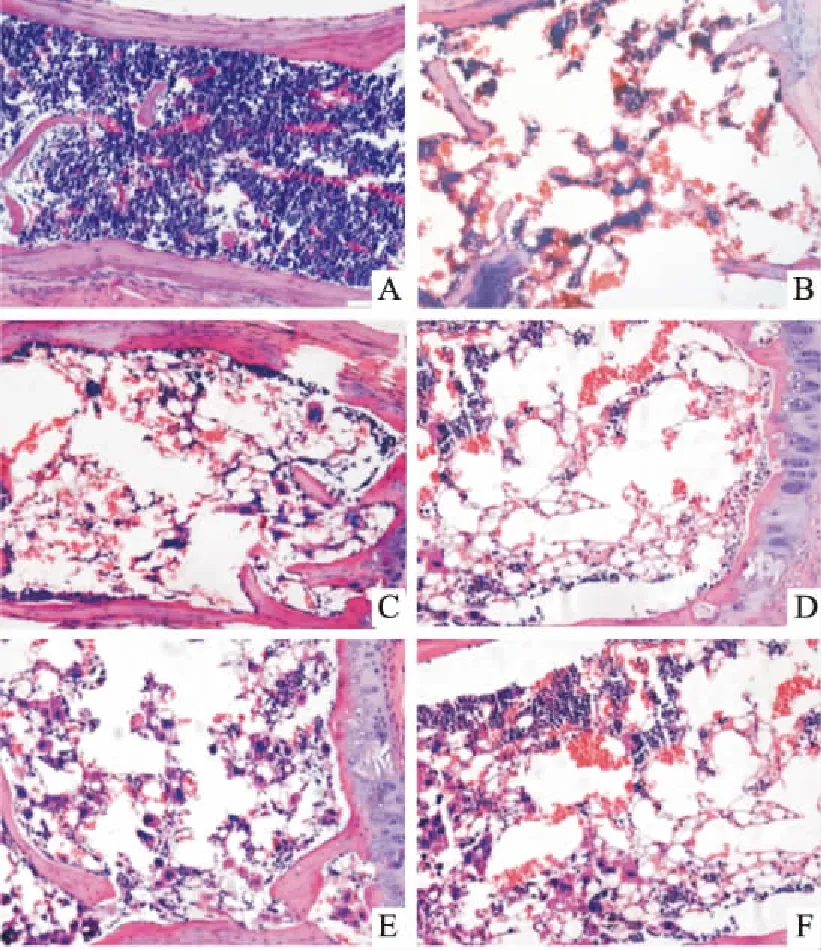
Fig 1 Bone marrow pathology of each group (HE ×200)
A: Control group; B: TBI group; C: Model group; D: TMP low dose group; E: TMP medium dose group; F: TMP high dose group.
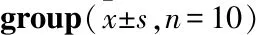
Tab 1 Blood cell counting and bone marrow nucleated cell counting of each
*P<0.05,**P<0.01vsmodel;#P<0.05,##P<0.01vscontrol
2.3 川芎嗪对肾脏病理的影响Fig 2的肾脏病理可见,模型组小鼠肾小管上皮细胞水肿,但无明显的淋巴细胞浸润;TMP给药各组未见明显的肾脏病理学改变。
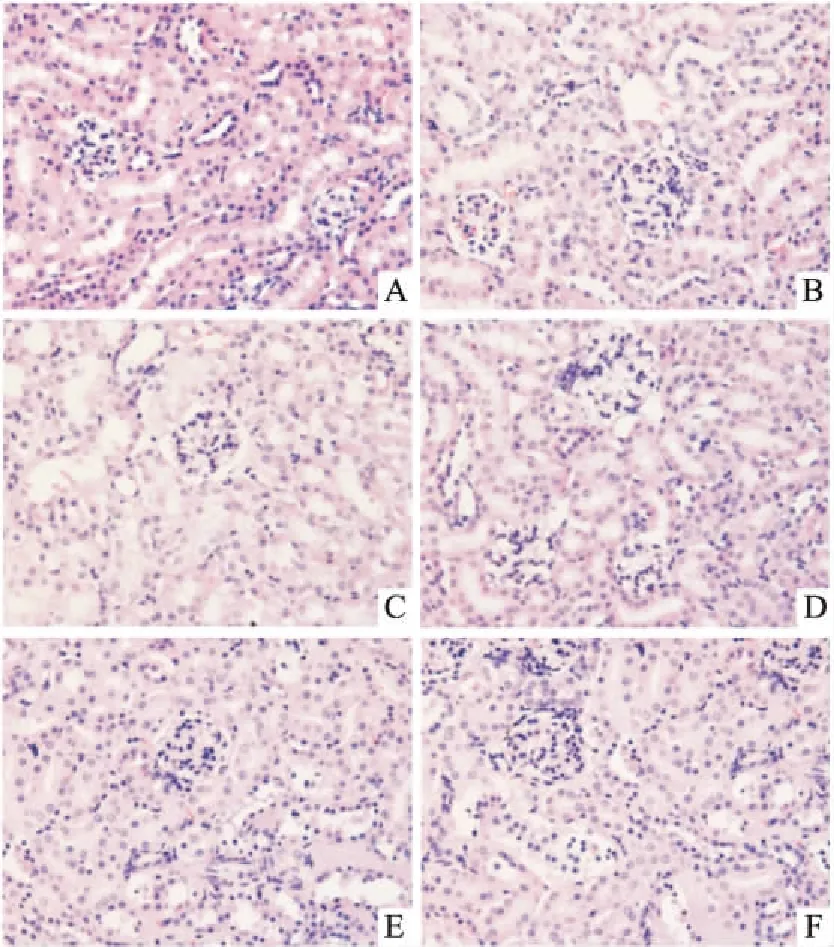
Fig 2 Renal pathology of each group (HE×400)
A: Control group; B: TBI group; C: Model group; D: TMP low dose group; E: TMP medium dose group; F: TMP high dose group.
2.4 川芎嗪对肾脏氧化应激的影响Tab 2结果显示,与正常对照组相比,模型组肾脏MDA含量明显升高(P<0.05);TMP中、高剂量组及单纯辐照组肾脏中MDA含量与模型组相比明显降低(P<0.05,P<0.01)。相比于正常对照组,模型组的SOD活力明显降低(P<0.05);TMP高剂量组SOD活力与模型组相比明显升高(P<0.05)。与正常对照组相比,单纯辐照组、模型组、TMP低剂量组肾脏GSH含量明显下降(P<0.01);TMP中、高剂量组GSH含量与模型组相比明显升高(P<0.01)。与正常对照组相比,模型组GSH-Px活力明显下降(P<0.05),而单纯辐照组、TMP给药各组无明显统计学差异(P>0.05)。
2.5 川芎嗪对肾脏组织中HIF-1α、VEGF表达的影响 经免疫组化检测,正常对照组未见HIF-1α表达,单纯辐照组小鼠肾小球基底膜区可见少量棕黄色的阳性颗粒表达,模型组HIF-1α阳性表达量明显增多;经TMP治疗后,与模型组相比,TMP中、高剂量组HIF-1α明显下降(P<0.01),TMP高剂量组几乎未见HIF-1α表达,见Fig 3。正常对照组、单纯辐照组、模型组小鼠未见VEGF表达,但经川芎嗪干预后,TMP低、中剂量组肾血管旁肾小管出现VEGF表达(Fig 4)。
Fig 3 Expression of HIF-1α in renal tissues by immunohistochemical staining (×400)
A: Control group; B:TBI group; C: Model group; D:TMP low dose group; E: TMP medium dose group; F: TMP high dose group.**P<0.01vsmodel;##P<0.01vscontrol
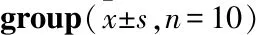
Tab 2 MDA, SOD, GSH and GSH-Px contents of kidney tissues in each
*P<0.05,**P<0.01vsmodel;#P<0.05,##P<0.01vscontrol
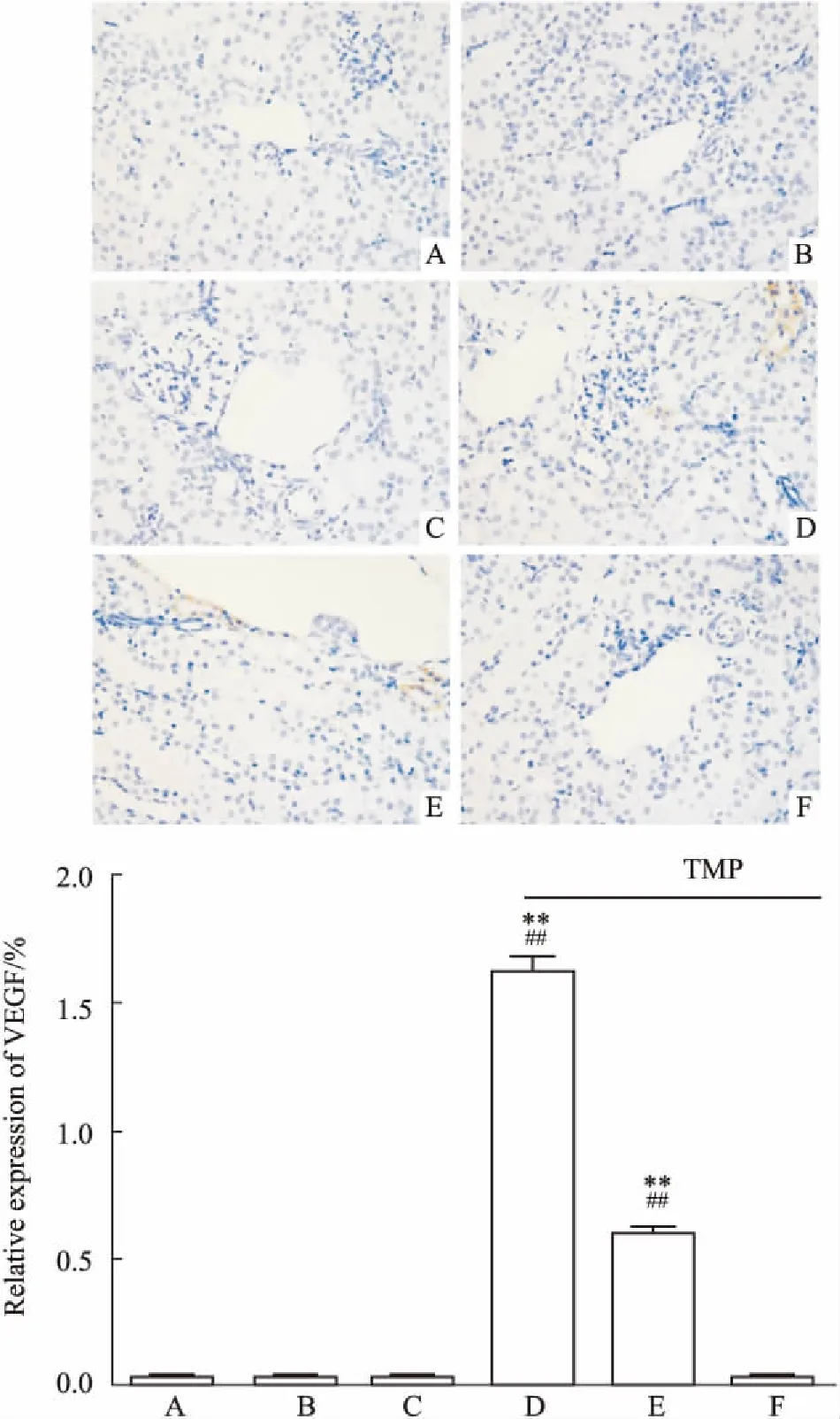
Fig 4 Expression of VEGF in renal tissues by immunohistochemical staining (×400)
A: Control group; B:TBI group; C: Model group; D:TMP low dose group; E: TMP medium dose group; F: TMP high dose group.**P<0.01vsmodel;##P<0.01vscontrol
3 讨论
免疫介导的BMF模型作为最接近SAA患者发病机制的动物模型[2],目前国内外大多采用辐照结合淋巴细胞输注的方法建立免疫介导的BMF动物模型。本实验中,我们通过X射线辐照结合淋巴细胞输注造模14 d后,模型组小鼠外周血三系和骨髓有核细胞均明显减少,骨髓病理可见脂肪空泡、巨核细胞缺如,说明成功建立免疫介导的BMF小鼠模型。既往研究表明,多种致病因素如辐照、缺血缺氧、炎症等都可导致肾脏氧化应激反应[6-7]。本实验肾脏病理切片显示,模型组小鼠肾小管水肿,检测肾脏氧化应激反应相关指标发现,与正常对照组相比,模型组小鼠肾脏氧化应激指标MDA明显上升,而抗氧化应激指标SOD、GSH、GSH-Px出现明显下降,单纯辐照组小鼠肾脏GSH明显下降,提示单纯辐照及造模都可导致小鼠肾脏氧化应激反应。
缺氧诱导因子HIF-1α是一种细胞应对缺氧的反应元件,已被证明在辐射损伤后被激活和上调表达[12],并参与多种应激反应。TMP作为一种有效的抗氧化剂,能够降低多种原因诱导的氧化应激反应,还能降低HIF-1α的表达[13]。并且HIF-1α参与调节VEGF的表达,而VEGF能通过诱导新血管的形成来重塑肾血流动力学[14]。那么,TMP能否通过HIF-1α/VEGF信号通路来减轻BMF小鼠肾脏因辐照与严重贫血诱导的氧化应激,值得深入探讨。
在本实验中,单纯辐照及造模后小鼠肾脏都存在氧化应激反应,并且HIF-1α蛋白表达增加,说明单纯辐照及造模后肾脏氧化应激可能与HIF-1α表达有关。给予TMP干预后,BMF小鼠肾脏无明显的病理学改变,TMP中、高剂量组肾脏MDA下降,而SOD、GSH上升,氧化与抗氧化系统恢复平衡,肾小球中HIF-1α蛋白表达明显下降、肾小管中出现VEGF蛋白表达,相关文献也证实,在HIF-1α降解的条件下,VEGF能被连续合成和持续表达[14],表明TMP可能通过抑制HIF-1α及上调VEGF蛋白表达,即通过调节HIF-1α/VEGF信号通路,从而减少模型小鼠肾脏氧化应激反应,达到保护小鼠肾脏的作用。
综上所述,TMP对免疫介导的骨髓衰竭C57BL/6小鼠模型肾脏氧化应激具有良好保护作用,其作用机制可能涉及HIF-1α/VEGF信号通路调控。
