拟康氏木霉胞外多糖对人结肠癌细胞HCT116增殖及凋亡的影响
2019-11-06沈学彬周玉燕陈靠山王国栋
李 萍,沈学彬,周玉燕,李 艳,高 娃,陈靠山,王国栋
(1. 皖南医学院药学院;2. 安徽省多糖药物工程技术研究中心;3. 活性生物大分子研究安徽省重点实验室,安徽 芜湖 241002)
目前,结肠癌是人群中最为高发的恶性肿瘤之一,严重威胁着人们的生命健康。近年来,中国结直肠癌的发病率及死亡率都呈现明显上升的趋势[1]。在结肠癌的治疗中,化疗是主要的治疗手段之一。结肠癌化疗常用药物奥沙利铂、伊立替康等,都具有较大的毒副作用,且常因发生耐药而失去作用,西妥昔单抗和贝伐单抗等发挥靶向治疗作用的新型生物药物也未能幸免[2]。因此,高效且低毒的新型天然抗结肠癌药物越来越受到人们关注。
研究发现,许多多糖具有抗肿瘤、抗衰老、调节免疫、抗病毒等其中的一种或多种生物学功能。多糖的抗肿瘤活性尤为引人注目,目前已提取出香菇多糖、黄芩多糖等多种具有抗结肠癌作用的多糖[3-4]。本课题组长期从事抗肿瘤活性多糖药物的筛选,目前已从黑根霉[5-6]、南极海洋菌[7]以及拟康氏木霉中,发现并提取出了具有抗肿瘤作用的活性多糖。拟康氏木霉胞外多糖(exopolysaccharide fromTrichodermapseudokoningii,EPS)是从拟康氏木霉发酵液中分离纯化出的一种均一的多糖,分子质量为31930 u,单糖组成及摩尔比为甘露糖 ∶葡萄糖 ∶半乳糖 ∶鼠李糖 ∶木糖 ∶果糖=25.8 ∶23.6 ∶48.1 ∶16.2 ∶14.4 ∶1。诱导肿瘤细胞凋亡是目前防治肿瘤研究的重要方向。前期研究已发现,EPS能够诱导人白血病细胞K562[8]和乳腺癌细胞MCF-7[9]凋亡。EPS对结肠癌细胞是否同样具有增殖抑制及诱导凋亡作用,尚未可知。本研究以结肠癌细胞HCT116为研究对象,探索EPS对结肠癌细胞的作用,并探讨其可能的作用机制。
1 材料与方法
1.1 试剂RPMI 1640培养基、胎牛血清、含EDTA胰酶(Gibco);CCK-8试剂盒、JC-1线粒体膜电位检测试剂盒、细胞周期检测试剂盒、caspase-9检测试剂盒、caspase-8检测试剂盒、caspase-3检测试剂盒(碧云天);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(凯基生物);结晶紫染色液(索莱宝);抗体Bax、Bcl-2(Abclonal);GAPDH抗体(CST);增强化学发光试剂盒(Invitrogen)。
1.2 仪器二氧化碳培养箱(Gold-SIM);全波长酶标仪(Thermo Fisher);TCS SP8激光共聚焦显微镜(Leica);蛋白电泳仪、凝胶成像仪(Bio-Rad);流式细胞仪(BD)。
1.3 多糖的制备拟康氏木霉菌保种于本实验室4 ℃冰箱。拟康氏木霉(Trichodermapseudokoningii)PDA培养基活化后,液体培养基中振荡培养96 h(28 °C、135×g)。收集上层液体,3倍体积无水乙醇沉淀,12 000×g离心收集沉淀,采用木瓜蛋白酶联合Sevag法脱蛋白(氯仿 ∶正丁醇=4 ∶1,V/V),减压旋转蒸发去除有机溶剂后,过D301型大孔树脂柱脱色,冷冻干燥后得到胞外粗多糖。粗多糖溶液过DEAE离子交换柱和G-75葡聚糖凝胶柱纯化。收集主成分后冻干,命名为EPS。
1.4 细胞培养人结肠癌细胞株(HCT116)购自上海细胞库。细胞培养在含双抗及10% FBS的RPMI 1640培养基中,培养箱温度37 ℃,CO2含量5%。
1.5 细胞增殖活力测定CCK-8法测定HCT116细胞的存活率。96孔板中细胞密度为每孔2×103个细胞,种板后培养24 h,吸弃培养基,分别加入100 μL终浓度分别为0、50、100、200、400、800 mg·L-1的EPS溶液,每组5个复孔。加药培养24 h后,按照说明书操作,450 nm处测定各孔的吸光值。细胞存活率/%=(A实验组-A调零孔)/(A空白对照组-A调零孔)×100%。
1.6 克隆形成率测定取对数生长期的HCT116细胞,使用含EDTA的胰蛋白酶消化,离心收集细胞,加入完全培养液并吹打成单细胞悬液,调整细胞密度使每孔细胞数500个,培养24 h后弃去培养液,每孔加入2 mL含不同浓度EPS的培养基,使终浓度分别为0、125、250、500 mg·L-1,继续培养。6 d后取出6孔板,弃去原培养液,使用PBS洗涤3次后,加入1 mL色谱甲醇固定10 min。弃去色谱甲醇,加入0.5%结晶紫溶液1 mL,室温染色30 min,回收结晶紫溶液,蒸馏水洗板,自然风干后拍摄照片。
1.7 Annexin V-FITC/PI流式双染法检测细胞凋亡率取适量对数生长期HCT116细胞,接种细胞至6孔细胞培养板,24 h后,每孔加入1 mL含不同浓度EPS的新鲜培养基,使终浓度分别为0、125、250、500 mg·L-1,24 h后收集培养基及细胞,离心,设对照管和单阳管及实验管,FITC单阳管和实验管先加入FITC避光室温孵育5 min,PI单阳管和实验管加入PI后立刻300目过滤细胞,流式细胞仪进行检测。
1.8 激光共聚焦显微镜检测线粒体膜电位(ΔΨm)取适量对数生长期的HCT116细胞,接种至激光共聚焦小皿,每孔0.5 mL,24 h后,每孔加入0.5 mL含不同浓度EPS的新鲜培养基,使其终浓度分别为0、125、250、500 mg·L-1,24 h后吸弃原培养基,PBS洗涤3次。按照试剂盒说明书,加入适量JC-1染色工作液和染色缓冲液,激光共聚焦显微镜下观察线粒体膜电位变化。
1.9 Western blot检测Bcl-2和Bax蛋白表达取适量对数生长期HCT116细胞,接种细胞至6孔细胞培养板,24 h后,每孔加入1 mL含不同浓度EPS的新鲜培养基,使其终浓度分别为0、125、250、500 mg·L-1,24 h后,洗涤细胞后,加入PMSF的裂解液,放置于水平摇床,冰上裂解20 min,4 ℃、12 000×g冷冻离心30 min,收集上清,测定各组蛋白质的浓度,并调整各组浓度使其一致。各组取10 μL蛋白质样品,蛋白质电泳分离目的蛋白,并将目的蛋白转移至硝酸纤维素膜上。5%脱脂牛奶粉摇床封闭90 min。加入稀释的一抗(Bax、Bcl-2、GAPDH),4 ℃孵育过夜。加入二抗,室温孵育2 h,加入曝光液后放入曝光机中,获得目的蛋白表达情况。
1.10 试剂盒检测caspase-9、caspase-8、caspase-3活性取适量对数生长期HCT116细胞,接种细胞至6孔细胞培养板,24 h后每孔加入1 mL含不浓度EPS的新鲜培养基(0、125、250、500 mg·L-1),48 h后收集原细胞培养基及细胞,离心收集沉淀,PBS洗涤后,按照每200万细胞加入100 μL裂解液,重悬沉淀,冰上裂解15 min。4 °C、18 000×g离心15 min,收集上清。按照试剂盒说明书操作,分别检测caspase-9、caspase-8和caspase-3酶活性。

2 结果
2.1 EPS对HCT116细胞增殖的影响采用CCK-8法分析了EPS对人结肠癌细胞HCT116存活率的影响。Fig 1A结果显示, EPS作用细胞24 h,在100~800 mg·L-1浓度范围能够明显抑制人结肠癌HCT116细胞存活,EPS作用细胞48 h,在50~800 mg·L-1浓度范围能够明显抑制人结肠癌HCT116细胞存活,并随着时间的增加和剂量的增大,作用逐渐增强。Fig 1B结果显示,经不同浓度EPS处理后,HCT116细胞克隆数降低,差异具有显著性(见Fig 1C)。
2.2 EPS对HCT116细胞凋亡的影响Fig 2结果显示,EPS(0、125、250、500 mg·L-1)作用于HCT116细胞48 h,流式检测发现,凋亡率分别为(10.21±2.04)%、(32.44±1.70)%、(50.77±2.36)%、(67.27±5.05)%,随着给药浓度的增加,凋亡比例逐渐上升,与对照组相比,EPS能明显诱导HCT116细胞凋亡(P<0.01)。
2.3 EPS对HCT116细胞线粒体膜电位的影响使用不同浓度EPS(0、125、250、500 mg·L-1)处理HCT116细胞后,进行JC-1染色发现,随着给药浓度的加大,绿色荧光逐渐增加,红色荧光逐渐减少(Fig 3)。
2.4 EPS对HCT116细胞中凋亡相关蛋白的影响Fig 4A结果表明,EPS (0、125、250、500 mg·L-1) 处理HCT116细胞后,随着给药浓度增大,Bcl-2蛋白表达量逐渐降低,Bax蛋白表达量却呈现上升趋势,导致Bcl-2/Bax比值逐渐下降 ,结果与空白对照组相比较均具有统计学意义(Fig 4B)。Fig 4C结果表明,当EPS(125、250、500 mg·L-1)作用HCT116细胞48 h后,与对照组相比,caspase-9、caspase-8以及caspase-3酶活性均明显升高。 caspase-9活性升高的百分比均值分别为21.04%、32.33%、42.67%,caspase-3酶活性升高的百分比均值分别为28.67%、47.62%、60.33%。
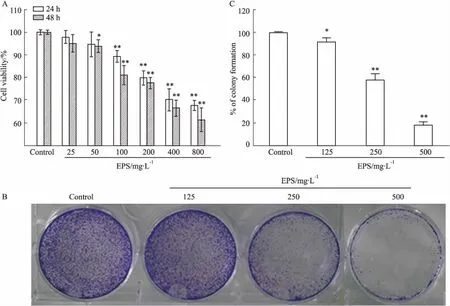
Fig 1 Effects of EPS on proliferation of HCT116 cells
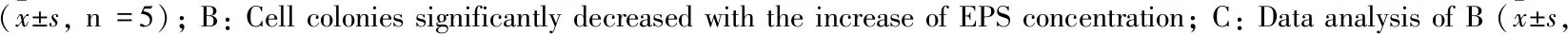
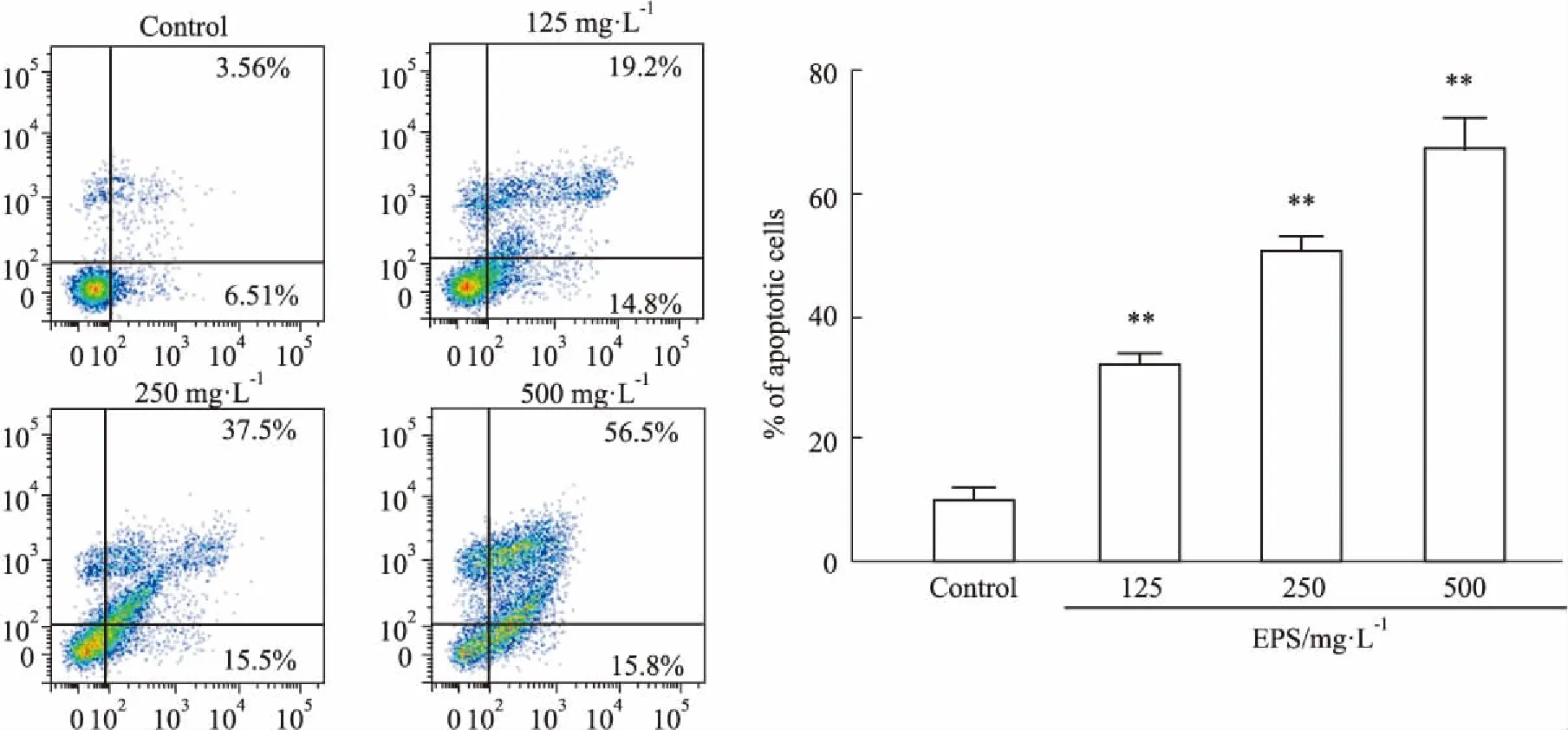
Fig 2 Effects of EPS on apoptotic rate of HCT116 cells n=3) **P<0.01 vs control.
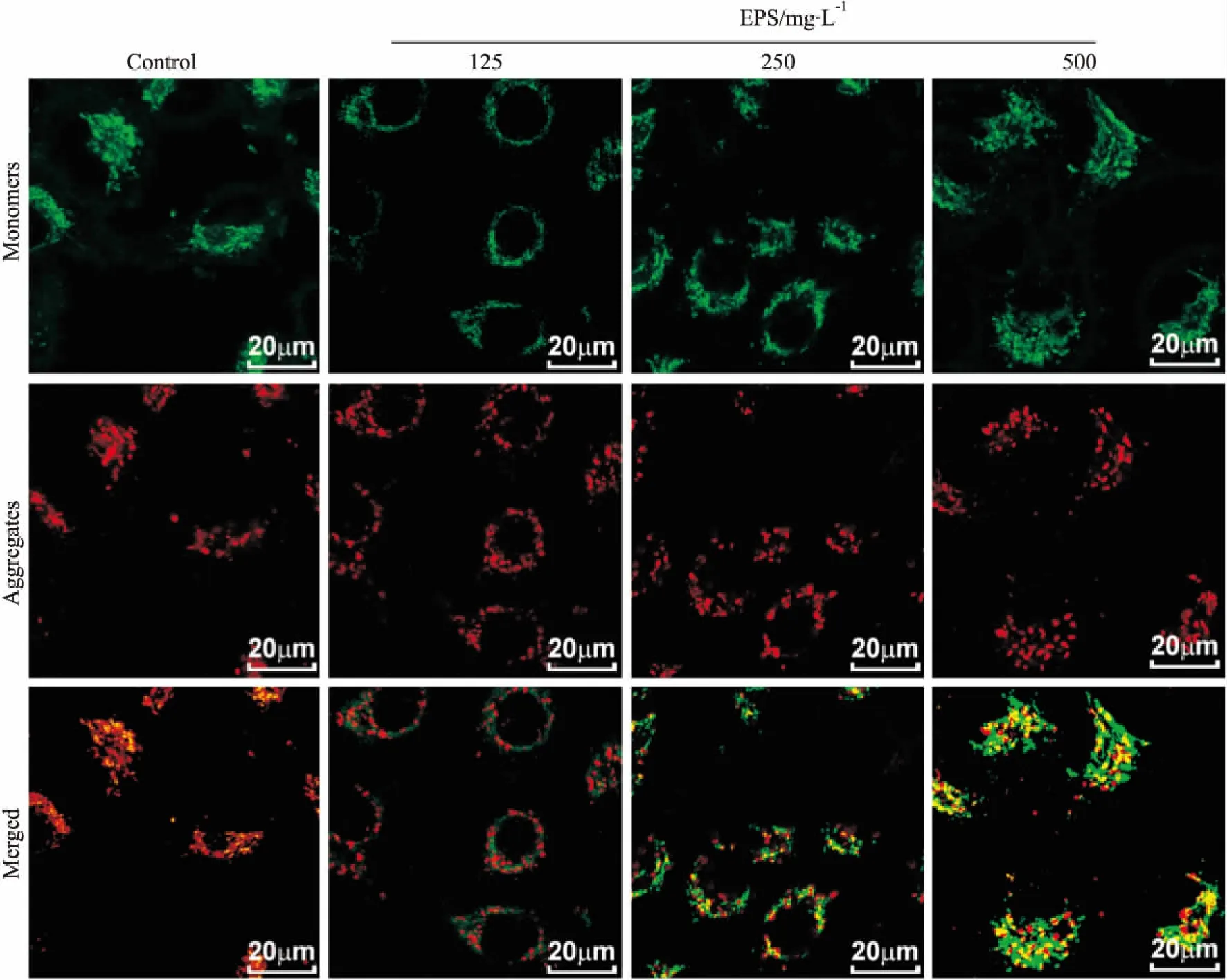
Fig 3 Effect of EPS on cell mitochondrial membrane potential of HCT116 cells
3 讨论
肿瘤细胞本身可产生生长因子受体,从而不能实现负反馈调节,表现为持续的增殖信号刺激,无限的分裂增殖[10]。是否具有增殖抑制作用是评价抗肿瘤药物是否有效的重要指标。本研究CCK-8结果显示,EPS可抑制HCT116细胞增殖,克隆形成实验则证明EPS能抑制HCT116细胞克隆形成,表明EPS对人结肠癌细胞HCT116具有增殖抑制作用。

Fig 4 Effects of EPS on expression of apoptosis-related proteins in HCT116 cells n=3)
A: Protein levels of Bcl-2, Bax, Bcl-2/Bax; B: Data analysis of A; C: Effects of EPS on caspase-9, caspase-8 and caspase-3 activity in HCT116 cells.*P<0.05,**P<0.01vscontrol.
细胞凋亡又被称为细胞程序性死亡,其对于维持一个多细胞生物的组织或器官的完整性和平衡性,具有不可替代的重要作用。凋亡是增殖的屏障,可以阻止肿瘤细胞的过度增殖,凋亡逃逸被认为是癌症发生的标志之一[11]。“凋亡触发”由促凋亡蛋白和抗凋亡蛋白之间的平衡控制。抑制凋亡的分子,以Bcl-2分子为代表;促进凋亡发生的分子,以Bax分子为代表。随着EPS加入浓度的增大,Bcl-2/Bax比值逐渐降低。由此可见,Bcl-2蛋白家族参与了EPS诱导HCT116细胞凋亡作用。通过激光共聚焦显微镜观察线粒体膜电位的变化,发现随着EPS浓度的提高,线粒体表现为去极化作用增强,跨膜电位丢失。EPS导致细胞线粒体膜电位下降,Bcl-2表达降低,Bax基因表达增加,caspase-9释放,最终激活效应分子caspase-3,引起结肠癌细胞凋亡。因此,EPS诱导人结肠癌细胞HCT116凋亡可能是通过线粒体途径,但caspase-8的活性也同时增强,因此,肿瘤坏死因子(TNF)受体家族也可能参与了EPS诱导HCT116凋亡。另外,Bax与Bcl-2共用蛋白-蛋白相互作用域,即BH3基序,而与自噬密切相关的Beclin-1蛋白是BH3凋亡调节蛋白家族成员,EPS也可能诱导凋亡的同时,激活或抑制了肿瘤细胞的自噬作用。
EPS为真菌发酵提取物,和其他动植物中提取的具有抗肿瘤作用的多糖相比,其生产不受季节因素的影响,也不需要较长的生长周期,所需场地面积小,适合后期的大规模量产。近几年,人们已从单一的植物中寻找天然抗肿瘤药物逐渐转向细菌、真菌等微生物,尤其是各类微生物的发酵产物以及次生代谢产物[12]。前期研究发现,拟康氏木霉发酵产物中提取的多糖对CT26结肠癌移植鼠具有抑瘤作用[13],本研究证明,EPS可抑制结肠癌细胞增殖,并可能通过线粒体通路诱导人结肠癌细胞凋亡,为该多糖开发为抗结肠癌药物提供了新的证据,也为微生物发酵产物中发现抗肿瘤物质,提供了新依据和数据支持。化疗药物常以抑制免疫作用为代价,而拟康氏木霉多糖抑制肿瘤的同时却可提高机体免疫功能[14],因此是较为理想的抗肿瘤潜在药物。当然,该多糖是否可以作为一种有效的辅助手段用肿瘤的治疗,还需进一步结合动物模型和临床实验进行更加深入的研究。
(感谢皖南医学院中心实验室和安徽省多糖药物工程技术研究中心提供实验平台,感谢中心实验室余浩、吕梦娟、窦德宇老师的协助,感谢多糖中心柳春燕和袁平川老师及陈雨婷、阙月月等同学的支持与协助。)