乙型肝炎病毒衣壳蛋白装配调节剂研究进展
2019-11-06李玉环
杨 璐,吴 硕,李玉环
(中国医学科学院北京协和医学院医药生物技术研究所抗感染药物研究北京市重点实验室、国家卫生健康委员会抗生素生物工程重点实验室,北京 100050)
乙型肝炎病毒(hepatitis B virus,HBV)感染已成为全球性的公共健康问题,全球目前约有2.57亿HBV感染者[1]。HBV主要有血液传播、性传播和母婴传播3种传播途径。HBV感染可引起急性和慢性肝炎,继而引发肝脏病变,每年约数百万的患者死于HBV感染导致的肝功能衰竭、肝纤维化、肝硬化和肝癌。我国是乙型肝炎的高发区,2006年,我国HBV表面抗原阳率达7.18%,现在虽有所降低,但仍在6%~7%。
HBV疫苗的普及和婴幼儿计划免疫项目的推广对乙肝的预防起到了积极的作用,但仍有5%~10%的人对疫苗无抗体应答或产生不良反应。而且,目前针对慢性乙肝的治疗方法尚不能完全清除HBV,HBV的治疗仍是一个至关重要的问题,研发新型HBV药物具有重要意义。HBV衣壳装配调节剂可以作用于HBV复制的多个阶段,因而成为乙肝药物研发的新热点。
1 HBV
HBV属于嗜肝DNA病毒科正嗜肝DNA病毒属,是目前发现最小的,具有复制功能的DNA病毒。
1.1 HBV结构组成具有感染性的完整HBV颗粒直径约为42 nm,呈球型,具有双层衣壳[2]。外衣壳是嵌有糖蛋白的脂质双分子层,HBV表面抗原(HBsAg)也镶嵌于此;内衣壳是直径约27 nm的20面体,包裹病毒的基因组DNA和DNA聚合酶。此外,一些细胞蛋白,如伴侣蛋白和蛋白激酶也包含在衣壳内。组成内衣壳的蛋白为HBV核心抗原(HBcAg)。HBcAg经酶或去垢作用后,可暴露e抗原(HBeAg)。
HBV基因组结构特殊,为部分双链松弛环状DNA(relaxed circular-DNA,rcDNA),长链为负链,长度固定,约3.2 kb;短链为正链。HBV基因组有4个重叠的开放阅读框,分别为S、C、P和X区。S区编码小(S)、中(M)、大(L)3种病毒表面蛋白。C区编码HBcAg和HBeAg。P区最长,负责编码有逆转录、RNaseH等活性的DNA聚合酶。X区则编码病毒的X蛋白,主要负责宿主细胞信号转导的调节,影响宿主和病毒基因的表达。虽然X蛋白不是结构蛋白,但与cccDNA的转录以及肝癌的发生密切相关。
1.2 HBV生命周期HBV与宿主细胞表面的受体钠离子-牛磺胆酸共转运蛋白(sodium taurocholate cotransporting polypeptide,NTCP)结合进入细胞。之后脱去核衣壳,rcDNA进入细胞核后在相关酶的作用下,延长修补正链形成共价闭合环状DNA(covalently closed circular DNA,cccDNA)。在宿主RNA聚合酶的作用下,进一步以cccDNA为模板转录形成基因组RNA,包括3.5、2.4、2.1、0.7 kb 4种长度的RNA,其中3.5 kb RNA为病毒的前基因组RNA(pregenomic RNA,pgRNA),编码HBV DNA聚合酶、核心蛋白(HBc)和Pre-core蛋白;2.4 kb RNA编码HBV L表面蛋白;2.1 kb RNA编码S和M表面蛋白;0.7 kb RNA编码HBx蛋白[3]。在RNA转运出细胞核并翻译出相应蛋白后,核心蛋白装配形成核衣壳,pgRNA与DNA聚合酶一起被包裹入壳内,接着pgRNA以自身为模板逆转录出负链DNA,逆转录得到的DNA再作为模板合成正链DNA,形成新的rcDNA,核衣壳成熟[8]。核衣壳大部分会在内质网和高尔基体的加工下,被膜蛋白包被,形成成熟的病毒颗粒,分泌至胞外,继续感染周边细胞。也有一部分核衣壳会重新进入细胞核,合成更多的cccDNA[4]。pgRNA被包裹进入衣壳后也可直接经过包被,分泌至细胞外(Fig 1)。多个cccDNA分子与病毒和宿主蛋白一起组成游离的微小染色体(episomal minichromosome),在细胞没有二次感染的情况下,cccDNA可以作为模板合成子代病毒,这也是HBV难以彻底清除的主要原因。

Fig 1 HBV life cycle
2 乙型肝炎的治疗药物
目前,抗乙肝治疗主要是干扰素(interferon,IFN)和核苷类似物(nucleoside analogues,NUCs)两大类药物。IFN包括IFNα和聚乙二醇IFNα,除了发挥直接抗病毒作用,也参与免疫调节过程,但是INF存在价格昂贵、副作用大的缺点。NUCs包括拉米夫定(lamivudine,3TC)、阿德福韦酯 (adefovirdipivoxil,ADV)、恩替卡韦(entecavir,ETV)、替比夫定(telbivudine,TBV)和替诺福韦(tenofovir,TFV)等,通过抑制逆转录过程,抑制病毒复制,抗病毒作用较强,但停药后复发率高,长期用药存在耐药问题。现有的HBV治疗方法均不能彻底清除cccDNA,进而彻底清除病毒感染,无法治愈乙肝。
药物影响HBV复制周期的任何一个环节都可能抑制病毒的复制,抗HBV药物的研发也处在不断探索的阶段。目前在研的抗HBV药物主要包括以下两个方面:一方面,通过激活宿主免疫系统功能有望帮助清除HBV,如TLR7激动剂GS-9620(Gilead Sciences,Ⅱ期临床)、RG7854(Roche,I期临床)、RO6870868(Roche,Ⅱ期临床)、AL-034(Janssen Pharmaceuticals,Ⅰ期临床),TLR8激动剂GS-9688(Gilead Sciences,Ⅰ期临床)以及RIG-Ⅰ和NOD2的双重激动剂SB 9200(Spring Bank Pharmaceuticals,Ⅱ期临床),均正在慢性乙肝治疗中进行尝试[5]。另一方面,直接靶向病毒自身成分或病毒与宿主相互作用的蛋白,包括HBV进入抑制剂,如Myrcludex B(MYR Pharma,Ⅱ期临床)可以特异性地结合NTCP,进而有效地抑制HBV感染正常细胞;NUCs前药,可以选择性地在肝脏中释放或激活,提高了耐受性和安全性,如替诺福韦前药TFV exalidex(TXL/CMX-157,ContraVir,Ⅱ期临床)、阿德福韦前药Pradefovir(Chiva,Ⅲ期临床)和贝西福韦(Besifovir, LB-80380,LG life science,Ⅲ期临床);RNA干扰(RNAi),如ARB-1467(Arbutus Biopharma,Ⅱ期临床)、RG-6004(Roche,Ⅰ期临床)、GSK-3389404和GSK-3228836(GlaxoSmithKline,Ⅱ期临床),均是基于RNAi来封闭HBV蛋白的表达,抑制病毒增殖;cccDNA功能抑制剂,如有报道化合物CCC-0975、CCC-0346和水解单宁(安石榴苷、石榴皮鞣素和老鹳草素)在细胞水平能降低HBV cccDNA的合成;HBsAg释放抑制剂,如REP 2139(Replicator,Ⅱ期临床)可以干扰亚病毒颗粒的形成,并阻止HBsAg释放,以改变HBsAg引起的自身免疫抑制。
直接靶向病毒还包括衣壳蛋白装配调节剂(HBV core protein allosteric modulators,CpAMs),该类化合物通过调节核心蛋白二聚体动力学特征影响衣壳的组装,进而抑制pgRNA的衣壳化、rcDNA和cccDNA合成等HBV复制的多个阶段,有望单独或联合用药实现更高的乙肝功能治愈率,因此,CpAMs成为潜力较大的新型抗乙肝药物研发方向。
3 HBV衣壳蛋白装配调节剂
HBV衣壳是由90个或120个核心蛋白二聚体组装形成的对称的20面体结构。HBV衣壳的形成对病毒基因组起到保护作用,加快衣壳蛋白降解或者阻断衣壳蛋白装配,都会影响病毒复制。
核心蛋白包含183或185个氨基酸,前149个氨基酸构成N端结构域(N-terminal domain,NTD),主要负责衣壳的支撑,可以在体外进行组装[6];氨基酸150-183/185构成C端结构域(C-terminal domain,CTD),富含丝氨酸和精氨酸,CTD的磷酸化和去磷酸化与核酸的结合以及核转运有关,也对pgRNA的衣壳化以及DNA的形成发挥重要作用(Fig 2)。
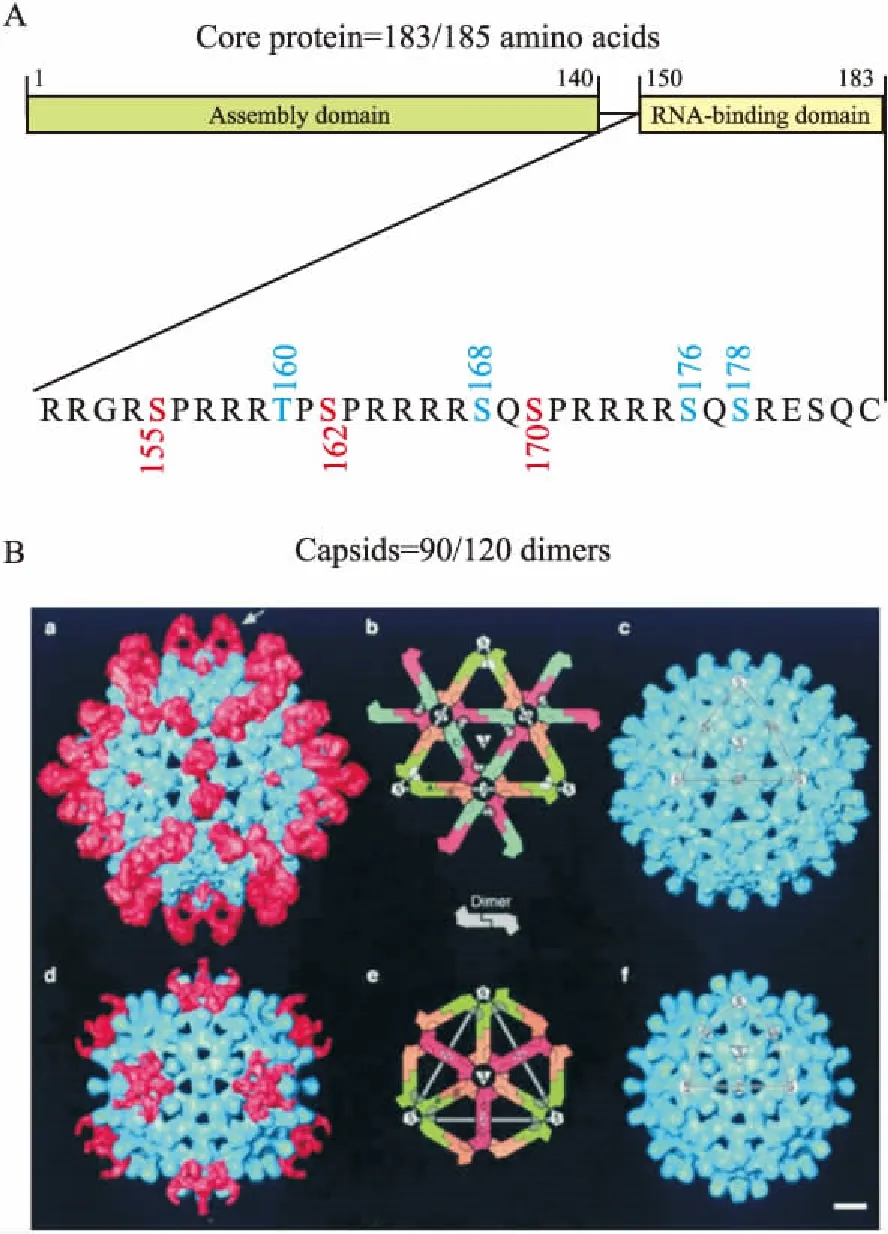
Fig 2 HBV capsid protein dimer
A: Sequence of HBV capsid protein gene; B: HBV capsid consists of 90 or 120 capsid protein dimers[7].
目前报道的HBV衣壳蛋白装配调节剂根据作用机制主要分为两大类:Ⅰ类化合物能改变二聚物之间的夹角,从而加速衣壳的降解,促使形成非衣壳形式的核心蛋白聚合物;Ⅱ类化合物能够诱导结构和形态正常的空衣壳的形成,即该衣壳中不含HBV基因组和DNA聚合酶(Fig 3)。如Fig 4所示,电镜下I类CpAMs Bay41-4109诱导形成形态异常的聚合物,且particle gel检测不到衣壳;Ⅱ类CpAMs在电镜下衣壳结构和形态正常,但是,particle gel结果显示衣壳迁移率发生变化,同时衣壳内DNA减少。
利用结构模拟及分子对接实验发现,Ⅰ类和Ⅱ类CpAMs均是通过与二聚体界面的疏水口袋相互作用来影响衣壳装配。如Fig 3A所示,I类CpAMs HAP1作用位点主要是位于二聚体亚单位C和D,Ⅱ类CpAMs AT-130作用位点主要是位于二聚体亚单位B和C;如Fig 3B所示,HAP18、HAP1和AT-130使HBV衣壳在三级和四级结构上发生不同变化。
3.1 Ⅰ类衣壳蛋白装配调节剂——芳基-二氢嘧啶(heteroaryldihydropyrimidines,HAP)类Bay41-4109是HAP类药物中治疗乙肝的代表性药物(Fig 5),目前处于临床I期试验。该药物在体内和体外均被验证具有良好的抑制HBV复制的效果[13]。Bay41-4109在HepG2.2.15细胞中的IC50约为53 nmol·L-1,在人源化的Alb-uPA/SCID小鼠中,抑制HBV复制的同时,不会造成肝细胞损伤。在HBV转基因小鼠中,Bay41-4109可以减少小鼠肝脏和血液中HBV DNA的含量,抑制效果与3TC相当。与传统的乙肝药物作用机制不同的是,其能降低受试小鼠肝脏中的HBcAg含量[14]。进一步研究发现,低浓度的Bay41-4109可以提高装配效率,高浓度的Bay41-4109可以导致异常衣壳结构的形成。这两种作用都可以减少HBV衣壳的形成[15]。

Fig 3 HBV capsid-CpAMs binding site and change of capsid structure
A: Sketch Map of binding sites between HBV capsid and CpAMs[8-9]。(a) A diagram showing the profile of HBV icosahedral capsid, in which red, blue, yellow and purple represent subunits A, B, C and D respectively, and cyan represents the binding position of HAP 1; (b) The binding position of HAP 1 (cyan) in the hydrophobic pocket between the two dimers;(c) The binding site of AT-130 (purple) and HAP1 (cyan) in subunit C (yellow); (d) The binding site between AT-130 (purple) and subunit B (blue). B: Overlays of CpAMs-bound capsids (magenta) on apo-capsid (cyan) when viewed down the 5-fold reveal systematic differences in capsid structure in the exterior (upper panels) and interior (lower panels)[10].
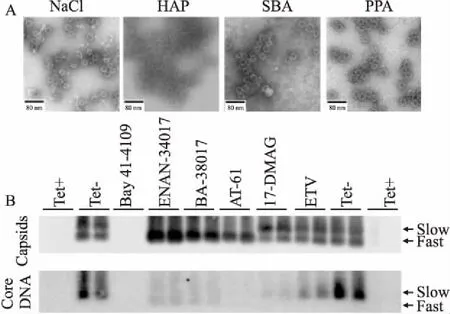
Fig 4 Biological characteristics of type Ⅰ and type Ⅱ CpAMs by different experimental methods
A: Electron microscopy analysis of core protein treated with different CpAMsinvitro[11]. B: Particle gel assay of capsids assembled in cells treated with representative type Ⅰ and type Ⅱ CpAMs[12].
GLS4作为Bay41-4109后续开发的第2代HAP类药物(Fig 5),目前处于临床Ⅰ期和Ⅱ期阶段。该药在HepG2.2.15细胞中,IC50达到了12 nmol·L-1的高活性。在Hep2.2.15细胞和瞬时转染HBV质粒的HepG2细胞中,GLS4均会干扰核心颗粒的形成。此外,GLS4对ADV耐药株rtA181T/V和rtN236T同样具有敏感性。临床前实验结果显示,相较于Bay41-4109,GLS4抑制HepAD38细胞上清HBV的活性更高,在人原代肝细胞中毒性更低,且可以更好地抑制肝脏中病毒的生成。将HepAD38细胞接种于裸鼠,得到HBV核瘤小鼠,给予GLS4和Bay41-4109后,都可以强烈持续地抑制HBV DNA的复制,降低肿瘤内HBcAg的水平[16]。药代动力学研究中,用酮康唑或利福平对成年♂比格犬预处理,都会明显影响GLS4的血浆浓度,说明GLS4是CYP3A肝药酶的一种敏感底物[17]。
HAP_R10(Roche,Ⅰ期临床,已停止)作为第3代HAP类化合物(Fig 5),其特点是在C6吗啉基的位置上引入1个羧基。已有研究证实了其优于一、二代HAP类化合物的药效。在HepG2.2.15细胞上的EC50达3 nmol·L-1,而在尾静脉高压注射的小鼠模型上也表现出了较优的药代动力学效果和安全性。3 mg·kg-1每日两次给药就可以在血浆和肝脏中表现出较好的抗病毒效果[34]。
近期,Roche公司公布了一类新的HAP类化合物,命名为4-ME HAP(Fig 5)。其中的代表性化合物24在HepDE19细胞中EC50为0.084 mmol·L-1,在HDI小鼠模型中也显示出了很好的效果。此外,HEC、Janssen和Enanta等公司也报道了相关的4-ME HAP化合物[18]。
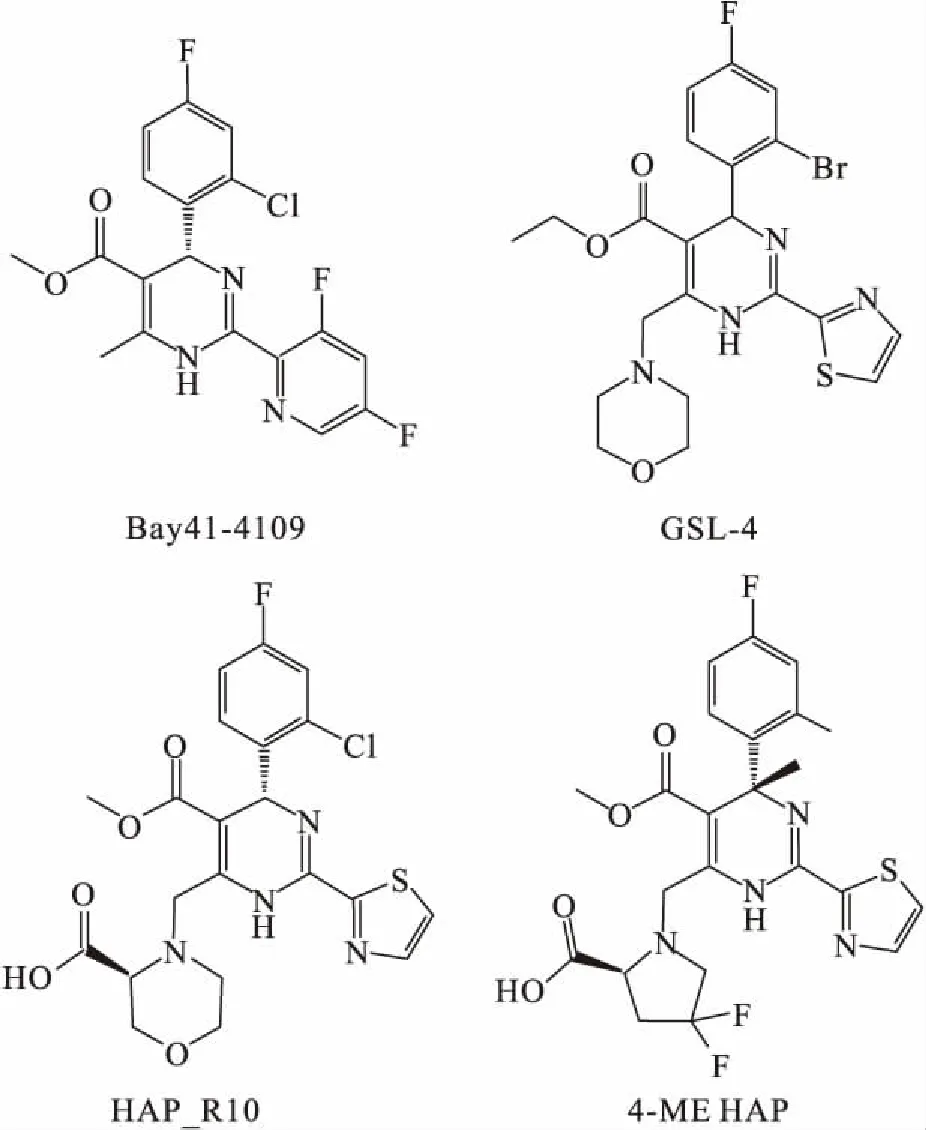
Fig 5 Chemical structure of type I CpAMs
3.2 Ⅱ类衣壳蛋白装配调节剂
3.2.1苯丙烯酰胺类(phenylpropenamides,PPA) AT-61和AT-130是PPA类的代表化合物(Fig 6)。针对PPA类化合物的研究最早是从AT-61开始的,AT-61可以抑制胞内核衣壳的形成和胞外病毒粒子的释放,其在27 μmol·L-1剂量时,能抑制细胞核中99%以上的cccDNA。虽然AT-61对HepAD38胞质内的HBV RNA含量没有影响,但可以减少包含pgRNA的成熟病毒颗粒含量。此外,该化合物特异性作用于HBV,对鸭乙型肝炎病毒(DHBV)、土拨鼠乙型肝炎病毒(WHV)、人类免疫缺陷病毒1型(HIV-1)、单纯疱疹病毒1型(HSV-1)、水疱性口炎病毒(VSV)和新城鸡瘟病毒(NDV)没有影响[19]。AT-130作为后续开发的PPA类药物,也是通过阻断HBV RNA的包装,进而抑制病毒的复制。AT-130可以加速体外衣壳组装,形成形态上完整的空衣壳。后续的一系列研究发现,AT-61和AT-130对3TC耐药株(rtL180M、rtM204I、rtL180M+rtM204V)有效,且和3TC联合用药可产生协同效应[20]。目前,AT-61和AT-130还处于临床前阶段,具有很重要的研究价值。
3.2.2磺胺苯甲酰胺类(sulfamoybenzamide derivatives,SBA) SBA类药物(Fig 6)在永生化小鼠肝细胞衍生稳定细胞系(AML12HBV10)中表现了良好的降低HBV DNA的能力,可以抑制HBV核衣壳的形成,且对WHV和DHBV不具备敏感性,如DVR-23。HBV和WHV的衣壳蛋白、DNA聚合酶以及pgRNA的异源遗传互补研究结果表明,HBV衣壳蛋白对SBA类化合物具有敏感性[21]。
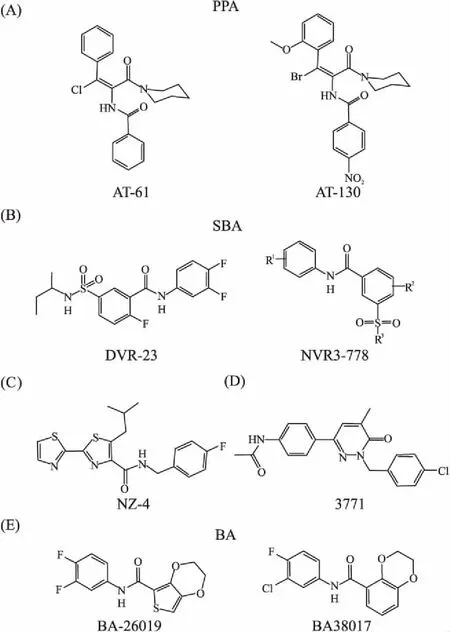
Fig 6 Chemical structure of type II CpAMs
Chemical structure of PPA (A), SBA (B), NZ-4 (C), 3771(D) and BA (E).
NVR3-778作为这类药物的代表药物,在HBV感染的人肝嵌合的uPA/SCID小鼠中不仅可以明显降低血清中HBV DNA的载量,也能减低HBV RNA的载量,表现出了较高的抗病毒活性。相对于NVR3-778和PEG-IFNα单独给药组,NVR3-778和PEG-IFNα联合给药组表现出更高的抗病毒活性[22-23],表明CpAMs和干扰素α具有功能性协同作用。NVR3-778目前已完成了临床Ia和Ib试验,耐受性良好。Ib临床数据结果显示,慢性HBV感染患者每日两次600 mg,口服4周可以减低1.72 log10的HBV DNA。NVR 3-778 (600 mg每日服用两次)与PEG-IFNα (每周180 μg)联合用药结果也显示出了更好的疗效。但是,目前强生公司终止了对NVR3-778的临床试验[18]。
AB-423是SBA另一个代表药物,结构未知,其在体外可以抑制A-D基因型以及NUCs耐药株的复制。在HepDES19细胞中,AB-423也可以抑制pgRNA衣壳化过程。此外,AB-423可以抑制衣壳化的rcDNA转变为cccDNA,并且可以与NUCs、RNAi类药物以及IFN-α发挥协同作用[24]。
JNJ-379(Janssen Pharmaceuticals,I期临床)也表现出较好抗HBV的潜力。在HepG2.2.15细胞中的EC50和EC90分别为69 nmol·L-1和240 nmol·L-1。体积排阻色谱和电镜结果均显示JNJ-379可以介导衣壳组装,但是不改变其大小和形态。Ia期临床结果显示,该化合物在健康受试者中最大无毒给药剂量可达600 mg[22]。
3.2.3哒嗪酮衍生物(pyridazinone derivatives) 哒嗪酮衍生物(Fig 6)3711在HepG2.2.15细胞系内抑制胞外和胞内HBV DNA的IC50约为1.5 μmol·L-1和1.9 μmol·L-1。细胞实验表明,3711对3TC/ETV耐药株L180M/M204I和ADV耐药株A181T/N236T同样具有敏感性。电镜结果显示,3711可以诱导空衣壳的形成,且不影响衣壳的形态和HBc蛋白表达。3711对CTD-Pol/pgRNA复合物没有影响,而是通过加强衣壳二聚体界面的疏水作用发挥功能[25]。对哒嗪酮类化合物进行后续结构优化,发现又一个很有潜力的抗病毒化合物5167,具有高抗HBV活性(IC50≈87 nmol·L-1)和低细胞毒性(CC50≈90.6 μmol·L-1)。5167对NUCs耐药株同样具有敏感性,并且和NUCs联合用药时可以产生协同作用,这也为HBV药物研发提供了新的研究方向[26]。
3.2.4异噻呋啶(isothiafludine) 此类化合物NZ-4(Fig 6)是中科院上海药物研究所基于天然产物leucamide A获得的一类双杂环串联衍生物。在HepG2.2.15细胞中的实验结果显示,NZ-4可以通过干扰衣壳组装进程中pgRNA和衣壳蛋白的相互作用形成空衣壳,对HBV复制起到抑制作用。进一步研究发现,NZ-4的抑制作用并不依赖于HBV Pol/pgRNA复合体,而是依赖于带正电氨基酸的CTD精氨酸富集域I(ARD I)。此外,NZ-4也可以抑制DHBV DNA的复制[27]。NZ-4的这些特性使它和其他的CpAMs不同,目前也已经完成临床I期评估,相关数据尚未公布。
3.2.5苯甲酰胺类(benzamide derivatives, BA) 最近的报道发现,BA类药物BA-26019和BA-38017具有很好的抗HBV活性(Fig 6),EC50分别达到了0.58、0.16 μmol·L-1。对3TC、ADV和ETV耐药株同样发挥较好的抗病毒作用。分子对接研究和结构模拟结果显示,BA类化合物也是通过结合在蛋白二聚体接口处的HAP疏水口袋来发挥调节作用的,进而改变pgRNA的衣壳化进程,诱导空衣壳形成。研究还发现,BA类化合物调控pgRNA衣壳化的过程中,与HBc CTD的精氨酸富集域无关[28]。
3.2.6ABI-H073 ABI-H0731是由Assembly Biosciences公司研发的一类衣壳组装调节剂(Fig 6),目前已推向临床Ⅱ期,但结构尚未公布。ABI-H0731可以阻断pgRNA的包装以及病毒DNA的合成。其在HepG2.2.15细胞和人原代肝细胞中的EC50分别为0.37 μmol·L-1和0.15 μmol·L-1。目前的临床研究主要是评估ABI-H0731与现有的标准核苷类药物联合用药的效果[18]。
Ⅰ类和Ⅱ类HBV衣壳装配调节剂作用机制总结见Fig 7。

Fig 7 Mechanisms of type I and type II CpAMs
3.3 其他类衣壳蛋白装配调节剂
3.3.1BIS-ANS(5,5’-BIS[8-(phenylamino)-1-naphthalenesulfonate]) 荧光染料BIS-ANS是第一类被定义为可以诱导衣壳错误组装的小分子(Fig 8)。平衡透析的结果显示,BIS-ANS可以和衣壳蛋白二聚体结合,并且这种结合导致衣壳生成量减少。动力学研究和电镜结果均显示,BIS-ANS是通过与二聚体相互作用,形成了非衣壳结构的聚合物[29]。这种小分子可以干预正常衣壳的几何结构,也可以导致衣壳形成过程中的错误装配,提示对衣壳蛋白装配类药物研发的一个切入点。
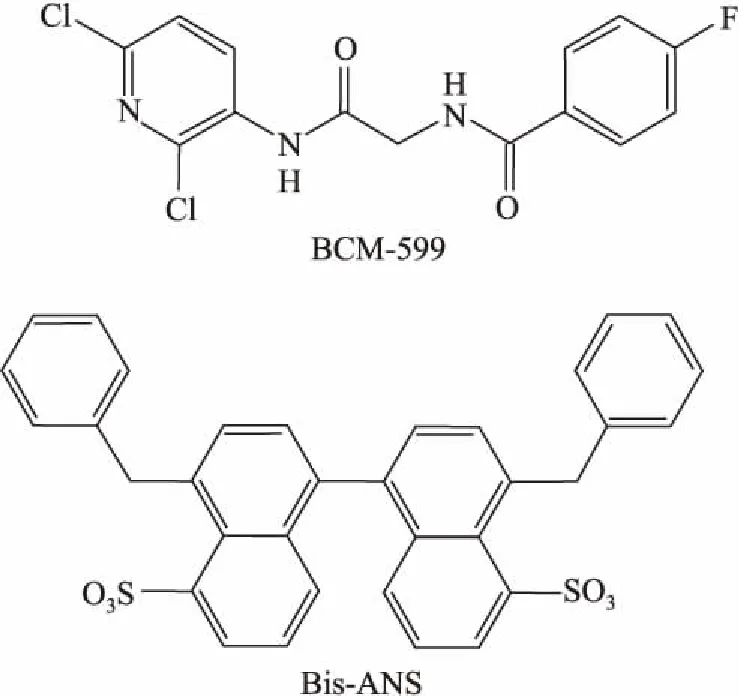
Fig 8 Chemical structure of other categories of CpAMs
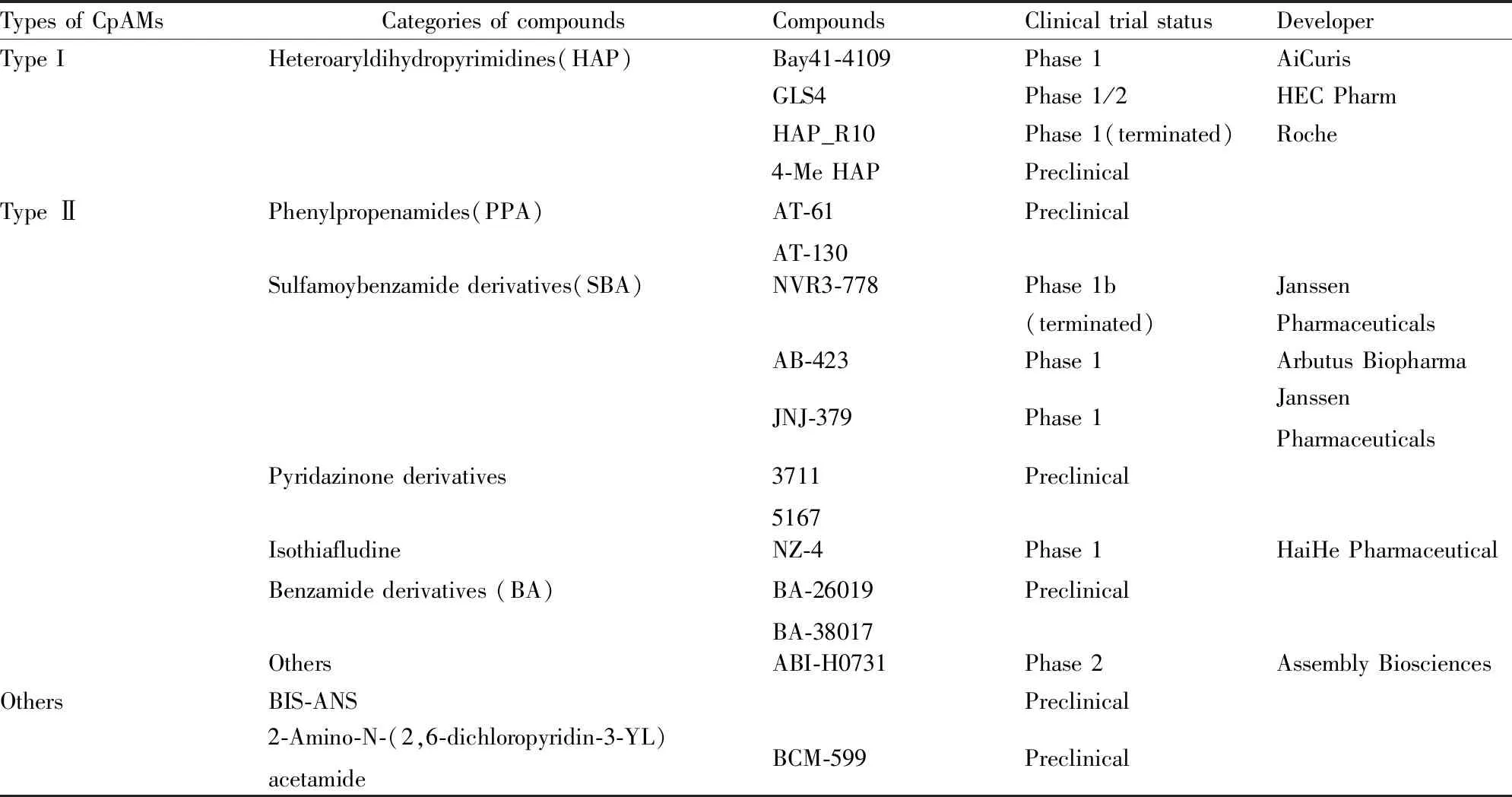
Tab 1 HBV capsid protein assembly modulators
3.3.22-Amino-N-(2,6-dichloropyridin-3-YL) Acetamide衍生物 在对HBV衣壳的结构进行研究时发现,结构中有由21-35、101-120和136-140的氨基围成的凹槽,而二聚体和六聚体的凹槽有明显的区别。通过计算结合二聚体凹槽和六聚体凹槽的结合力以及ADMET因子预测,对化合物进行筛选,发现了BCM-599是对两种凹槽都有很好结合力的化合物[30](Fig 8)。该化合物可以明显降低衣壳的含量。进一步的研究发现,BCM-599可以抑制衣壳的组装,使其处于中间体游离的非装配状态。在细胞水平上,BCM-599和3TC联合用药可以发挥协同作用。
综上,这些已被报道的衣壳装配调节剂具体信息见Tab 1。
4 小结
乙肝一直是全球性的健康热点问题。目前,乙肝的治疗药物主要是干扰素和核苷类似物两大类。但是,这两类药物仍然不能完全根除HBV,存在停药反跳、耐药突变等问题。因此,新类型的抗乙肝药物研发刻不容缓。衣壳组装调节剂作为一种新型的抗乙肝药物,目前仍处于临床试验阶段。但是,其作用在pgRNA衣壳化的步骤,抑制成熟的病毒颗粒的形成。此外,对生命周期的早期步骤也有影响,可以抑制cccDNA的形成,与核苷类药物联合用药可以发挥很好的治疗效果。衣壳组装调节剂的这些优点,使它不同于传统的HBV类药物,而近年不断涌现出来的新类型的衣壳组装调节剂也使得这类药物具有很好的前景,为HBV类药物研发提供新途径。
