β -环糊精增敏荧光法测定氟氰戊菊酯
2019-11-05聂继云刘红弟匡立学
程 杨, 聂继云*, 刘红弟, 闫 震, 匡立学
(中国农业科学院果树研究所,农业农村部果品质量安全风险评估实验室(兴城),农业农村部果品及苗木质量监督检验测试中心(兴城),辽宁兴城 125100)
β-环糊精(β-Cyclodextrin,β-CD),它是直链淀粉在葡萄糖转移酶的作用下生成的环状低聚糖,具有外亲水内疏水的圆筒形中空结构,客体分子的疏水基团能够进入到β-CD的疏水空腔之中,可形成主-客体超分子包合物[1 - 4],避免去活碰撞,减少分子移动自由度,增加发射速度常数,保持适宜的微环境以及保护激发态不与大体积水分子和猝灭剂接触,从而引起体系荧光显著增强[5 - 7]。近年来,科研工作者已利用β-CD 增敏荧光法来测定蔬菜和水果中农药残留[8 - 9]。氟氰戊菊酯(Flucythrinate)是一种非三元环结构含氟的合成拟除虫菊酯杀虫剂,主要应用于棉花、蔬菜、果树等作物上多种害虫的防治,对叶螨有一定抑制作用。氟氰戊菊酯具有潜在的神经毒性[10],并且长期接触可能会引起内分泌紊乱等问题[11]。因此,其残留问题必然会给消费者带来潜在的危险并引起人们的高度重视。氟氰戊菊酯的测定方法多为气相色谱法[12 - 13]和气相色谱-质谱联用法[14 - 15]。但这些方法操作繁琐耗时,需要大型仪器和专业操作人员等缺点限制其应用,因此,建立一种氟氰戊菊酯残留快速准确的分析方法显得尤为迫切。
荧光分析法具有实时检测、灵敏度高、分析快速、操作简单、试样用量少等优点,使其在农药残留分析中受到国内外学者的广泛关注,并且在痕量物质的检测方面也具有很好的应用前景[16 - 17]。本文利用荧光光谱法研究了β-CD与氟氰戊菊酯的超分子相互作用,确定了包合比、包合常数,利用其自身产生的荧光信号,通过β-CD对其的增敏作用,可有效降低氟氰戊菊酯的检出限,据此建立一种直接、快速、高灵敏度测定氟氰戊菊酯含量的新方法,为β-CD作为超分子主体化合物对客体分子的荧光增敏效应提供理论基础。
1 实验部分
1.1 仪器与试剂
F-4600型荧光光谱仪(日本,日立公司);雷磁pHS-3E型数显式pH计(上海仪电科学仪器有限公司);VT6060M真空干燥箱(美国,赛默飞世尔科技公司)。
β-环糊精(β-CD)(分析纯,国药集团化学试剂有限公司);氟氰戊菊酯标准品(农业农村部环境保护科研监测所),二次重结晶,真空干燥后备用;其它试剂均为分析纯。所有实验用水均为高纯水。
1.2 溶液的配制
氟氰戊菊酯标准溶液:准确移取1 mL 100 μg/mL氟氰戊菊酯标准品溶液,用95%乙醇稀释100 mL,然后再稀释成0.1 μg/mL的标准工作溶液。β-CD溶液:准确称取2.8375 gβ-CD,用高纯水配制成浓度为1.0×10-2mol/L贮备溶液。B-R缓冲溶液:取0.272 mL 85%H3PO4,0.464 mL 36%冰HAc和0.2473 g H3BO3,用高纯水配成100 mL的三酸混合液(0.04 mol/L);将配制好的三酸混合溶液与不同体积NaOH溶液(0.2 mol/L)混合,可得到不同pH的B-R缓冲溶液。
1.3 实验方法
移取1 mL 0.1 μg/mL的氟氰戊菊酯标准工作液,置于10 mL比色管中,依次加入不同体积的β-CD(1.0×10-2mol/L)的标准溶液,1 mL的B-R缓冲溶液(pH=5.02),加高纯水稀释至刻度,充分摇匀,室温下放置5 min后,在λex=251 nm,λem= 306 nm的条件下测定溶液的荧光强度。
2 结果与讨论
2.1 氟氰戊菊酯的荧光激发和发射光谱
按照实验方法,在室温下进行荧光激发光谱和发射光谱的扫描,扫描波长200~700 nm,扫描速度为2 400 nm/min。最后确定氟氰戊菊酯的λex=251 nm,λem=306 nm,仪器狭缝宽度均为2.5 nm。
2.2 pH值对氟氰戊菊酯荧光强度的影响
采用B -R缓冲溶液考察了pH=1.98~11.20范围内反应体系荧光强度的变化。由图1可以看出,β-CD包合氟氰戊菊酯的荧光强度在pH为1.98~6.09范围内较为稳定,当体系pH=5.02时,荧光强度达到最大值。本实验选择pH=5.02作为体系荧光测定的最佳pH值,B-R缓冲溶液用量为1 mL。
2.3 氟氰戊菊酯与β -CD反应时间对其荧光强度的影响
取按实验方法配制溶液8份,测定反应不同时间的后荧光强度。氟氰戊菊酯与β-CD的反应在5~40 min内,体系的荧光强度变化不大。实验选择反应时间5 min为最优实验条件。
2.4 β -CD浓度对氟氰戊菊酯荧光强度的影响
在pH=5.02条件下,固定氟氰戊菊酯的浓度,分别加入不同体积的β-CD。实验结果表明,氟氰戊菊酯的荧光强度随着β-CD浓度的增加而增强(图2),当加入1.0×10-2mol/Lβ-CD溶液体积达到4 mL时,氟氰戊菊酯荧光强度的增加趋于平缓并达到最大值,这是由于β-CD对氟氰戊菊酯的包合作用所致。本文选择1.0×10-2mol/Lβ-CD的加入量为4 mL。
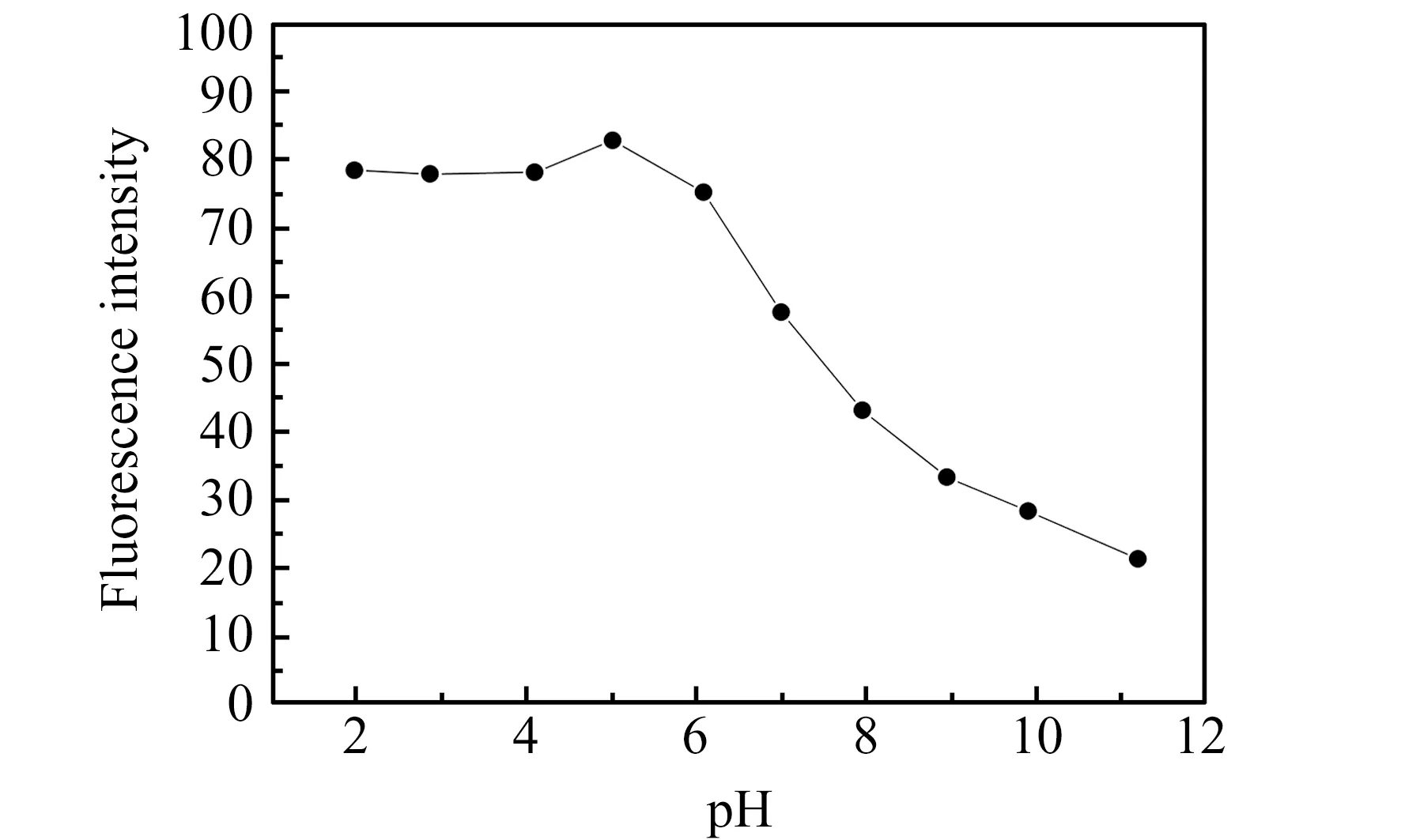
图1 溶液pH对荧光强度的影响Fig.1 The effect of pH on the fluorescence intensity
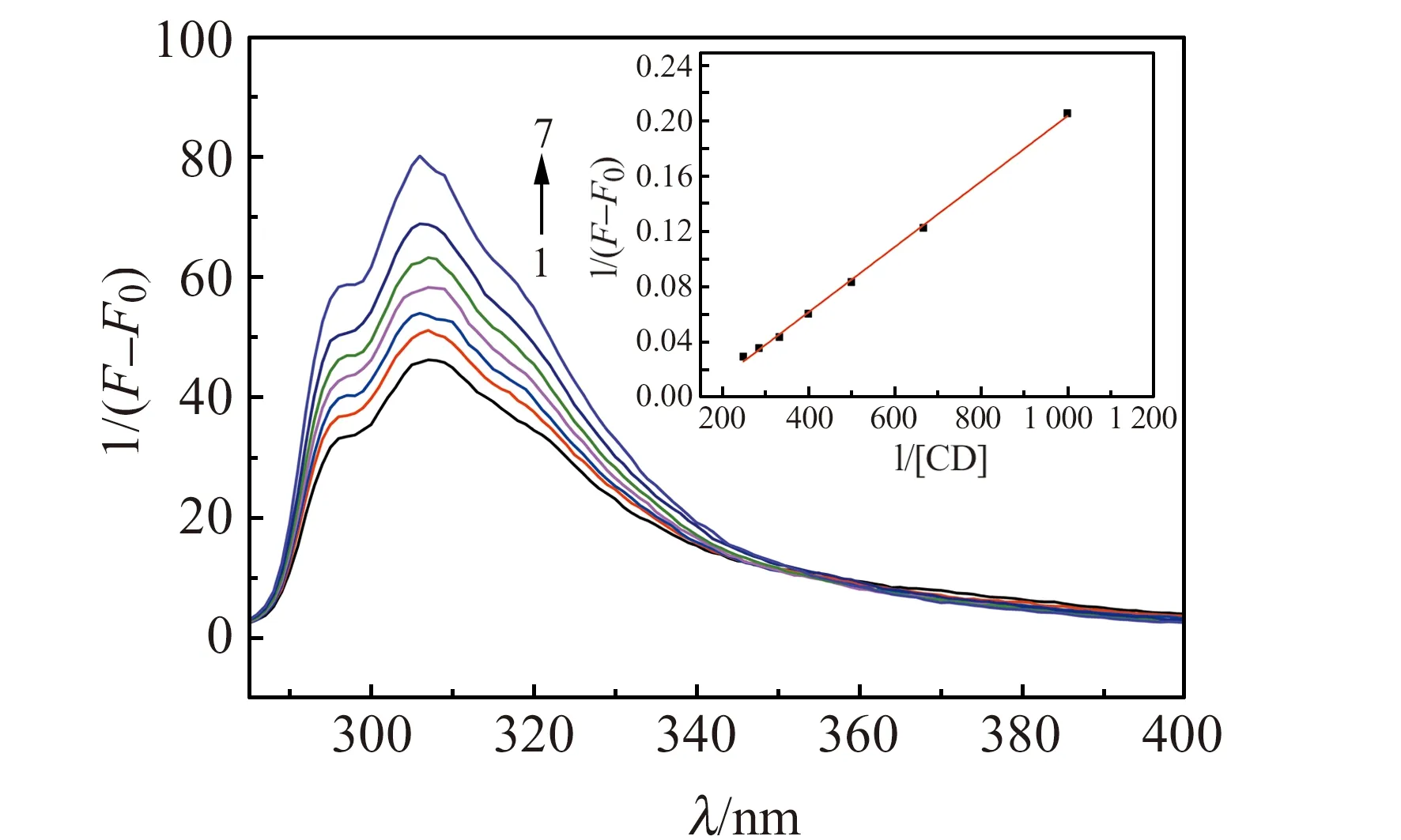
图2 β -CD的加入量对于荧光强度的影响Fig.2 The effect of the amount of β -CD on the fluorescence intensity[β -CD]:1.0×10-2 mol/L.1-7:1 mL,1.5 mL,2 mL,2.5 mL,3 mL,3.5 mL,4 mL.inset:Relationship equation curve of β -CD-flucythrinate inclusion complex.
在本实验中,我们利用Benesi-Hildebrand的双倒数法测定β-CD包合常数,根据公式[8],将所得实验数据按1/(F-F0)对1/[CD]作图,可得线性关系较好的直线:y=2.36923×10-4x+0.0351(R2=0.9985)。实验结果表明β-CD与氟氰戊菊酯之间形成了1∶1的超分子包合物。由直线的截距与斜率之比可求得(图2内插图):β-CD与氟氰戊菊酯的结合常数K=148 L/mol。

图3 β -CD与氟氰戊菊酯形成包合物的模型Fig.3 A model for the formation of inclusion complexes of β -CD and flucythrinate
由于氟氰戊菊酯的疏水基团在疏水作用、氢键力及范德华力等非共价键作用的驱动下,进入β-CD疏水空腔形成主-客体包合物,从而导致β-CD对氟氰戊菊酯具有荧光增敏作用,β-CD的空腔尺寸大小与极性对客体分子氟氰戊菊酯进行选择性识别包合。这种结构模型(图3)导致氟氰戊菊酯分子的荧光在β-CD疏水空腔中受到屏蔽和保护,减少分子的移动自由度,避免分子间的去活碰撞,体系的荧光强度增加。
2.5 干扰实验
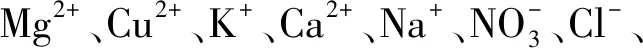
2.6 工作曲线、检出限及精密度
在实验选定的最优化条件下,改变氟氰戊菊酯的加入浓度,按照实验方法绘制标准曲线。实验结果表明,氟氰戊菊酯的浓度在1~30 ng/mL之间与其荧光强度呈现良好的线性关系(R2=0.9975),线性回归方程为:y=4.65x+36.99,计算方法检出限(3σ/k)为0.25 ng/mL。对20份浓度为0.01 μg/mL的氟氰戊菊酯标准溶液平行测定,其相对标准偏差(RSD)为1.3%。
2.7 实际样品分析
分别称取市售苹果18.95 g,梨13.28 g,分别切成小块研磨后,用50 mL 95%乙醇浸泡,过滤后转移至50 mL容量瓶中定容后作为样品溶液。按照实验方法,在2支10 mL比色管中分别加入1 mL苹果和梨样品溶液,再取另外两支10 mL比色管,分别加入1 mL苹果和梨样品溶液和1 mL浓度为0.1 μg/mL的氟氰戊菊酯标准溶液进行测定,平行测定5次(表1)。从表1结果可以看出,我们建立的基于β-CD荧光光谱法具有很好的测定值和回收率,说明此方法可以应用于水果中氟氰戊菊酯的快速检测。
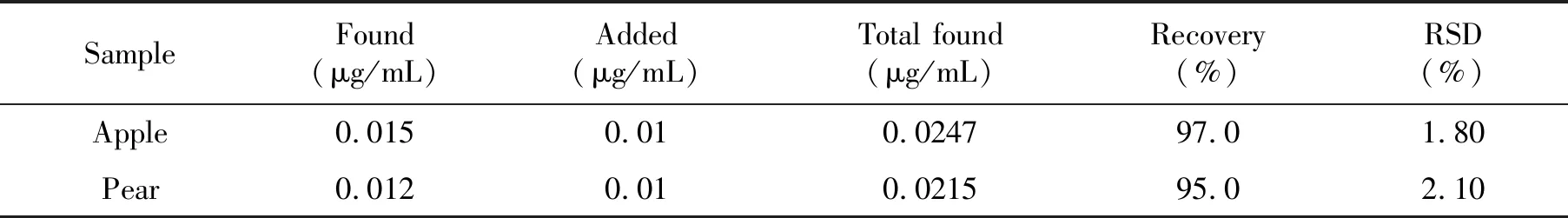
表1 水果样品分析结果(n=5)
3 结论
本文通过β-CD增敏荧光光谱法测定水果中氟氰戊菊酯的含量,该方法的线性范围为1~30 ng/mL,检出限为0.25 ng/mL,RSD为1.3%。建立的荧光检测方法,具有灵敏度高,选择性好,操作简便等优点,能够满足水果中氟氰戊菊酯的检测要求,尤其适用于小型实验室的应用研究,对水果中农药残留的检测有一定的参考价值。
