线粒体定位双光子荧光探针用于小鼠大脑炎症过程中H2O2的检测
2019-11-05翟保评郝瑞林刘志洪
翟保评, 郝瑞林, 何 军, 胡 伟, 刘志洪*
(1.忻州师范学院化学系,山西忻州 034000;2.武汉大学生物医学分析化学教育部重点实验室,化学与分子科学学院,湖北武汉 430072)
神经退行性疾病是由神经元和(或)其髓鞘的丧失所致1 - 3],并随着时间的推移而恶化,出现功能性障碍[4 - 5]。随着对神经退行性疾病研究的不断深入,人们发现越来越多的因素与神经退行性疾病的发生和发展有关[6]。然而,神经退行性疾病发病的炎症假说直到最近才提出[7 - 8]。众所周知,线粒体在神经免疫过程中产生的活性氧(ROS),可以与人体免疫系统协同作用共同抵抗病原微生物入侵,而过量的ROS是线粒体损伤并造成神经退行性疾病的主要原因[9 - 13],为此,我们希望通过原位监控神经细胞线粒体中H2O2浓度的变化,实现对神经退行性疾病的早期诊断。
荧光分析法已经成为生化分析领域的一种重要手段[14 - 16]。而双光子荧光(TPF)是分子同时吸收两个能量较低、波长更长的光子使其基态电子激发至激发态,相比于紫外线和可见光激发,双光子激发能达到更深的穿透深度,对生物样本造成更少光损伤和光漂白,避免了来自细胞和组织自体荧光的干扰[17 - 21]。近年来大量双光子H2O2荧光探针被相继报道[22 - 23],然而对线粒体中H2O2和神经免疫之间相互作用的研究还未见报道。为此,本文设计了一种基于分子内电荷转移(ICT)机理的H2O2荧光探针Mito -H2O2,如图1所示,利用萘酰亚胺衍生物作为双光子荧光团(黑色部分),引入三苯基磷结构(红色部分),增加水溶性的同时,使探针可以更好定位于线粒体内膜上。黄色硼酸酯部分为H2O2反应位点,硼酸酯能够与H2O2特异性反应产生羟基,得到Mito -green(neutral form),在生理环境下分子去质子化形成Mito -green(anion form)产生绿色荧光。水溶液实验显示,在与H2O2反应后,Mito -H2O2最大发射峰(540 nm)的相对发射强度在60 min内增加了12倍(540 nm),检出限低至412 nmol/L。细胞实验显示该探针具有很好的生物相容性,并且能够准确定位于细胞线粒体中,脂多糖(LPS)诱导探针处理过的bv-2细胞及小鼠大脑也发现很明显的荧光增强,并且对LPS具有浓度依赖关系。本研究成功构建了能够定位于线粒体中的双光子H2O2探针,并以其为平台探究了LPS诱导小鼠大脑神经免疫反应。

图1 探针Mito -H2O2的结构及其对H2O2的响应机理Fig.1 Chemical structure of Mito -H2O2 probe and the fluorescent response towards H2O2
1 实验部分
1.1 仪器及试剂
UV-2550型紫外-可见分光光度计(日本,岛津公司);RF-5301PC型荧光分光光度计(日本,岛津公司);双光子共聚焦荧光成像(CLSM,C1-Si,Nikon,日本)。
噻唑蓝(MTT)购自阿拉丁试剂公司,DMEM细胞培养基及无菌的磷酸盐缓冲溶液(PBS,pH=7.0)购自Gibco。硅胶(青岛海洋化工厂,200~300目和GF-254)。未经特殊说明,所有溶剂均为分析纯,购于国药集团;所有试剂均为分析纯,购自安耐吉化学试剂公司。实验用水为超纯水(18.2 MΩ·cm)。
1.2 探针Mito -H2O2的合成
探针Mito -H2O2的合成路线如图2所示:
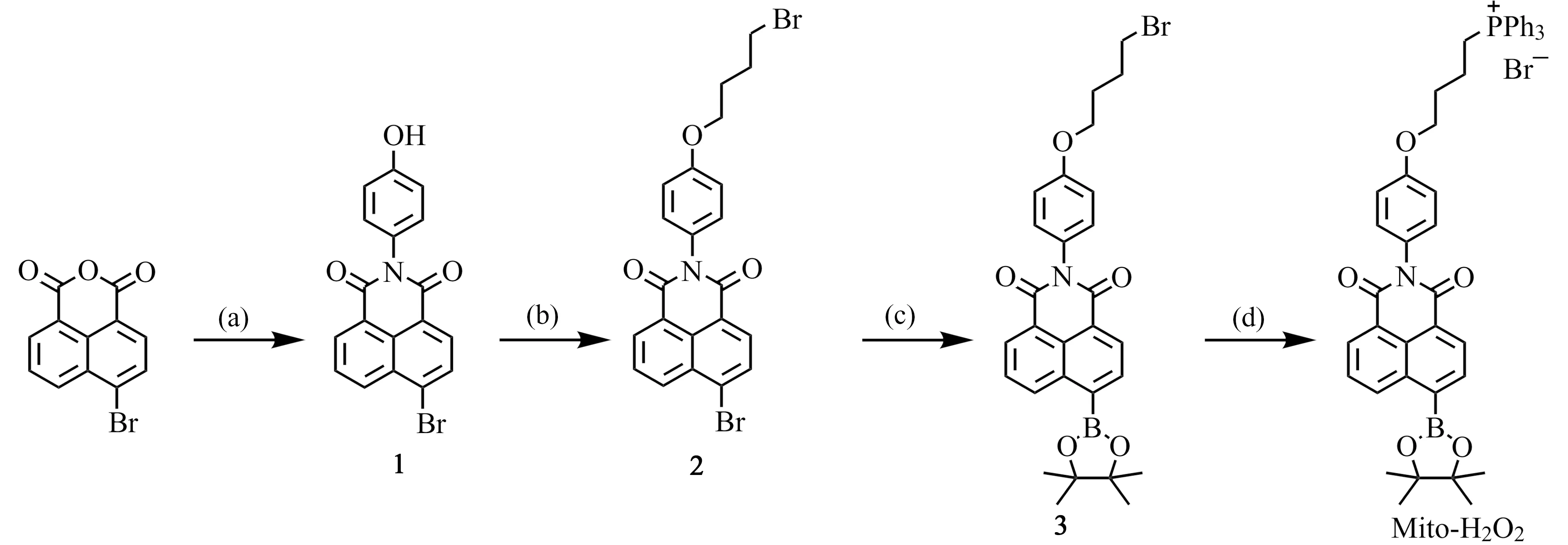
图2 探针Mito -H2O2的合成路线Fig.2 Synthesis route of probe Mito -H2O2Reagents and conditions:(a) glacial acetic acid,reflux,4 h;(b) 1,4-dibromobutane,K2CO3,DMF,80 ℃,12 h;(c) Bis(pinacolato)diboron,Pd(dppf)Cl2,CH3COOK,dry dioxane,reflux,10 h,Ar atmosphere;(d) PPh3,CH3CN,KI,reflux,24 h.
1.2.1 化合物1的合成称取3.24 g 4-溴-1,8-萘二酸酐(18 mmol)和2.4 g 4-氨基苯酚(21.6 mmol)于100 mL烧瓶中,用适量冰HAc溶解原料,剧烈搅拌,回流反应4 h,薄层色谱(TLC)检测。待反应结束后,冷却,饱和NaHCO3溶液调节pH到中性,抽滤,滤饼用乙醇洗涤3次,得到5.6 g灰白固体(产率84.9%),即化合物1。
1H NMR(400 MHz,DMSO):δ:9.70(s,1H),8.55(d,J=7.9 Hz,1H),8.26(dd,J=36.0,7.9 Hz,1H),8.00(t,J=7.9 Hz,1H),7.15(d,J=8.7 Hz,1H),6.88(d,J=8.7 Hz,1H)。
1.2.2 化合物2的合成将2.0 g化合物1(5.4 mmol)溶于10 mL无水DMF中,加入2.3 g K2CO3(16.3 mmol)以及2.3 g 1,4-二溴丁烷(10.8 mmol),于80 ℃反应12 h,TLC检测。待反应结束后,冷却,将反应液倒入水中,二氯甲烷萃取,饱和NaCl溶液洗涤3次,无水Na2SO4干燥,减压旋蒸后,柱层析分离,得白色固体2.2 g(产率81.5%),即化合物2。
1H NMR(400 MHz,DMSO):δ:8.63~8.55(m,1H),8.29(dd,J=34.9,7.9 Hz,1H),8.03(dd,J=8.4,7.4 Hz,1H),7.34~7.24(m,1H),7.12~7.02(m,1H),4.08(t,J=6.2 Hz,1H),3.65(t,J=6.6 Hz,1H),2.06~1.97(m,1H),1.92(t,J=4.6 Hz,1H)。
1.2.3 化合物3的合成称取609.6 mg联硼酸频那醇酯(2.4 mmol),1 g化合物2(2.0 mmol),10 mg二氯二三苯基膦钯,294 mg KAc(3 mmol)于茄形反应瓶中,加入磁子,用NaCl溶液塞密封瓶口。经过三抽三放使瓶中达到无水无氧状态。量取20 mL 1,4-二氧六环加入瓶中,在80 ℃反应24 h。TLC检测。待反应结束后,冷却,二氯甲烷萃取,饱和NaCl溶液洗涤3次,无水Na2SO4干燥,减压旋蒸后,柱层析分离,得白色固体532.1 mg(产率48.5%),即化合物3。
1H NMR(400 MHz,DMSO):δ:9.06(d,J=8.5 Hz,1H),8.49(dd,J=6.8,4.8 Hz,1H),8.26(d,J=7.3 Hz,1H),8.01-7.90(m,1H),7.29(d,J=8.8 Hz,1H),7.06(d,J=8.8 Hz,1H),4.09(t,J=6.2 Hz,1H),3.65(t,J=6.6 Hz,1H),2.06-1.97(m,1H),1.94-1.84(m,1H),1.43(s,6H)。
1.2.4 Mito -H2O2的合成称取200 mg化合物3(0.36 mmol)和112 mg三苯基膦(0.43 mmol)于50 mL烧瓶中,加入催化当量的KI,20 mL乙腈作溶剂,80 ℃下回流反应6 h。TLC检测。待反应结束后,冷却,减压旋干溶剂,二氯甲烷萃取,饱和NaCl溶液水洗涤3次,无水Na2SO4干燥,减压旋蒸后,柱层析分离,得白色固体123.2 mg(产率42.1%),即Mito -H2O2。
1H NMR(400 MHz,DMSO):δ:8.49(dd,J=4.9,2.3 Hz,1H),7.95-7.90(m,3H),7.82-7.78(m,6H),7.30(d,J=8.8 Hz,1H),7.02(d,J=8.8 Hz,1H),4.14(t,J=5.8 Hz,1H),3.73(t,J=6.4 Hz,1H),2.00-1.96(m,1H),1.80-1.75(m,1H),1.43(s,6H)。
1.3 细胞培养
bv-2细胞在37 ℃培养箱(5%CO2,95%空气)中培养,培养基为含有1%的青霉素、链霉素和10%胎牛血清的DMEM培养液。成像前将细胞传代至35 mm玻底培养皿中,待其增殖到理想的密度。在与药物或刺激物孵育前,细胞先使用37 ℃预热过的PBS洗一次,移去液体后再与含有药物或刺激物的新鲜培养基孵育。除特殊说明外,细胞的探针标记操作均为使用含5 μmol/L探针Mito -H2O2的培养基(DMSO体积比为0.2%)孵育60 min,成像前使用PBS洗两次,成像。双光子激发波长810 nm,荧光收集范围:500~600 nm。
1.4 探针的细胞毒性实验
采用MTT法测定探针细胞毒性。将bv-2细胞接种于96孔板中,分别孵育0、5、10、20、30 μmol/L的探针24 h。将Mito -H2O2标记bv-2细胞后孵育24 h,之后在每孔加入20 μL MTT溶液(5 mg/mL),继续以相同的条件培养4 h,随后去除100 μL上清液,并且加入150 μL DMSO溶液振摇10 min,用酶标仪测定490 nm波长处的吸光度。细胞存活率通过公式:E%=A/A0×100计算(A和A0分别代表Mito -H2O2标记组和对照组的吸光度)。
1.5 组织成像
体重大约35 g小鼠被麻醉后,在后腿部通过皮下注射200 μL的LPS。14 h后,200 μL 200 μmol/L的探针Mito -H2O2注射到LPS诱导产生炎症的部位。孵育1 h,小鼠被麻醉后获取大脑组织,并迅速冰冻切片,切片经过PBS漂洗后立即用双光子显微镜成像。在z-扫描成像中,取小鼠的大脑组织,冷冻,用切片机切成厚度为300 μm的切片,用双光子显微镜成像观察。

图3 探针Mito -H2O2与H2O2反应前(a)和后(b)的紫外-可见(UV-Vis)光谱Fig.3 UV-Vis spectra of Mito -H2O2 before(a) and after(b) reacting with H2O2
2 结果与讨论
2.1 Mito -H2O2及其与H2O2反应体系的紫外-可见光谱
图3为探针Mito -H2O2(10 μmol/L)与500 μmol/L的H2O2反应前后的紫外-可见吸收光谱曲线。由图可知,当Mito -H2O2与H2O2反应后,紫外吸收峰和摩尔吸光系数没有明显变化。
2.2 Mito -H2O2及其与H2O2反应体系的荧光光谱及理论计算
图4为单光子激发(A)和双光子激发(B)模式下,10 μmol/L Mito -H2O2与500 μmol/L H2O2反应前后的荧光发射光谱曲线。探针Mito -H2O2在单光子(激发光波长为430 nm)和双光子模式(激发光波长810 nm)下,均未观察到明显的荧光发射,而当探针Mito -H2O2与H2O2反应之后,其产物在530 nm处有荧光发射峰。Mito -H2O2由于ICT机理,识别域上的硼酸酯将荧光猝灭,探针分子荧光变得非常弱,背景很低。而H2O2可以将探针中硼酸酯结构转换为羟基,得到荧光团Mito -green,如图1。

图4 单光子(A)和双光子(B)模式下探针Mito -H2O2(10 μmol/L)与500 μmol/L H2O2反应前(a)和后(b)的荧光发射光谱Fig.4 Fluorescence emission spectra of one -photon(A) and two -photon(B) for Mito -H2O2(10 μmol/L) before(a) and after(b) reacting with 500 μmol/L H2O2
理论计算表明,探针分子HOMO轨道与LUMO轨道电子云分布不同,说明该过程电子禁阻跃迁,分子不发生荧光;当硼酸酯脱去之后,HOMO轨道与LUMO轨道电子云分布相同,能够发生荧光,两分子间的能级差达到3.76 eV。由于反应体系呈弱碱性,荧光团会发生去质子化使电子供体部分供电子效应会更加明显,去质子化之后的荧光团能级差降低为3.3 eV,电子转移所释放的能量降低,发射光的波长增加,即发生红移现象,实验观测中也证明了这一点。生理环境下分子发出的荧光为绿色,如图5所示。

图5 Mito -H2O2、Mito -green(neutral form)和Mito -green(anion form)的几何构象及电子轨道分布Fig.5 The geometries and distribution of frontier orbitals in Mito -H2O2,Mito -green(neutral form) and Mito -green(anion form) at B3LYP/def2-SVP level
2.3 荧光量子产率及双光子活性吸收截面
为评估探针Mito -H2O2检测H2O2的灵敏度,以及能否用于双光子共聚焦成像,考察了Mito -H2O2及其与H2O2反应产物的量子产率及双光子活性截面。以0.1 mol/L H2SO4中的硫酸奎宁溶液为参比(η=0.55),可得探针Mito -H2O2及其与H2O2反应后的荧光团的量子产率分别为0.03和0.44;再以双光子诱导荧光法测出Mito -H2O2及其与H2O2反应后的荧光团在780~880 nm范围内的双光子吸收截面,以1 μmol/L罗丹明B的甲醇溶液作为参比,双光子活性吸收截面即为两者的乘积。如图6所示,Mito -H2O2及其与H2O2反应后的荧光团均在810 nm激发光下具有最大双光子活性截面,Mito -H2O2与H2O2反应后荧光团的双光子最大活性吸收截面为20 GM(1 GM=1.0×10-50cm4·s/photon),而Mito -H2O2探针在此处的双光子活性吸收截面小于4 GM。
2.4 反应时间对Mito -H2O2与H2O2反应体系的影响
以10 μmol/L Mito -H2O2与0 μmol/L H2O2(对照样)和500 μmol/L H2O2反应,考察不同反应时间体系的荧光强度变化,从而获取反应动力学信息。其结果表明,37 ℃下,当H2O2浓度为500 μmol/L时,反应完全所需时间为60 min。更重要的是,在不含H2O2,而其它条件相同的反应体系中,随反应进行未观察到荧光光谱变化,表明Mito -H2O2在该反应体系中具有较好的稳定性。
2.5 H2O2的测定
图7为Mito -H2O2与不同浓度H2O2反应后的荧光发射光谱,在Mito -H2O2的初始浓度为10 μmol/L条件下,随着H2O2浓度的不断增加,540 nm附近的发射峰强度逐渐上升,表明Mito -H2O2对H2O2具有较好的荧光响应。考察了荧光强度与H2O2浓度间的关系(图略),由540 nm处荧光强度的点状图可知,当H2O2浓度在0~50 μmol/L范围时,荧光强度与H2O2浓度之间有很好的线性关系,其相关系数R2为0.97,k=11.74,计算出该方法的检出限(3σ/k)为0.41 μmol/L。

图6 探针Mito -H2O2与H2O2反应前(a)和后(b)的双光子活性吸收截面Fig.6 Two -photon active cross section of Mito -H2O2 before(a) and after(b) reacting with H2O2
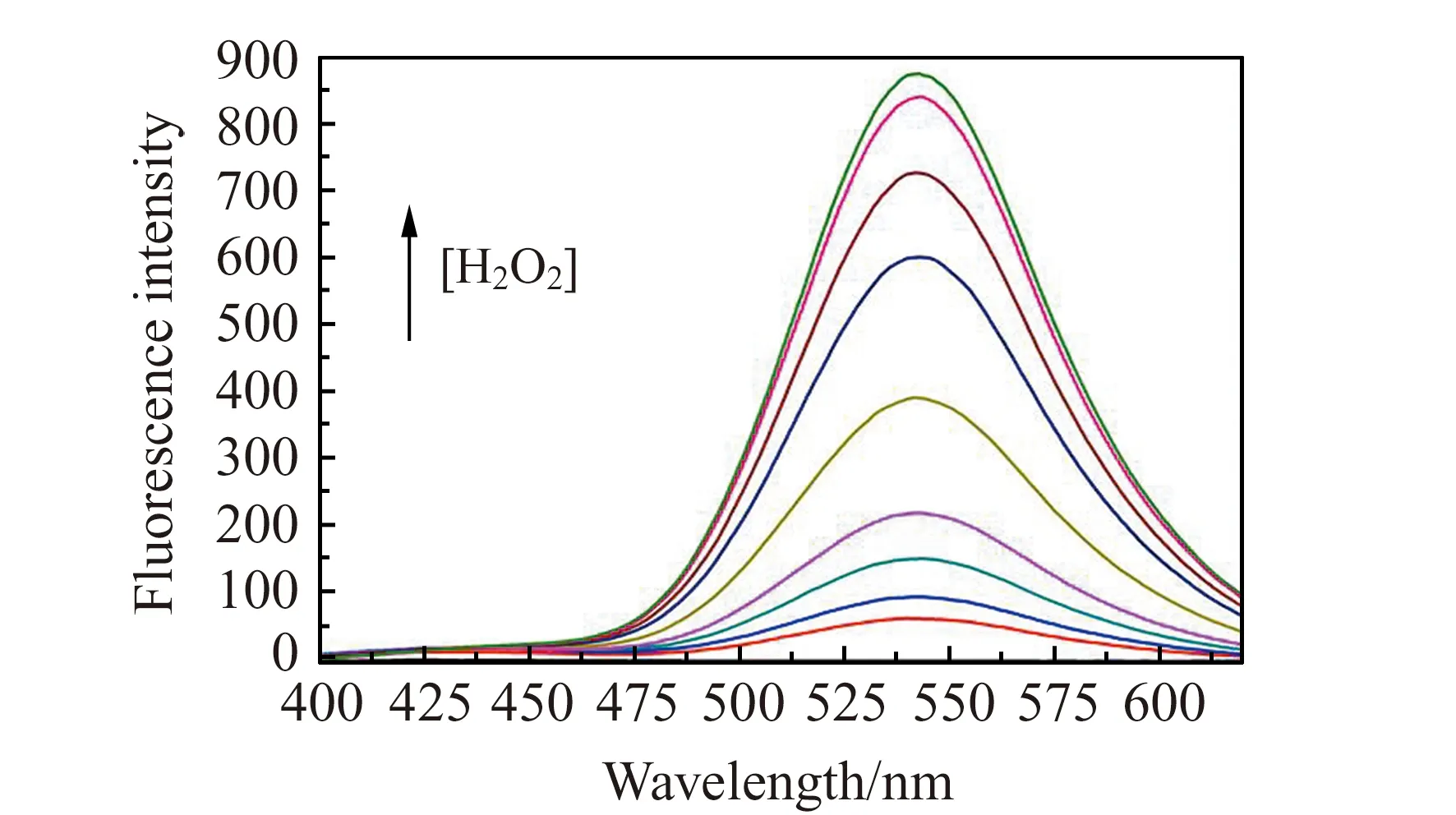
图7 探针Mito -H2O2与不同浓度H2O2反应后的荧光发射光谱Fig.7 Fluorescence emission spectra of Mito -H2O2(10 μmol/L) after reacting with H2O2 at different concentrations [H2O2]:0,1,5,10,20,50,80,100,300,500 μmol/L.

图8 pH对Mito -H2O2与500 μmol/L H2O2反应前后荧光强度(λex/λem=430/540 nm)的影响Fig.8 Effects of pH on the fluorescence intensity(λex/em=430/540 nm) of Mito -H2O2(10 μmol/L) before and after reacting with 500 μmol/L H2O2
2.6 pH值对探针Mito -H2O2荧光响应的影响
考察了Mito -H2O2(10 μmol/L)与H2O2(500 μmol/L)反应前、后的荧光强度随溶液pH值的变化情况。如图8所示,在pH=5.0~8.2范围内,Mito -H2O2几乎无荧光响应,且其荧光特性不受pH值影响,随溶液pH值逐渐增大,探针Mito -H2O2和H2O2反应体系在540 nm处的荧光发射峰强度逐渐增加。这是由于pH对该反应影响较大,但在近生理pH值7.4附近,可获得较强荧光响应信号。
2.7 探针Mito -H2O2的选择性
2.8 探针的细胞毒性
为了考察了探针Mito-H2O2是否适合用于细胞成像,实验检测了其细胞毒性。如图10所示,使用MTT法测试探针对bv-2细胞的毒性,20 μmol/L探针经过24 h孵育后,细胞仍保80%以上的存活率。由此看出,探针在浓度小于20 μmol/L时对细胞毒性很小,适用于生物样品的成像。

图9 探针Mito -H2O2对不同物质的荧光响应Fig.9 Fluorescence responses of Mito -H2O2(10 μmol/L) towards different interference compounds:(1) control;(2) KF;(3)H2S;(4) H2Sn;(5) Cys;(6) GSH;(7) Hcy;(8) HNO2;(9) BSA;(10) Gly;(11) vitamin C;(12) Lys;(13) Gly;(14) Glu;(15) HClO;(16) NO;(18) 1O2;(19) OH-;(20) ONOO-;(21) H2O2.

图10 MTT细胞毒性实验Fig.10 Cell survival rate of control groups (without Mito -H2O2) and experimental groups
2.9 探针在bv-2细胞中成像
考察了探针Mito -H2O2对LPS处理过的bv-2细胞中H2O2的检测。首先我们考察了探针分子亚细胞器定位情况,如图11所示:将5 μmol/L Mito -H2O2探针,100 μmol/L的H2O2溶液,以及Mitotracker Red FM(MTR,100 nmol/L)加入bv-2细胞培养基,孵育60 min,PBS洗去多余的探针后,在波长430 nm以及640 nm激发光源下,分别对探针和线粒体商业染料进行单光子共聚焦荧光成像。收集绿光波段(500~600 nm)以及红光波段(650~700 nm)的荧光信号。软件Image-Pro Plus 6.0进行处理。如图11所示,发现探针有很好的线粒体定位能力,共定位系数达到0.93。

图11 线粒体共定位实验Fig.11 Mitochondrial specificity of Mito -H2O2.Fluorescent images of bv-2 cells contained with(A) Mitotracker Red FM(MTR,100 nmol/L) and(B) Mito -H2O2(5 μmol/L) with H2O2(100 μmol/L) in culture medium for 40 min.(C) Merged image of (A) and(B).Excitation wavelength 430 nm for Mito -H2O2 and 640 nm for MTR.(D)The correlation of Mitotracker Red and Mito-H2O2 intensities scale bar:20 μm.
对外源性H2O2进行了共聚焦成像。将5 μmol/L Mito -H2O2,100 μmol/L H2O2和10 mmol/L NAC加入bv-2细胞培养基,孵育60 min,PBS洗去多余的探针后,在810 nm激发光源下进行双光子共聚焦荧光成像。收集绿光波段(500~600 nm)的荧光信号。软件Image-Pro Plus 6.0进行处理。如图12 所示,发现探针能够对外源性H2O2进行成像,荧光强度随H2O2浓度的增加而增加,加入H2O2的清除剂NAC发现荧光有很明显的减弱。

图12 (A)外源性过氧化氢双光子bv-2细胞成像图:5 μmol/L Mito -H2O2分别与0,10,50,100 μmol/L H2O2 (a-d)以及与100 μmol/L H2O2和10 mmol/L NAC(e)反应,激发(810 nm)收集500~600 nm通道;(B)荧光柱状图(n=3)Fig.12 (A)TPM images of bv-2 cells labeled with 5 μmol/L Mito -H2O2 and 0,10,50,100 μmol/L H2O2 (a-d) and labeled with 5 μmol/L Mito -H2O2,100 μmol/L H2O2 and 10 mmol/L NAC (e) for 40 min at 37 ℃.Images were obtained with 810 nm excitation,and the emissions were collected in the range of 500 - 600 nm(green channel);(B) The fluorescence intensity and the intensity bar was processed by Image-Pro Plus 6.0.cells shown are replicate images from replicate experiments(n=3) Scale bar:50 μm.
实验对LPS诱导bv-2细胞产生H2O2进行了共聚焦成像。将5 μmol/L Mito -H2O2与2 μg/mL LPS,以及5 μmol/L Mito -H2O2、2 μg/mL LPS和2 μg/mL NS -398加入bv-2细胞培养基,孵育60 min,PBS洗去多余的探针后,在810 nm激发光源下进行双光子共聚焦荧光成像。收集绿光波段(500~600 nm)的荧光信号。软件Image-Pro Plus 6.0进行处理。如图13所示,发现探针能够对LPS诱导细胞H2O2进行成像,当细胞内加入LPS后,荧光强度有很明显增强,加入COX-2抑制剂NS -398发现荧光有很明显的减弱。
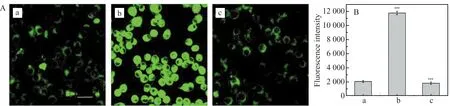
图13 (A)LPS诱导bv-2过氧化氢双光子成像图:5 μmol/L Mito -H2O2孵育细胞(a),5 μmol/L Mito -H2O2和2 μg/mL LPS孵育细胞(b),5 μmol/L Mito -H2O2,2 μg/mL LPS以及2 μg/mL NS -398孵育细胞(c),激发(810 nm)收集500~600 nm通道;(B)荧光柱状图(n=3)Fig.13 (A)TPM images of bv-2 cells labeled with 5 μmol/L Mito -H2O2 (a),5 μmol/L Mito -H2O2 and 2 μg/mL LPS (b),and 5 μmol/L Mito -H2O2,2 μg/mL LPS and 2 μg/mL NS -398 (c) for 40 min at 37 ℃.Images were obtained with 810 nm excitation,and the emissions were collected in the range of 500 - 600 nm(green channel);(B)The fluorescence intensity and the intensity bar was processed by Image-Pro Plus 6.0.cells shown are replicate images from replicate experiments(n=3) scale bar:50 μm.
2.10 探针在小鼠大脑中成像
实验最后对LPS诱导小鼠大脑组织产生H2O2进行了共聚焦成像。将200 μL 200 μmol/L Mito -H2O2与1、2、4 mg/mL LPS,以及200 μL 200 μmol/L Mito -H2O2与4 mg/mL LPS和4 mg/mL NS -398通过后腿部皮下注射入小鼠体内,14 h之后取小鼠大脑组织,冷冻,用切片机切成厚度为300 μm的切片,随后在810 nm激发光源下进行双光子共聚焦荧光成像。收集绿光波段(500~600 nm)的荧光信号。软件Image-Pro Plus 6.0进行处理。如图14所示,发现探针能够对LPS诱导小鼠大脑组织H2O2进行成像,且荧光强度随着LPS浓度的增加有很明显增强,加入COX-2的抑制剂NS -398发现荧光有很明显的减弱。

图14 (A)LPS诱导小鼠大脑组织过氧化氢双光子成像图:200 μL 200 μmol/L Mito -H2O2分别与0,1,2,4 mg/mL LPS(a-d)以及4 mg/mL LPS and 4 mg/mL NS -398(e)反应14 h,激发(810 nm)收集500~600 nm通道;(B)荧光柱状图(n=3)Fig.14 (A)TPM images of brain tissue labeled with 200 μL 200 μmol/L Mito -H2O2 and 0,1,2,4 mg/mL LPS (a-d) and labeled with 200 μL 200 μmol/L Mito -H2O2,4 mg/mL LPS and 4 mg/mL NS -398(e) for 14 h.TP imaging depth for(a-e) was 100 mm.Images were obtained with 810 nm excitation,and the emissions were collected in the range of 500 - 600 nm(green channel);(B) The fluorescence intensity and the intensity bar was processed by Image-Pro Plus 6.0.tissue shown are replicate images from replicate experiments(n=3) scale bar:100 μm.
3 结论
本工作成功合成了线粒体定位双光子荧光探针Mito -H2O2,该探针与H2O2的响应理想,H2O2浓度在0~50 μmol/L范围呈现良好的线性,且探针与H2O2反应后得到的Mito -green具有很好的光物理性质,量子产率达到0.44,双光子活性截面也达到了20 GM(810 nm)。此外,探针具有很好的选择性以及相对较低的细胞毒性。共聚焦成像显示该探针能够很好地定位于细胞线粒体中,并且能够检测细胞外源性H2O2,LPS诱导细胞H2O2,以及LPS诱导小鼠大脑H2O2,发现NS -398能够通过抑制COX-2从而减弱炎症程度。我们通过在bv-2细胞以及小鼠大脑中加入NS -398均发现荧光强度有不同程度的降低,进一步论证了NS -398的抗炎作用。
