基于阳离子表面活性剂/核酸适配体的超分子组装体荧光检测Hg(Ⅱ)的研究
2019-11-05高菲,贾兰,陈松
高 菲, 贾 兰, 陈 松
(太原理工大学材料学院,山西太原 030024)
汞是在生态系统中唯一能完善循环的重金属。汞具有高迁移、不可降解及生物富集性等特性,因此微量的汞也会对生态环境造成严重的危害[1]。汞与其化合物可通过人体的皮肤、消化道或者呼吸道进入人体,对口、粘膜和牙齿都有不良影响,严重破坏人体的中枢神经系统,长时间暴露在高汞环境中甚至可以导致脑损伤及死亡[2]。汞以多种形式存在于环境中,水环境中的Hg(Ⅱ)是最常见的形式,而汞中毒一般也由Hg(Ⅱ)引起,Hg(Ⅱ)会与人体中的巯基络合形成金属蛋白,抑制酶的活性,损害人体的肝功能,从而导致肾衰竭。因此,检测生物体及水环境中微量Hg(Ⅱ)成为近年来的重要研究领域[3 - 4]。核酸适配体是一段脱氧核糖核酸(DNA)或者核糖核酸(RNA)序列,它是利用体外筛选技术(SELEX)[5]从核酸分子文库中得到的寡核苷酸片段。核酸适配体可以与目标物高选择性、高特异性结合。研究发现,Hg(Ⅱ)能够与碱基胸腺嘧啶T特异性结合,形成稳定的“T-Hg(Ⅱ)-T”发夹状结构,基于这种结构的检测体系已有报道[6 - 9]。表面活性剂中加入带相反电荷的聚电解质,在低于表面活性剂的临界胶束浓度(CMC)条件下,可通过静电作用和疏水作用形成类胶束组装体[10]。
荧光光谱法具有简便快捷、高灵敏度和高选择性、实时监测以及成本低等优点[11]。本研究利用带正电的阳离子表面活性剂十二烷基三甲基溴化铵(DTAB)与带负电的Hg(Ⅱ)核酸适配体,通过静电和疏水作用结合为组装体。当加入Hg(Ⅱ)后,Hg(Ⅱ)能够与碱基胸腺嘧啶T特异性结合,形成稳定的“T-Hg(Ⅱ)-T”发夹状结构,将会诱导其解组装。利用尼罗红在水环境与疏水腔中不同荧光强度的性质构造“荧光关”的Hg(Ⅱ) 的检测体系。图1为其检测Hg(Ⅱ)的原理示意图。

图1 DTAB/Hg(Ⅱ)核酸适配体/尼罗红组装与加入Hg(Ⅱ)后解组装示意图Fig.1 Scheme of the DTAB/Hg(Ⅱ) Aptamer/NR assembly and Hg(Ⅱ) induced disassembly
1 实验部分
1.1 主要仪器及试剂
FLUOROMAX-4荧光光谱仪(美国,HORIBA);JFM-1011透射电镜(TEM)(日本,JEOL);JK99B全自动张力仪(上海中晨数字技术设备有限公司);SB-100D超声波清洗机(宁波新芝生物科技股份有限公司);H/T16MM台式高速离心机(湖南赫西仪器装备有限公司)。
十二烷基三甲基溴化铵(DTAB)(99%,阿拉丁试剂(上海)有限公司);Hg(Ⅱ)核酸适配体(5′-TTCTTTCTTCCCTTGTTTGTT-3′)(HAP纯化,生工生物工程(上海)股份有限公司);高氯酸汞(99%+,Strem Chemicals,Inc.美国);尼罗红(NR)(≥95%,阿拉丁试剂(上海)有限公司)。实验用水由XYA2-50-H纯水机制备。
1.2 实验方法
1.2.1 DTAB临界胶束浓度的确定配制浓度为1.0×10-4mol·L-1尼罗红的丙酮溶液,同时配制浓度1.0×10-5~1.0 mol·L-1的系列DTAB溶液,各取2 mL于离心管中,分别加入20 μL的1.0×10-4mol·L-1尼罗红的丙酮溶液(尼罗红终浓度为1.0×10-6mol·L-1)。涡旋振荡混匀后,将含有尼罗红的DTAB溶液敞口超声处理30 min,静置1 h,测量荧光发射光谱。
1.2.2 Hg(Ⅱ)核酸适配体浓度的确定配制浓度为1.0×10-3~10 μmol·L-1的系列Hg(Ⅱ)核酸适配体溶液,分别加入一定量的DTAB溶液(DTAB终浓度为5.0×10-4mol·L-1),各取2 mL置于离心管中,分别加入20 μL的1.0×10-4mol·L-1尼罗红的丙酮溶液,混匀,敞口超声处理后,进行荧光光谱测量。
1.2.3 超分子组装体的表征荧光光谱在FLUOROMAX-4(HORIBA,美国)荧光光谱仪上测试。测试条件:电压750 V,固定激发波长为545 nm,测定发射波长范围为565~800 nm,狭缝宽度为10/10 nm。
透射电镜(TEM)测试在JEM-1011(JEOL,JAPAN)透射电子显微镜上进行,电流加速电压为80 kV。制样时,对样品进行负染色,用微量注射器将溶液悬滴到铜网上静置数分钟,然后用磷钨酸钠染色液浸泡数分钟,再用滤纸吸去多余的液体,待干后用于电镜观察。
表面张力是在JK99B(铂金板法)全自动张力仪(上海中晨数字技术设备有限公司)上进行测定。
2 结果与讨论
2.1 DTAB的临界胶束浓度
本实验采用荧光谱法[12]测定DTAB的CMC值。图2为发射波长为638 nm时,DTAB/尼罗红溶液体系中DTAB浓度对数的荧光光谱图,可以看出当DTAB的浓度低于某一值时,体系的荧光强度基本无变化,随着DTAB的浓度增加,体系的荧光强度逐渐增强,并产生一个拐点,在拐点处做两条切线,切线位置对应浓度即为DTAB的CMC值,用荧光法测得的CMC值为9.2 mmol·L-1。
2.2 Hg(Ⅱ)核酸适配体的最佳浓度
Hg(Ⅱ)核酸适配体是通过SELEX从核酸分子文库中得到的寡核苷酸片段。图3是发射波长在638 nm处,在DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液体系中Hg(Ⅱ)核酸适配体浓度的荧光强度。可以看出当Hg(Ⅱ)核酸适配体浓度很小时,体系荧光强度基本保持不变,这是因为Hg(Ⅱ)核酸适配体的浓度过小,不足以与DTAB形成组装体;当Hg(Ⅱ)核酸适配体浓度超过0.1 μmol·L-1时,体系的荧光强度开始增强,此时体系中带正电的表面活性剂DTAB与带负电的Hg(Ⅱ)核酸适配体通过静电与疏水作用结合,形成超分子组装体,荧光探针尼罗红进入组装体的疏水腔中,从而产生荧光强度的变化;而当Hg(Ⅱ)核酸适配体浓度大于5 μmol·L-1时,体系荧光强度增长趋于平缓,此时DTAB/Hg(Ⅱ)核酸适配体/尼罗红超分子组装体基本完全形成。为了保障后续实验中形成DTAB/Hg(Ⅱ)核酸适配体/尼罗红超分子组装体,实验选用的Hg(Ⅱ)核酸适配体浓度为5.0 μmol·L-1。组装体中DTAB浓度为5.0×10-4mol·L-1,尼罗红的浓度为1.0×10-6mol·L-1。
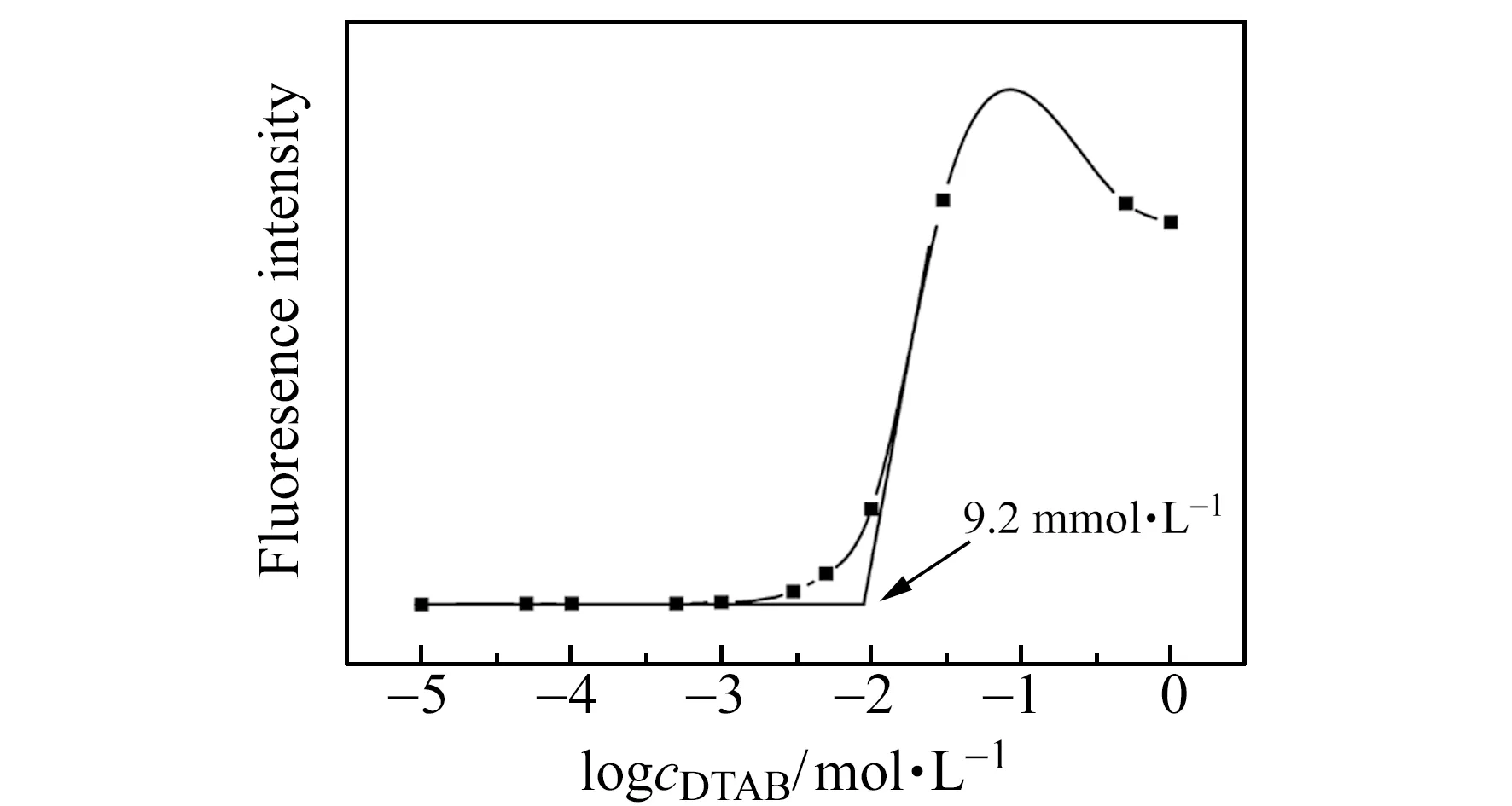
图2 DTAB/尼罗红溶液中DTAB浓度对数的荧光强度Fig.2 Fluorescence intensity of the logarithm concentration of DTAB in DTAB/NR solutions

图3 DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液体系中Hg(Ⅱ)核酸适配体浓度的荧光强度Fig.3 Fluorescence intensity of Hg(Ⅱ) aptamer concentration in the DTAB/Hg(Ⅱ) aptamer/NR solutions
2.3 超分子组装体的表征
为了观察DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液形成的组装体,以及加入Hg(Ⅱ) 后组装体解离,分别对其用透射电镜(TEM)进行表征。图4(a)为DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液的TEM;图4(b)为加入1.0×10-4mol·L-1Hg(Ⅱ)的DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液的TEM。可以看出,图4(a)中存在较为规则且分布均匀的圆形胶束,在加入Hg(Ⅱ)后(图4(b))基本不存在胶束。说明DTAB/Hg(Ⅱ)核酸适配体/尼罗红组装体已经完全解体。

图4 (a)DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液的透射电镜(TEM)图;(b)DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液中加入1.0×10-4 mol·L-1Hg(Ⅱ)的TEM图Fig.4 (a)TEM image of DTAB/Hg(Ⅱ) aptamer/NR solutions;(b)TEM image of DTAB/Hg(Ⅱ) aptamer/NR solutions with 1.0×10-4 mol·L-1 Hg(Ⅱ)
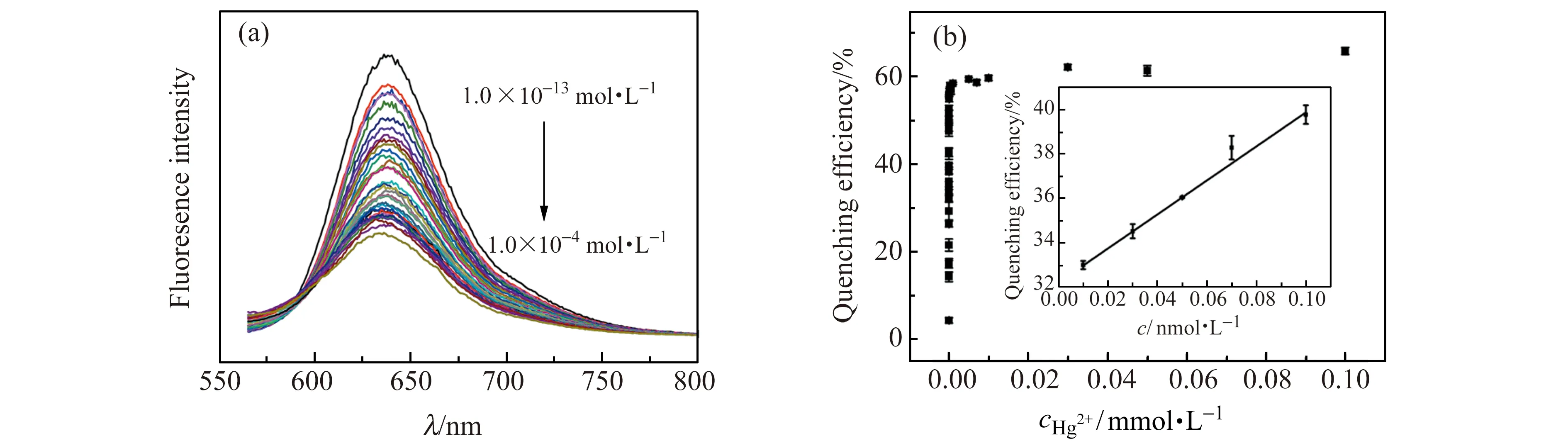
图5 (a)不同浓度Hg(Ⅱ)在DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液中的荧光光谱图;(b)荧光猝灭效率与加入Hg(Ⅱ) 浓度的关系(插图对应的是线性检测图)Fig.5 (a)Fluorescence spectra of different concentration of Hg(Ⅱ) in the DTAB/Hg(Ⅱ) aptamer/NR solutions;(b)Quenching efficiency of assemblies in the DTAB/Hg(Ⅱ) aptamer/NR solutions(The inset corresponds to the linear plots of the detection)
2.4 Hg(Ⅱ)的检出限
图5(a)为在DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液体系中,加入不同浓度Hg(Ⅱ)的荧光光谱图。随着Hg(Ⅱ)浓度的增加,体系的荧光强度逐渐变小,其荧光猝灭率((I0-I)/I0)与Hg(Ⅱ)浓度呈良好线性关系(图5(b))。这是因为Hg(Ⅱ)能够与核酸适配体中碱基胸腺嘧啶T特异性结合,形成稳定的“T-Hg(Ⅱ)-T”发夹状结构,会将Hg(Ⅱ)从组装体中解离出来,从而使组装体解组装,荧光探针尼罗红会被释放出来,从而使体系的荧光强度降低。方法的线性检测范围为1.0×10-11~1.0×10-10mol·L-1,计算可以得到Hg(Ⅱ)检出限为5.1×10-12mol·L-1。
2.5 Hg(Ⅱ)的选择性分析

图6 DTAB/Hg2+核酸适配体/尼罗红溶液中不同离子的荧光猝灭效率图Fig.6 Quenching efficiency of DTAB/Hg(Ⅱ) aptamer/NR solutions with different ions
为了验证组装体系对Hg(Ⅱ)的选择性,选取了K+、Na+、Ag+、Ni2+、Ca2+、Fe3+、Mn2+、Ba2+、Fe2+、Pb2+、Mg2+、Cu2+、Cd2+作为对照离子。图6中为加入不同离子时,对DTAB/Hg(Ⅱ)核酸适配体/尼罗红溶液在638 nm处荧光强度的猝灭效率,其中每种离子的浓度均为1.0×10-4mol·L-1。在DTAB/Hg(Ⅱ)核酸适配体/尼罗红组装体系中加入Hg(Ⅱ)时,荧光猝灭率可达60%。而加入其他离子时荧光强度仅下降或上升约2%~12%左右,与加入Hg(Ⅱ) 相比,其他离子对于检测体系的影响可忽略不计。说明该DTAB/Hg(Ⅱ)核酸适配体/尼罗红检测体系对Hg(Ⅱ)具有良好的选择性。
2.6 Hg(Ⅱ)在实际水样中的检测
为验证所构建体系实际检测能力,采用加标回收实验[3,7,9]。用自来水作为实际水样,配制DTAB/Hg(Ⅱ)核酸适配体/尼罗红的检测溶液。滴加Hg(Ⅱ)标准溶液,浓度分别为5.0×10-11mol·L-1和1.0×10-10mol·L-1,在最优实验条件下,测定各溶液的荧光强度,根据线性方程计算出Hg(Ⅱ)的含量,计算得回收率为92%~107%,且相对标准偏差(RSD)在5%以内。

表1 实际水样中Hg(Ⅱ)的检测(n=3)
3 结论
利用带正电的表面活性剂DTAB与带负电的Hg(Ⅱ)核酸适配体通过静电与疏水作用组装,包埋荧光探针尼罗红,构建DTAB/Hg(Ⅱ)核酸适配体/尼罗红的“荧光关”检测Hg(Ⅱ)的检测体系。向该检测体系添加Hg(Ⅱ)的浓度为1.0×10-4mol·L-1时,荧光猝灭率达60%。检出限为5.1×10-12mol·L-1,线性检测范围为1.0×10-11~1.0×10-10mol·L-1。检测体系对Hg(Ⅱ)具有良好的选择性,且该方法可用于自来水中Hg(Ⅱ)的检测,回收率为92%~107%。
