FeCl3蚀刻Cu的废液的再生研究
2019-11-05杨俏敖思琦于洁周婉秋田鹏康艳红
杨俏,敖思琦,于洁,周婉秋,田鹏,康艳红
(沈阳师范大学 化学化工学院,辽宁省高校重大科技平台能源与环境催化工程技术研究中心,辽宁省特种材料制备与应用技术重点实验室,辽宁 沈阳 110034)
目前国内针对三氯化铁蚀刻废液的再生循环利用方法较多,主要有沉淀法、化学氧化再生法、萃取法和电解法等[1-13]。沉淀法的能耗高、时间长;萃取法所用原料多、成分复杂。基于此提出阴极除杂-阳极氧化再生三氯化铁方法来恢复三氯化铁蚀刻液的蚀刻能力,并且目前对三氯化铁蚀刻铜的废液的再生研究很少,在生产单位对废液的处理方法一般是经过化学处理得到沉铜的化合物后,排掉废液,既浪费资源又污染环境[14]。本文通过在电解槽中对废液进行电解,从而实现三氯化铁蚀刻铜的废液的再生研究,使废液经过调整后循环使用,在减少环境污染的同时使资源得到综合利用。
1 实验部分
1.1 原料与仪器
盐酸(HCl)、氯化铜(CuCl2)均为分析纯;铜片(65 mm×100 mm)。
CHI620E电化学分析仪/工作站;7900型电感耦合等离子体质谱仪(ICP-MS);GYDF 50A/24 V高频开关电源。
1.2 实验方法
首先通过电化学工作站得到废液的电化学信息,玻碳电极为工作电极,以铂电极为对电极,饱和甘汞电极为参比电极,间距均为10 mm。以700 mL废液为阳极液,150 mL电解质溶液为阴极液,70 mm×80 mm的石墨为阴极,70 mm×70 mm的钛板为阳极,用高频开关电源对其进行电解,以确定较为合适的温度、槽压和极距。随后用ICP-MS对溶液进行测试,以确定溶液中的离子含量,从而得到再生液中的铜的去除率。FeCl3蚀刻液蚀刻Cu的过程中,在一定的时间间隔测试溶液的温度、波美度、氧化还原电位(ORP)、pH和Cu的质量,从而实现对再生液的再生蚀刻能力的研究。而后分别向三氯化铁蚀刻液中加入0,1.250,2.503,5.004,7.504 g的CuCl2,考察Cu2+含量对蚀刻速度的影响。
2 结果与讨论
2.1 电化学窗口信息分析
FeCl3蚀刻Cu的过程中发生2Fe3++Cu=Cu2++2Fe2+化学反应,当反应进行到一定程度时形成蚀刻废液,废液中主要含有Fe3+、Fe2+、Cu2+、Cl-等,将废液用循环伏安法进行电化学分析,起始电位0.45 V,负扫,循环范围-0.75~1.5 V,室温条件下获得的循环伏安曲线见图1。
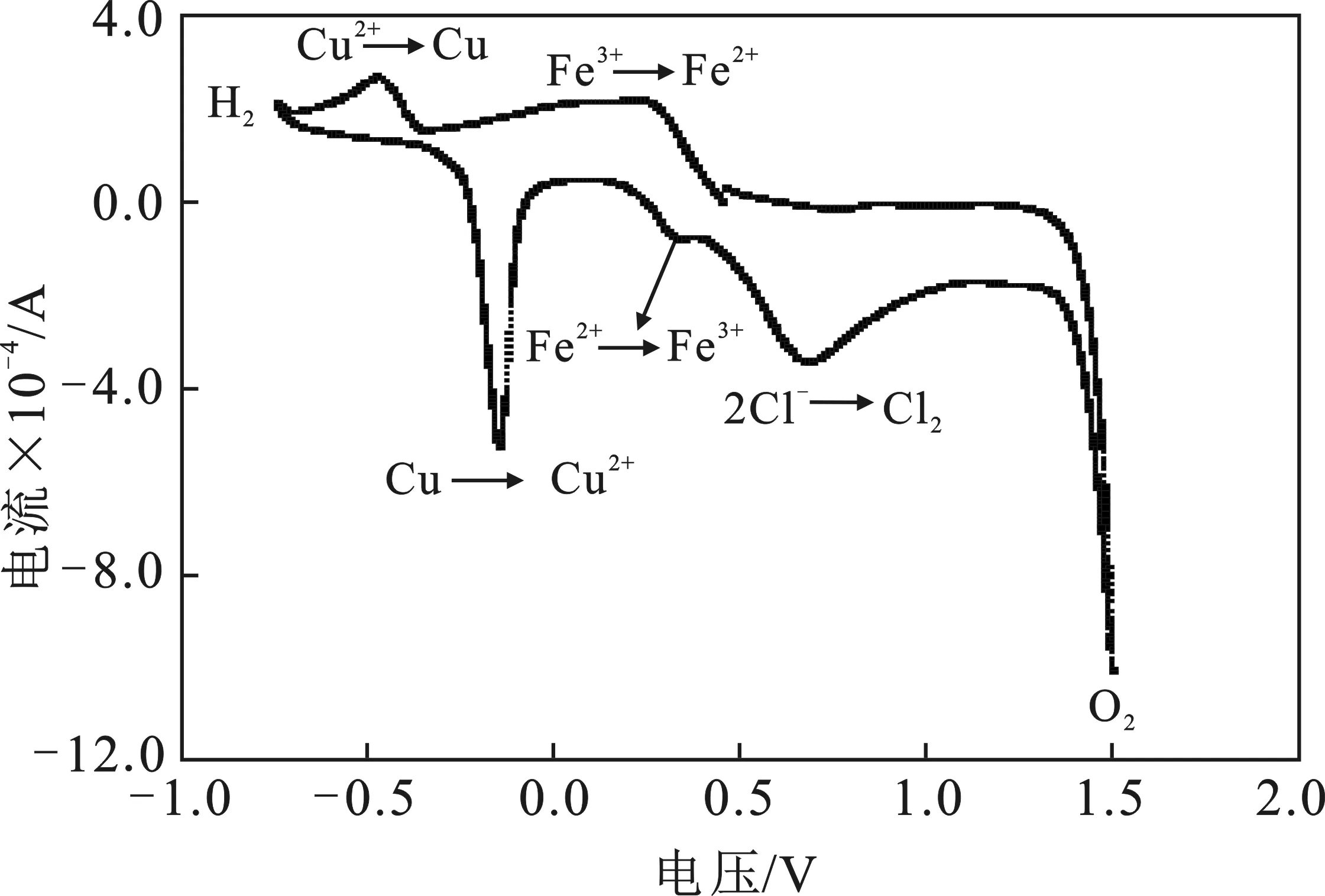
图1 蚀刻废液的循环伏安曲线Fig.1 Cyclic voltammetry curve of etching waste solution
由图1可知,还原过程依次出现Fe3+→Fe2+,Cu2+→Cu,以及2H+→H2↑,三个还原峰,起始峰电位分别为0.45,-0.35,-0.75 V。在回扫过程中,依次出现Cu→Cu2+,Fe2+→Fe3+,2Cl-→Cl2↑,2O2-→O2↑三个氧化峰,起始峰电位分别为-0.35,0.1,0.4,1.3 V。
通过电化学窗口信息分析得到阴极上Cu的还原电位低于Fe3+的还原电位,因此阴极电解过程中先达到Cu的还原电位;阳极上Fe2+的氧化电位高于Cu2+的,因此阳极电解时先达到Fe2+的氧化电位。溶液中不同的离子在不同的电位下发生电化学反应,电解过程中当阳极的电压在0.1~0.4 V时即可将Fe2+氧化为Fe3+,并且此时可以避免有Cl2的析出,从而可以实现阳极的氧化再生。当阴极电压在-0.75~-0.35 V时,溶液中的Cu2+→Cu从而析出在阴极,实现阴极的除杂。
2.2 电流对电解再生的影响
当电极发生电化学反应时,在极距、电极材料、电解液、电解液初始温度不变的情况下,观察电流随电压的变化趋势,一定时间间隔得到实验数据,见图2。
适当地调节电压,使阳极主要发生Fe2+-e-→Fe3+,而尽量避免2Cl--2e-=Cl2↑的发生,阴极主要发生Cu2+→Cu和2H++2e-=H2↑。不同离子的电化学反应存在不同的氧化或还原电位,而溶液氧化或还原的能力可以通过ORP的变化表现出来,而ORP的变化可以从ORP值上反映出来[15]。

图2 电流随电压变化趋势Fig.2 Trend of current variation with voltage
由图2可知,当电压加大,电流明显变高,但溶液的ORP值的变化不明显。ORP的上升趋势不明显,说明溶液中的Fe2+→Fe3+的数量较少,电流密度并不是越大ORP的转化效果越好。经过分析图2数据可知,8~15 V电压下电流比较明显,因此选取低电压8 V和高电压15 V来探究电压对电解的影响情况。
2.3 电压对电解再生的影响
在电极发生电化学反应时,在极距、电极材料、电解液、电解液初始温度不变的情况下,影响电化学反应的因素主要是电压。溶液中Fe2+→Fe3+的转化情况可以用ORP来表示,图3为极距80 mm,电压分别为8,15 V时的ORP变化情况,图中ORP的单位为mV。由于15 V时电解实验的电解液温度上升得很快,因此,在ORP转化到582 mV时停止实验。
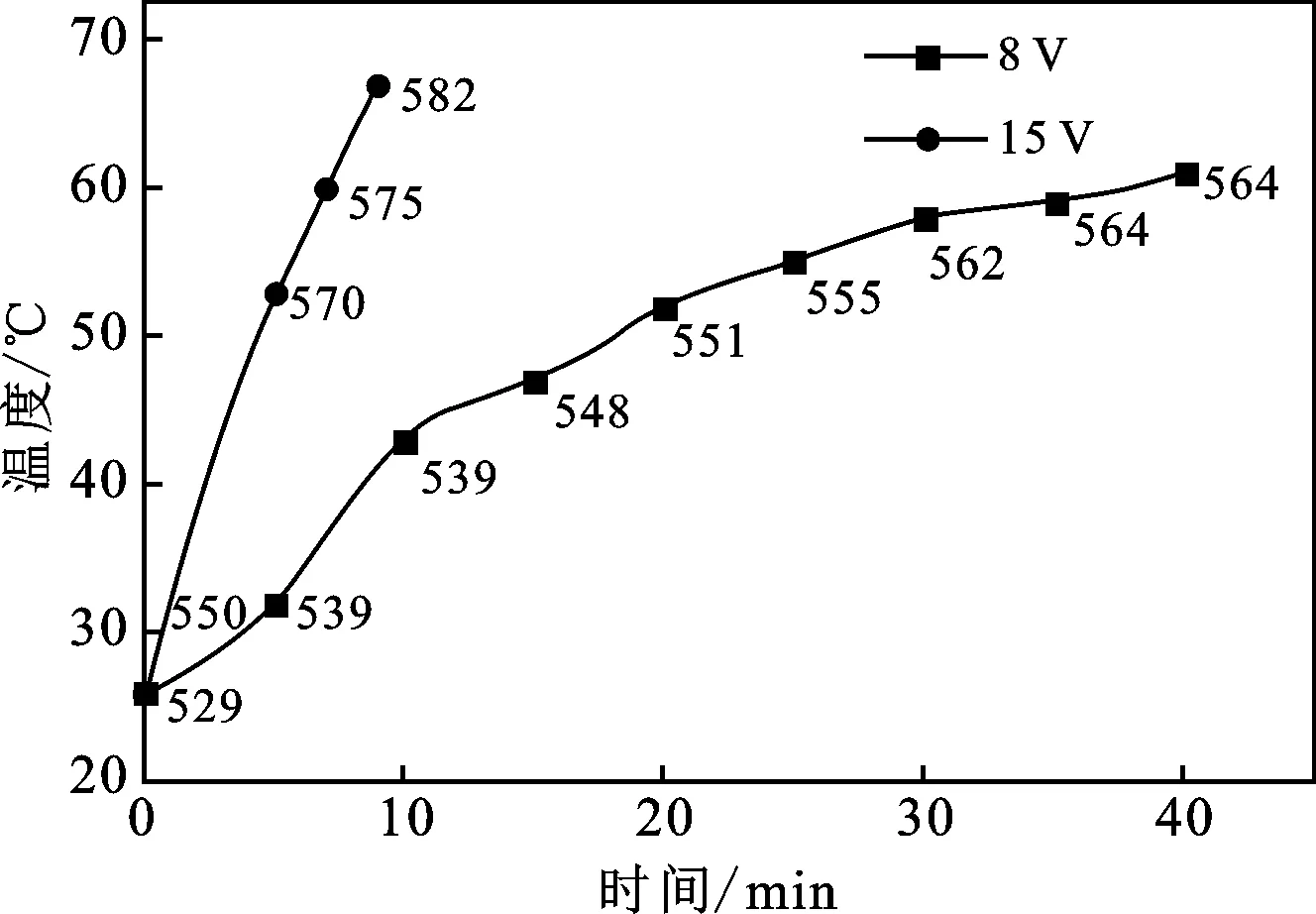
图3 不同电压对再生液的影响Fig.3 Influence of different voltages on regenerated liquid
由图3可知,随着电解的进行,氧化还原电位(ORP)逐渐增高,说明废液中的Fe2+逐渐转化成Fe3+,蚀刻能力得到恢复和再生。电压15 V的ORP值变化稍大于8 V,但在15 V电压下电解溶液温度升高的速度明显大于8 V,说明电解过程除了电极表面发生电化学反应外,溶液极板等电阻在电解时的能量损失,会使电解液温度升高。高电压没有完全做有用功,而是部分电能转化为能耗被损失。表1为不同槽压下ORP的变化值以及单位能耗。通过公式P=UI,计算单位能耗。由表1可知,15 V电压为8 V电压的1.875倍,ORP为转化目标,但是单位时间的ΔORP仅为1.27倍,能耗为3.72倍,更大的电压都作为能耗而损失,所以选择8 V的槽压。
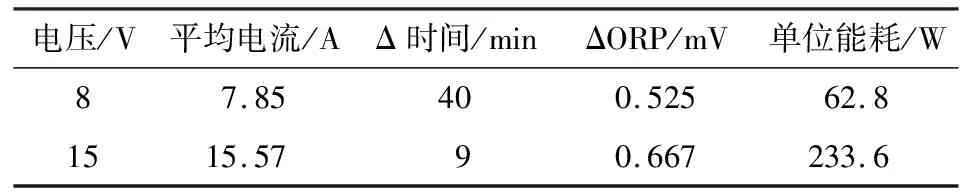
表1 不同电压对再生液的影响Table 1 Influence of different voltages on regenerated liquid
2.4 温度对电解再生的影响
当电极发生电化学反应时,在极距、电极材料、电解液、电压不变的情况下,考察温度对ORP转化的影响。为了确定较为合适的反应温度,在8 V槽压下,进行了恒温电解实验。分别对比25 ℃和35 ℃时溶液的ORP转化情况,结果见图4。
由图4可知,35 ℃的ORP上升趋势仅比25 ℃略高一点。理论上根据阿伦尼乌斯公式k=Ae-Ea/RT(k为速率常数,R为摩尔气体常量,T为热力学温度,Ea为表观活化能,A为指前因子),当温度升高时,离子运动速度加快,减小电极浓差极化,化学反应速率会加快,即Fe2+-e-→ Fe3+转化速率加快,使溶液的ORP恢复时间变短,转化趋势更大。但实际在实验过后,发现升高温度不会加快废液中的Fe2+转化成Fe3+的速度。但对于电解液而言,温度升高,增大了溶液和电极表面的电阻,使得部分电能做热功,增加了能耗。因此,当升高温度时,化学反应的速率加快的并不明显。并且在实验中发现,高温还会加快阴极电解液的挥发,需要每隔一定时间补加,因此,综合分析,25 ℃为较合适的电解温度。

图4 温度对氧化还原电位的影响(槽电压8 V)Fig.4 Influence of temperature on REDOX potential (tank voltage 8 V)
2.5 再生液蚀刻能力的研究
为探究再生液的蚀刻能力,取100 mL原液于烧杯中,将烧杯放置于搅拌器上,在转速为200 r/min时向其中蚀刻铜。此过程中一定时间间隔称量一次剩余铜片的质量,通过计算得出蚀刻速度,见图5。
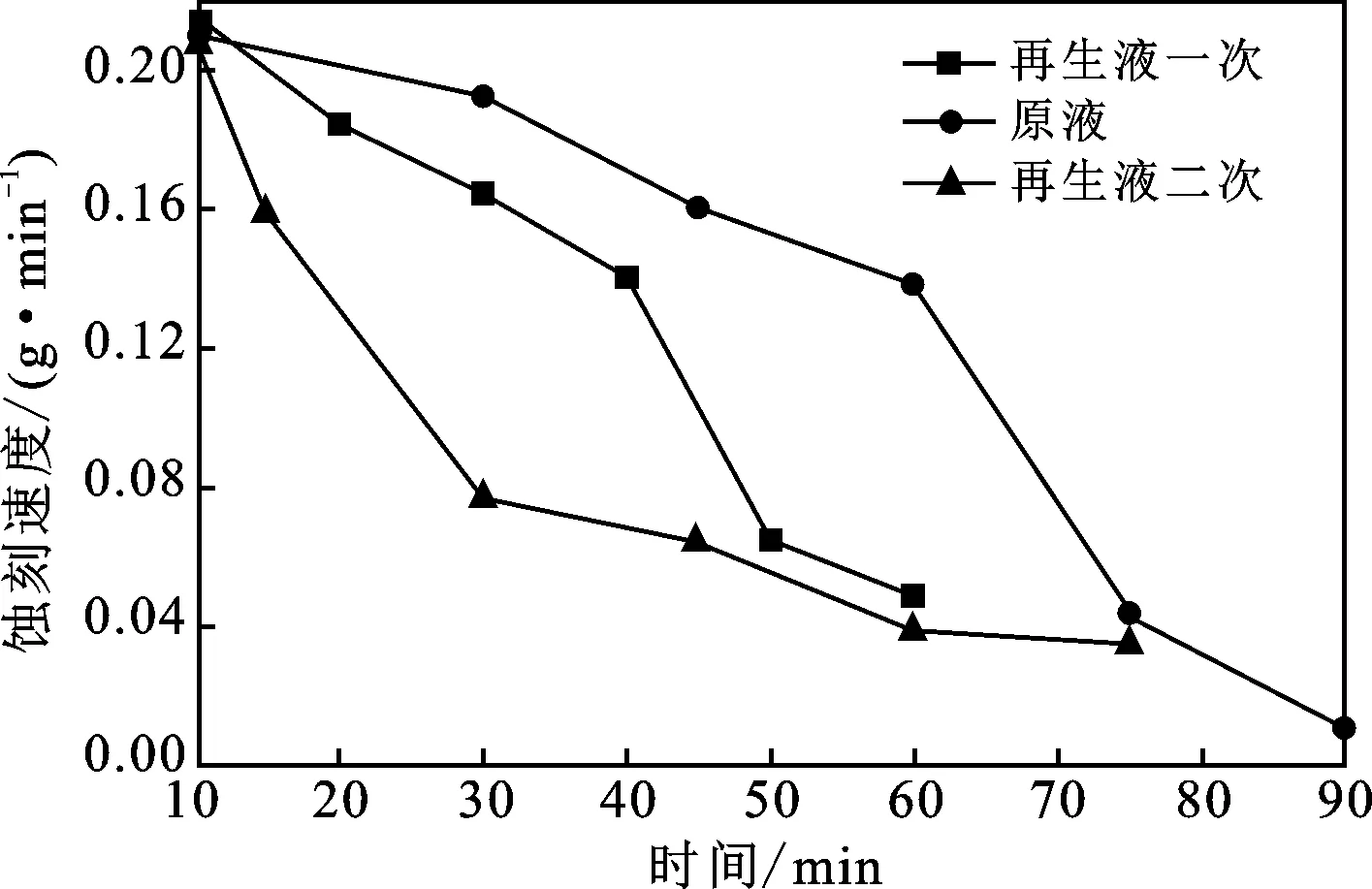
图5 再生液的蚀刻速度变化Fig.5 Etching velocity change of regenerated solution
由图5可知,原液的蚀刻能力最强,60 min以后蚀刻速度比较低,90 min蚀刻完成。随着使用次数的增加,由于溶液中的Fe3+含量减少,因此溶液的蚀刻能力会逐渐下降。虽然可以通过电解将溶液中的Fe2+→Fe3+,但是由于转化的效率有限,因此再生液一次的蚀刻能力低于原液,40 min以后开始骤降,60 min时蚀刻能力非常低,而再生液二次在30 min 后蚀刻速度变得很小。整个蚀刻过程中,原液的ORP变化了171 mV,蚀刻Cu的质量为10.037 g;再生液一次的ORP变化了203 mV,蚀刻Cu的质量为7.832 g;再生液二次的ORP变化了153 mV,蚀刻Cu的质量为6.169 g。随着循环使用次数的增加,蚀刻Cu的质量和速度都有所下降。说明在一定时间内再生液的蚀刻能力很好,可以加以利用,超过一定时间,蚀刻能力下降得比较快。
2.6 再生液蚀刻铜的去除率
取原液、废液以及废液连续再生的再生液,共6种溶液对其进行总铁和总铜含量检测,结果见图6和表2。
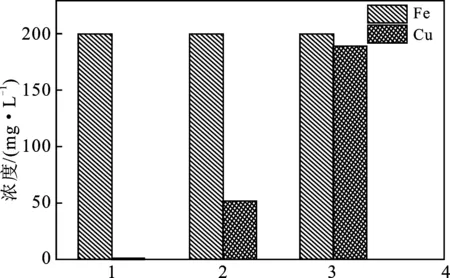
图6 再生液的浓度变化Fig.6 Changes in the concentration of regenerated liquid1.原液;2.再生液一次;3.再生液二次
由图6可知,再生后的溶液的蚀刻能力仍然很强,可以继续蚀刻Cu。由表2可知,再生一次后Cu2+的去除率为68.5%。由于在实验过程中,存在少量的溶剂挥发,因此再生液二次的Cu2+的含量略高于再生液一次加铜。而Fe2+的转化率,通过数据计算得到分别为25.6%,31.7%,23.6%,由此可知Fe2+的转化率比较低。

表2 再生液铜的去除率Table 2 Contents of copper
2.7 CuCl2对蚀刻能力的影响
由于Cu2+的去除率不理想,所以Cu2+为蚀刻的主要影响因素。为探究Cu2+对蚀刻能力的影响,分别向50 mL三氯化铁溶液中加入0,1.250,2.503,5.004,7.504 g CuCl2,待其溶解后倒入夹套烧杯中,通入冷凝水使其温度恒温为25 ℃,在转子转速为200 r/min时向溶液中蚀刻Cu。每10 min记录一次Cu的质量和溶液的ORP数值,结果见图7。
由图7可知,CuCl2的含量越多,溶液的蚀刻能力越慢。通过测试50 mL三氯化铁蚀刻液中ORP从664 mV到496 mV一共需要160 min,一共可以蚀刻进4.450 g的Cu,此时溶液中Cu2+的浓度为0.089 g/mL。对比余下4条曲线,当50 mL三氯化铁蚀刻液中加入7.504 g CuCl2后只能蚀刻进2.386 g 的Cu,并且ORP也只能降到523 mV,此时溶液中一共含有5.958 g的Cu2+,也就是此时溶液中的Cu2+的浓度为0.119 g/mL,此时溶液的蚀刻能力很低,因此Cu2+的浓度为0.119 g/mL蚀刻能力的一个临界值。

图7 CuCl2对蚀刻能力的影响Fig.7 Influence of CuCl2 on etching ability
3 结论
(1)通过一系列实验,确定了较为合适的电解工艺条件:槽压为8 V,电解温度25 ℃,以及极距为80 mm。
(2)Fe2+的再生,通过实验数据计算得到再生率分别为25.6%,31.7%,23.6%。
(3)由于Fe2+的再生率比较低,因此对再生液的蚀刻能力进行研究,得出可循环使用次数。向三氯化铁溶液中蚀刻铜,当溶液的ORP 恢复后,计算时刻质量,最终确定可循环使用次数最少为3次。
(4)通过对溶液总铁和总铜离子含量进行检测,得到再生一次后的溶液的Cu2+的去除率为68.5%。由于电化学方法Cu2+的去除率不理想,因此下一步计划使用化学方法去除Cu。
(5)通过计算蚀刻Cu的质量得到了CuCl2对蚀刻能力的影响,当Cu2+浓度为0.119 g/mL是蚀刻能力的一个临界值,浓度升高溶液的时刻能力变低。
因此实际应用中,以8 V电压25 ℃、80 mm极距可最大化的提高循环利用率,实现废液的再生利用。
