miR-34a、PD-1、PD-L1在膀胱癌中的表达及其与预后的相关性分析
2019-11-05吴金平王光亚
景 琼,吴金平,王光亚
(庆阳市人民医院 a.泌尿外科,b.血液科,甘肃 庆阳 745000)
膀胱癌是我国发病率和死亡率较高的泌尿系统恶性肿瘤,多见于男性群体,具有恶化程度高、早期确诊率较低、预后差、易出现远处转移和复发等特点[1]。目前,虽然关于膀胱癌预后相关标志物和危险因素的研究较多[2],但临床上仍以Sylvester等[3]于2006年提出的膀胱肿瘤危险因素评分表格作为预后的判断标准。该方法在群组水平预测肿瘤复发及进展的准确性较高,但对于相同群组患者仍缺乏个体化、特异性的预测指标。近年来,细胞免疫学治疗越来越被临床接受,尤其是程序性细胞死亡受体-1(programmed cell death receptor-1,PD-1)/程序性细胞死亡配体1(programmed cell death-ligand 1,PD-L1)通路与免疫逃逸机制关系的研究逐渐成为肿瘤免疫学领域的热点[4]。PD-1/PD-L1是免疫反应中极其重要的协同共刺激分子,在肿瘤免疫逃逸中发挥重要作用。因此,众多学者认为PD-1/PD-L1通路是逆转肿瘤细胞免疫逃逸和恢复抗癌免疫应答治疗的重要靶点[5-7]。与其他很多信号通路相同,PD-1/PD-L1通路也受表观遗传调控,而微RNAs(microRNAs,miRNAs)是表观遗传调控的重要分子,在很多疾病中具有早期诊断和预后评估的潜力[8]。研究发现,miR-34a在急性髓细胞白血病患者骨髓标本中呈低表达,而PD-L1呈高表达,推测两者可能具有靶向调控关系[9]。本研究主要通过检测miR-34a、PD-1、PD-L1在膀胱癌组织中的表达及其与预后的相关性,为筛选复发高危患者提供潜在的预测分子。
1 资料与方法
1.1一般资料 选取2012年7月至2014年6月庆阳市人民医院泌尿外科收治的86例膀胱癌患者的存档病理蜡块作为研究对象,患者均经病理科主任医师复检确定。其中,男59例、女27例,年龄18~82岁,平均(60.18±13.64)岁。纳入标准:①行膀胱癌切除术且切缘未见癌细胞浸润;②术前未行放疗、化疗及其他辅助治疗者;③有完整的临床病理及术后随访资料。排除标准:①行姑息性切除术者;②合并其他恶性肿瘤、心脑血管疾病、免疫系统疾病、急慢性感染者;③长期服用免疫抑制剂或免疫增强剂者。本研究经庆阳市人民医院伦理委员会批准,患者或家属均签署了知情同意书。
1.2方法
1.2.1切片制作 自庆阳市人民医院病理科调取符合上述纳入和排除标准患者的膀胱组织病理蜡块,采用冰冻切片机(德国Leica公司,CM1950型)进行组织切片(约4 μm)。
1.2.2RNA提取及实时荧光定量聚合酶链反应检测miR-34a 采用TRIzol试剂(美国Invitrogen公司,批号:15596-026)提取组织总RNA。采用SuperScript RT Kit(日本TAKARA公司,批号:RR047A)逆转录成互补DNA。利用SYBR Green PCR master Mix试剂盒(日本TAKARA公司,批号:RR420A)进行实时荧光定量聚合酶链反应。miR-34a引物序列设计如下:上游引物,5′-GCAGATCTGGGGTGATTCATCG-3′;下游引物,5′-GCATCGATGTGCATGCTTGT-3′。冰浴中配制20 μL 聚合酶链反应体系,1个循环(95 ℃预变性30 s),36个循环(95 ℃变性5 s,60 ℃退火30 s,70 ℃延伸10 s),建立聚合酶链反应产物扩增曲线和溶解曲线。以小分子U6作为内参,读取Ct值,以2-ΔΔCt表示miR-34a相对表达量。miR-34a的表达参照樊茹佳等[10]的方法进行分类,miR-34a≥中位值视为高表达,反之为低表达。
1.2.3免疫组织化学染色法检测PD-1和PD-L1 将组织切片逐步进行二甲苯脱蜡和梯度酒精水化,柠檬酸缓冲液进行组织抗原修复,冷却后滴加过氧化氢消除内源性过氧化物酶的活性;随后滴加PD-1一抗(1∶200稀释,美国Abcam公司)或PD-L1一抗(1∶50稀释,美国Abcam公司)和二抗(北京中杉金桥生物科技有限公司)。二氨基联苯胺(二氨基联苯胺试剂盒,日本Takara公司)染色,脱水,中性树胶封片。免疫组织化学结果判定参照张宋安等[11]的标准,将染色后的病理切片置于400倍视镜下,PD-1和PD-L1定位于胞膜上,随机选择10个视野,观察细胞阳性表达情况,计算出被染色阳性细胞的百分比。阳性率为0(0分),阳性率≤25%(1分),阳性率为26%~50%(2分),阳性率为51%~75%(3分),阳性率>75%(4分)。同时观察细胞染色强度:阴性(0分),弱染色(1分),中度染色(2分),强染色(3分)。染色指数=阳性细胞率×染色强度,根据总分数将切片分为1~4级:0~1分(1级),2~3分(2级),4~6分(3级),7~12分(4级)。其中,1级和2级为阴性表达,2级和3级为阳性表达。
1.3随访 建议患者术后1~3个月,每个月复查1次;4~12个月,每3个月复查1次;13~41个月,每6个月复查1次。本研究的主要研究终点为无进展生存时间,即自手术之日起至第1次出现局部复发、远处转移、死亡或随访终止的时间。

2 结 果
2.1膀胱癌组织中miR-34a、PD-1和PD-L1的表达情况 经实时荧光定量聚合酶链反应法检测,膀胱癌组织中miR-34a的表达量为1.34±0.37,中位值为1.201,其中43例患者的miR-34a<1.201为低表达,43例患者的miR-34a≥1.201为高表达。经免疫组织化学法检测,有55例(63.95%)膀胱癌患者肿瘤组织中的PD-1呈阳性表达,45例(52.33%)膀胱癌患者肿瘤组织中的PD-L1呈阳性表达。见图1和2。

1a:阴性表达;1b:阳性表达;PD-1:程序性细胞死亡受体1

2a:阴性表达;2b:阳性表达;PD-L1:程序性细胞死亡配体1
图2 PD-L1在膀胱组织的表达(S-P法,400×)
2.2miR-34a、PD-1、PD-L1在膀胱癌中的表达与临床病理特征的关系 见表1。不同年龄、肿瘤直径、病理分级的miR-34a低表达率比较差异无统计学意义(P>0.05),TNM分期T2~T3期患者miR-34a的低表达率高于Tis~T1期患者,淋巴结转移患者miR-34a的低表达率高于未转移者(P<0.01);不同年龄、肿瘤直径的PD-1阳性表达率比较差异均无统计学意义(P>0.05),TNM分期T2~T3期患者PD-1的阳性表达率高于Tis~T1期,高级别肿瘤患者PD-1的阳性表达率高于低级别肿瘤患者,出现淋巴结转移患者PD-1的阳性表达率高于未转移患者(P<0.05);不同年龄、病理分级PD-L1阳性表达率比较差异无统计学意义(P>0.05),肿瘤直径≥2 cm患者 PD-L1的阳性表达率高于肿瘤直径<2 cm患者,TNM分期T2~T3期的PD-L1阳性表达率高于Tis~T1期患者,出现淋巴结转移者PD-L1阳性表达率高于未转移者(P<0.05)。
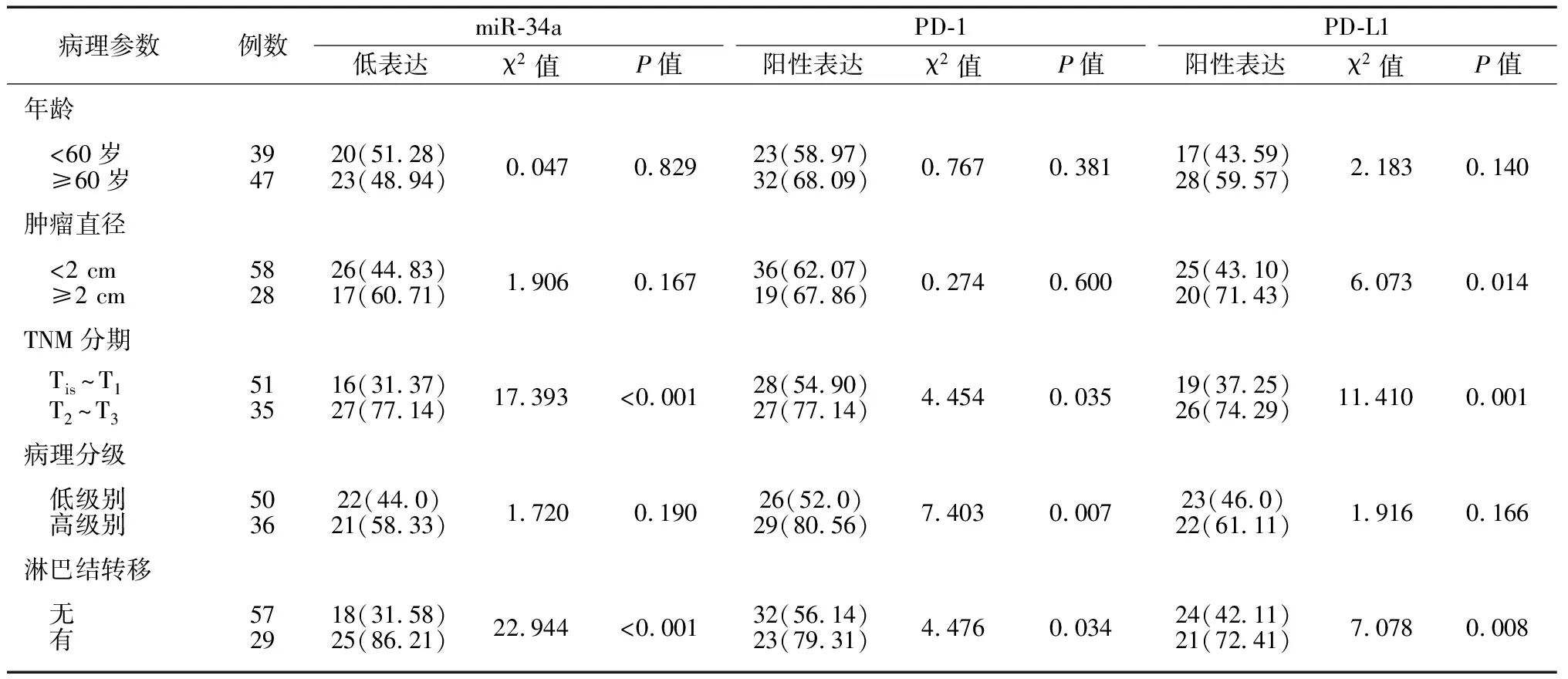
表1 miR-34a、PD-1、PD-L1在膀胱癌中的表达与临床病理特征的关系 [例(%)]
miR-34a:微RNA34a;PD-1:程序性细胞死亡受体1;PD-L1:程序性细胞死亡配体1
2.3膀胱癌组织中miR-34a的表达量与PD-1、PD-L1 的关系 经Spearman等级相关性分析,miR-34a低表达组的PD-L1阳性表达率高于miR-34a高表达组(r=-0.121,P=0.267);但miR-34a的表达与PD-1无关(r=-0.303,P=0.005)。见表2。

表2 膀胱癌组织中miR-34a的表达量与PD-1、PD-L1的关系 (例)
miR-34a:微RNA34a;PD-1:程序性细胞死亡受体1;PD-L1:程序性细胞死亡配体1
2.4miR-34a、PD-1、PD-L1在膀胱癌组织中的表达与患者预后的关系 随访截止时间为2018年10月,随访7~41个月,平均随访(32.4±7.5)个月。61例患者随访期间未出现复发或转移,无进展生存率为70.93%。其中,miR-34a低表达患者3年无进展生存率为55.81%(24/43),PD-1阳性表达患者为61.82%(34/55),PD-L1阳性表达患者为57.78%(26/45),经Log-rank法分析,不同miR-34a、PD-1、PD-L1表达患者3年无进展生存率比较差异有统计学意义(P<0.05)。见图3。
3 讨 论
虽然我国膀胱癌的发病率稍低于西方国家,但据流行病学统计数据显示,近年来膀胱癌在我国尤其是男性群体中的发病率呈逐年上升趋势[12]。膀胱癌起病隐匿,部分患者确诊时可能已经发生远处转移,且术后转移率和复发率较高也是手术失败和5年生存率较低的重要原因[13]。因此,监测术后复发、转移具有重要的临床意义。但单纯依靠肿瘤分期、病理学分级、肿瘤大小、淋巴结浸润等对膀胱癌患者预后预测的准确性有待提高[14]。
随着肿瘤免疫学研究的深入,免疫逃逸被认为是肿瘤发生的主要机制之一。组织局部微环境中的免疫细胞尤其是肿瘤抗原特异性T细胞在协同刺激分子的调控下活性降低或凋亡是造成肿瘤细胞免疫逃逸的主要机制[15]。其中,PD-1/PD-L1通路是调控肿瘤免疫逃逸的重要通路之一,其通过抑制肿瘤相关细胞因子(肿瘤坏死因子-α、γ干扰素、白细胞介素-2等)的分泌抑制肿瘤特异性T细胞的功能[16]。研究显示,PD-L1在胃癌、食管癌、宫颈癌等肿瘤细胞中表达上调,是患者预后的独立危险因素[17-18];PD-L1表达上调,与肿瘤浸润T淋巴细胞表面的PD-1受体结合,抑制调节性T细胞的活化和增殖,从而促使肿瘤免疫逃逸的发生[19]。另外,miR-34a 对PD-1/PD-L1信号通路具有重要的调控作用。Wang等[20]研究证实,与癌旁正常组织相比,脑胶质瘤组织中的miR-34a呈低表达,而PD-L1呈高表达,经荧光素酶报告基因实验证实两者具有靶向调控关系。此外,另有学者通过细胞实验发现,上调胶质瘤细胞miR-34a的表达量可靶向抑制PD-L1的表达,进而抑制脑胶质瘤细胞的增殖,促使其凋亡[21]。但目前关于膀胱癌与PD-1/PD-L1通路关系的研究尚少,本研究结果显示PD-1和PD-L1蛋白在膀胱癌组织中的阳性表达率分别为63.95%、52.33%,且与患者肿瘤直径、TNM分期及淋巴结转移密切相关,而miR-34a与肿瘤TNM分期和淋巴结转移有关,说明miR-34a和PD-1/PD-L1通路均参与膀胱癌的发生、发展和转移过程。在本研究中,miR-34a与PD-L1表达呈负相关;但与PD-1的表达量无关,与Wang等[20]的研究结果基本一致,说明miR-34a与PD-L1存在靶向调控关系,但具体作用机制需进一步研究证实。此外本研究结果显示,miR-34a低表达、PD-1或PD-L1蛋白阳性表达的患者3年无进展生存率相对较低,提示膀胱癌组织中miR-34a、PD-1、PD-L1表达水平可作为预测患者预后的分子标志物。miR-34a表达水平降低、PD-1 和(或)PD-L1表达水平升高预示患者预后较差,无进展生存率较低,对于这部分患者应给予术后辅助治疗及密切随访,这对早期发现肿瘤复发和转移、提高患者生存率具有重要意义。

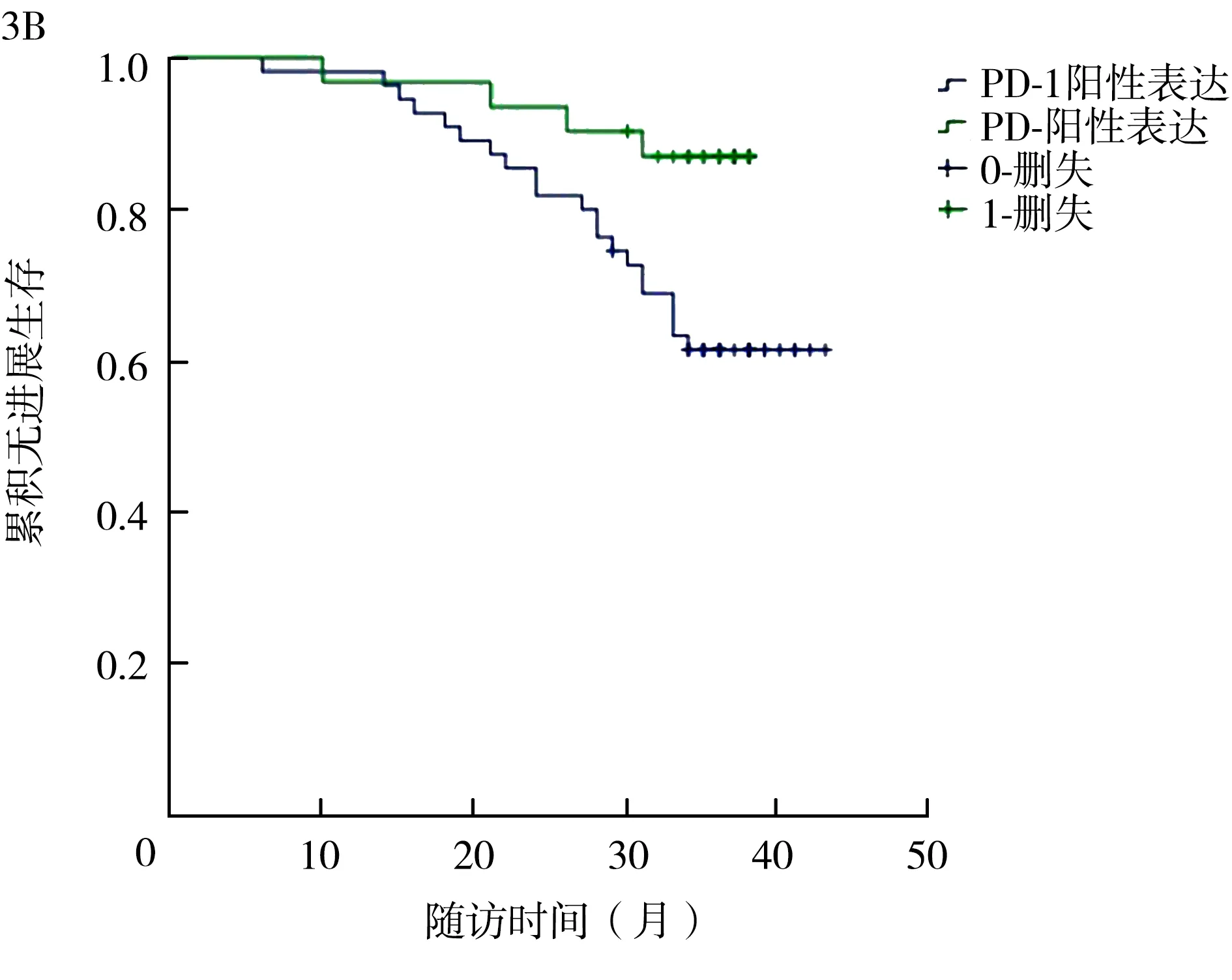

miR-34a:微RNA-34a;PD-1:程序性细胞死亡受体1;PD-L1:程序性细胞死亡配体1
图3不同miR-34a、PD-1、PD-L1表达患者的3年无进展生存曲线
综上所述,肿瘤组织中miR-34a低表达和PD-1、PD-L1蛋白高表达与膀胱癌的发生、发展、转移及预后密切相关,有望成为膀胱癌早期诊断、临床病理分期分级判断及预后评估的辅助指标,以提前筛选出复发高危人群,术后给予适当的辅助放化疗,从而有助于降低复发率、延长患者生存期。
