HPLC同时测定透明质酸发酵液中两种单糖含量的研究
2019-11-05穆淑娥陈玉娟黄思玲栾贻宏郭学平
穆淑娥,陈玉娟,黄思玲,栾贻宏,郭学平
(华熙生物科技股份有限公司,山东 济南 250101)
透明质酸(hyaluronic acid,HA),又名玻璃酸,玻尿酸,是一种酸性黏多糖,广泛存在于脊椎动物组织细胞间质中。HA由β-D-葡糖醛酸和β-D-N-乙酰氨基葡糖组成的双糖单位反复交替连接而成,分子量可达到4×106Da,通常应用其钠盐形式,即透明质酸钠[1]。HA是在1934年由美国科学家Meyer等从牛眼玻璃体中首次分离得到,因其具有良好的润滑性、保湿性和黏弹性,并具有极佳的生物相容性,现广泛应用于化妆品、食品和医药行业中。
目前HA的工业生产主要有两种方法:动物组织提取法和微生物发酵法[2]。其中微生物发酵法生产HA与传统的动物组织提取相比具有明显的优势,如成本低、原料不受限适合规模化生产、产品易于纯化、质量可控等[3-4],因此发酵法生产HA逐步取代了组织提取法。在发酵法生产HA过程中,做为底物的葡萄糖在UDP-葡糖脱氢酶和UDP-葡糖焦磷酸化酶的作用下转化为葡糖醛酸(GA)及乙酰氨基葡糖(NAG),两种单糖在透明质酸合成酶的作用下合成HA[5-6],检测发酵液中两种未转化为HA的单糖前体含量的变化,可更直观地了解发酵过程,辅助判断发酵终点。本文建立了一种高效液相色谱法(HPLC)检测HA发酵液中两种单糖前体的含量,专属性强,精密度良好,且操作简便,是一种易于推广的透明质酸钠发酵液中单糖前体含量测定方法。
1 仪器与试药
1.1 仪器
梅特勒-托利多AL104型分析天平(0.1 mg),Agilent 1260高效液相色谱仪(紫外检测器)。
1.2 试药
无水乙醇(色谱纯),磷酸二氢钠(分析纯),去离子水。葡糖醛酸标准品(中国食品药品检验研究院),N-乙酰氨基葡糖标准品(阿拉丁),透明质酸钠发酵液(华熙生物科技股份有限公司)。
2 方法与结果
2.1 色谱条件
色谱柱:Venusil HILIC(4.6 mm×250 mm,5 μm);流动相:4 mmol/L磷酸二氢钠溶液;流速:0.8 ml/min;柱温:35 ℃;进样量:20 μl。
2.2 溶液制备
2.2.1 流动相 4 mmol/L磷酸二氢钠溶液:称取0.62 g二水合磷酸二氢钠置于1000 ml量瓶,加水溶解并定容至刻度,使用前经0.45 μm滤膜过滤,超声脱气15 min。
2.2.2 标准储备液 标准储备液A:精密称取葡糖醛酸标准品50 mg至5 ml量瓶,用水溶解并定容至刻度,混合均匀;标准储备液B:精密称取乙酰氨基葡糖标准品50 mg至5 ml量瓶,用水溶解并定容至刻度,混合均匀。
2.2.3 标准溶液 精密量取标准储备液A和标准储备液B各0.2 ml至10 ml量瓶中,流动相定容至刻度,混匀,进样前经0.45 μm滤膜过滤。
2.2.4 系列标准工作液 精密量取标准储备液A及标准储备液B各0.05,0.1,0.2,0.4,0.5 ml至10 ml量瓶,流动相定容至刻度,混匀,进样前经0.45 μm滤膜过滤。
2.2.5 供试溶液 精密量取HA发酵液0.5 ml置于10 ml量瓶,加入1.5 ml纯水稀释后用无水乙醇定容至刻度,摇匀,使HA及发酵液中的其他多糖及蛋白等大分子物质充分沉淀,进样前经0.45 μm滤膜过滤。
2.3 定量方法
分别取标准溶液和供试溶液各20 μl注入液相色谱仪,记录色谱图,以外标法[7]计算供试品中两种单糖残含量(mg/ml)。
2.4 方法专属性研究
专属性测试色谱图见图1。如图所示,流动相溶剂峰出现在5.9 min,而标准溶液中的GA和NAG色谱峰分别出现于5.0 min和4.0 min。溶剂峰对两种单糖未造成干扰,且两个单糖之间的分离度5.8。满足方法学要求(分离度>2.0)。
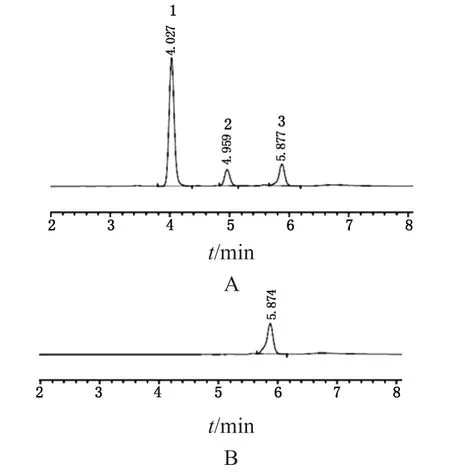
图1 专属性验证色谱图
2.5 线性和范围
按照2.2.4所述方法制备两种单糖的系列标准工作液,以峰面积为横坐标x,单糖的加入量(mg)为纵坐标y,进行线性回归得到标准回归方程。结果表明,乙酰氨基葡萄糖加入量与峰面积关系的线性回归方程为y=771.73x+0.4531,相关系数r2=1;葡萄糖醛酸线性方程为y=94.338x-0.2002,相关系数r2=1。两种单糖在0.05 ~ 0.5 mg/ml浓度范围内线性关系良好。
2.6 检出限(LOD)
当信噪比为3时,该方法对HA发酵液中NAG的最低检出浓度为2 μg/ml,对GA的最低检出浓度为20 μg/ml。
2.7 精密度测试
按照2.2.5中所述方法平行制备6份供试品溶液(同一个取样点的HA发酵液),按照既定方法检测单糖含量。结果表明,两种单糖的6个检测结果相对标准偏差分别为1.2 %和1.8 %,表明本方法精密度良好。
2.8 准确度测试
取发酵培养基做为空白供试品(即不含GA及NAG)按照2.2.5中所述方法平行制备9份供试品溶液,设计高中低3个浓度准确加入2.2.2中所述两种单糖的标准储备液A/B,每种浓度平行制备3份,按照既定方法检测单糖含量,根据标准品加入量计算方法回收率。结果表明,该方法对GA和NAG的回收率分别为97.1 %和99.8 %,9个样品的回收率RSD为1.6 %,表明该方法具有良好的准确度。结果见表1。
3 讨论
3.1 发酵液前处理
由于发酵液中HA含量较高,黏度较大,直接过滤较困难,也易堵塞色谱柱,应先通过前处理将发酵液中的HA尽量除去。大分子透明质酸钠可溶于水但不溶于有机溶剂如乙醇(50 %以上)等,而葡糖醛酸和乙酰氨基葡糖为小分子单糖,在高浓度乙醇中有一定的溶解度,利用这一差别,经过充分预实验,将发酵液乙醇浓度调至80 %,可将其中的HA充分沉淀,也可将其它多糖类物质以及蛋白质等杂质除去,减少发酵液中的成分对检测的干扰。
3.2 色谱柱的选择
分析单糖类物质通常采用糖柱或氨基柱[8]。糖柱的填料往往是基于配体交换作用的聚合树脂,其分离原理是基于配体交换反应,这类色谱柱往往价格昂贵且对多种单糖的分离效果不佳。氨基柱属于弱阴离子交换柱,流动相一般为乙腈和水,广泛应用于糖类检测,但这类色谱柱的键和相易水解,使柱效在使用过程中下降很快,重复性和耐用性较差。本文选用亲水作用色谱柱HILIC对单糖进行分析,HILIC是近年来色谱领域研究的热点之一,是一种用来改善在反相色谱中保留较差的强极性物质保留行为的色谱技术。本文建立的检测方法表明这类色谱柱适用于两种单糖的分析,分离度满足要求,稳定性好。
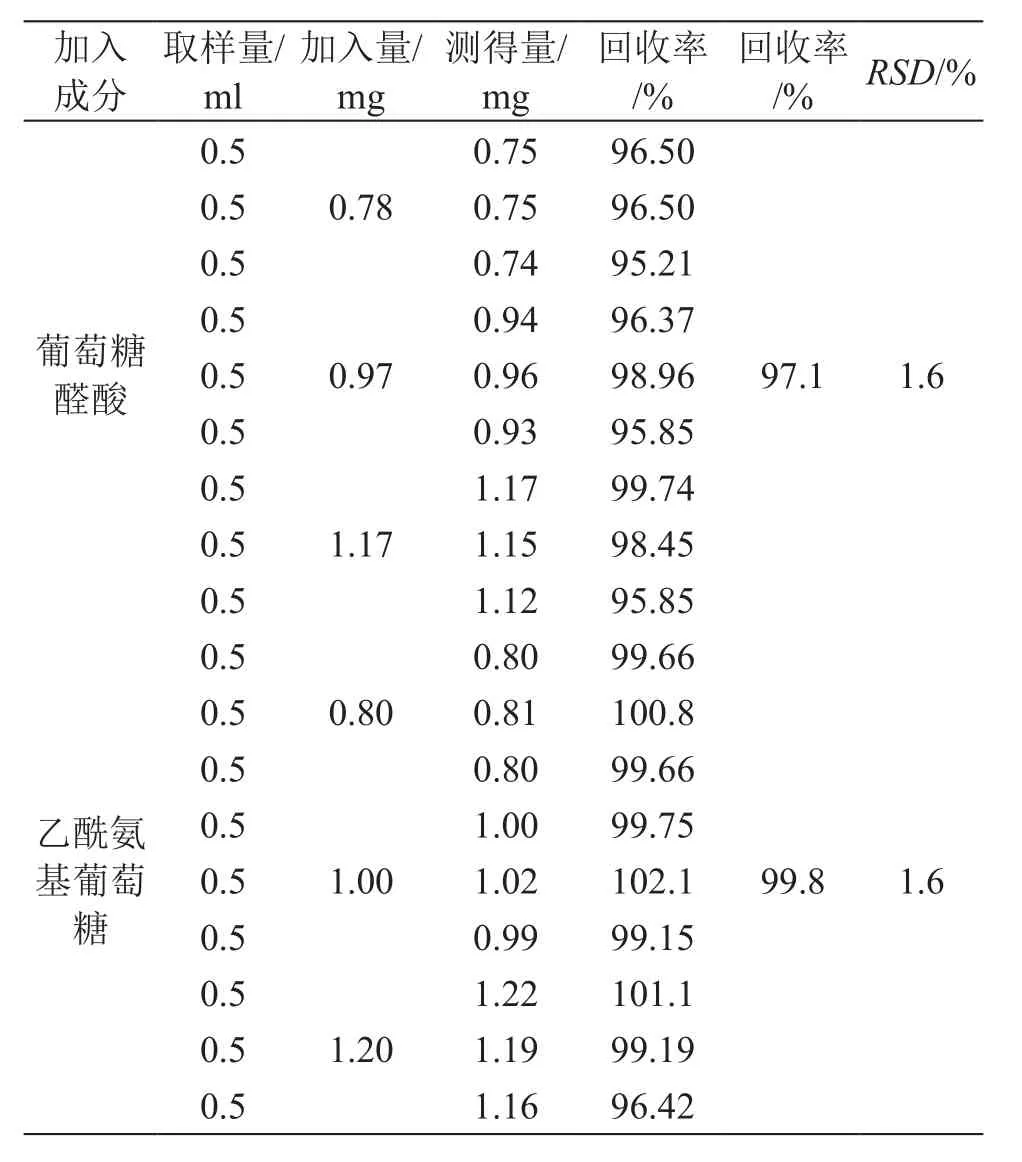
表1 加样回收率实验结果(n=9)
3.3 流动相的选择
HILIC色谱柱分析单糖一般采用反相体系,缓冲盐的加入能够增加两种单糖在色谱柱上的保留,通过调节缓冲盐的浓度可改善两种单糖的分离度,经实验,最终确定流动相4 mmol/L磷酸二氢钠。
本文建立了一种高效液相色谱法用于检测HA发酵液中两种单糖前体的含量,专属性强,分离度好,且对检测设备要求不高,基本配置(紫外检测器)的高效液相色谱仪即可满足要求,可用于发酵法生产HA的过程控制,了解转化情况,辅助判断发酵终点。
由于葡糖醛酸和乙酰氨基葡糖没有特征紫外吸收,因此采用UV检测器灵敏度并不是很高,两种单糖的检测限分别为20 ppm和2 ppm。如果将流动相中的不挥发性盐用挥发性盐(如乙酸铵)替代,则可用蒸发光散射检测器来检测单糖含量,提高方法灵敏度。
