102例注射用脑蛋白水解物不良反应分析
2019-11-05刘承启
宋 滨,刘承启,姜 华
(淄博市药品不良反应监测中心,山东 淄博 255020)
注射用脑蛋白水解物为猪脑组织提分离、精制而得的无菌制剂,内含约16种游离氨基酸及少量肽。本品可透过血脑屏障进入神经细胞,以多种方式作用于中枢神经,调节和改善神经元的代谢,促进突触的形成,诱导神经元的分化,保护神经细胞免受各种缺血和神经毒素的损害[1]。临床主要用于颅脑外伤、脑血管病后遗症伴有记忆力减退及注意力集中障碍的症状改善[2]。本文对注射用脑蛋白水解物引起的102例药品不良反应(ADR)报告进行统计和分析,了解其ADR发生特点,为指导临床合理用药提供参考。
1 资料与方法
1.1 资料来源
报告来源于2012~2016年淄博市药品不良反应监测中心收集到的102例注射用脑蛋白水解物不良反应报告。
1.2 统计方法
采用回顾性研究方法,对患者年龄、性别、用法用量、ADR发生时间、累及系统-器官、严重的不良反应、ADR转归等进行了统计分析。
2 结果
2.1 年龄与性别分布
102 例报告中,男女比例为1.08:1,表明ADR发生率与性别关系不大。患者最小年龄29岁,最大年龄91岁,平均年龄65岁。从年龄段看,51~80岁患者占绝大多数,比例为78.43 %。结果见表1。

表1 ADR患者年龄与性别分布
2.2 用法用量情况
102 例报告中,用法均为静脉滴注,每日一次。日剂量为60~180 mg共94例,日剂量低于60 mg共8例,日剂量为120 mg用药时不良反应发生率最高。仅27例报告中上报溶媒信息,其中21例生理盐水,6例葡萄糖注射液。结果见表2。

表2 ADR患者日剂量分布
2.3 ADR发生时间
102 例报告中,ADR主要发生在30 min以内,共55例,占53.92 %;30 min以上共16例,占15.69 %;发生时间不详,共31例。结果见表3。

表3 ADR发生时间
2.4 ADR累及器官-系统及临床表现
102 例报告共包含不良反应192例次,累及皮肤及其附件、呼吸系统、全身性损害、神经系统、消化系统等多个系统-器官。其中皮肤及其附件损害占比最大,为46.88 %。结果见表4。
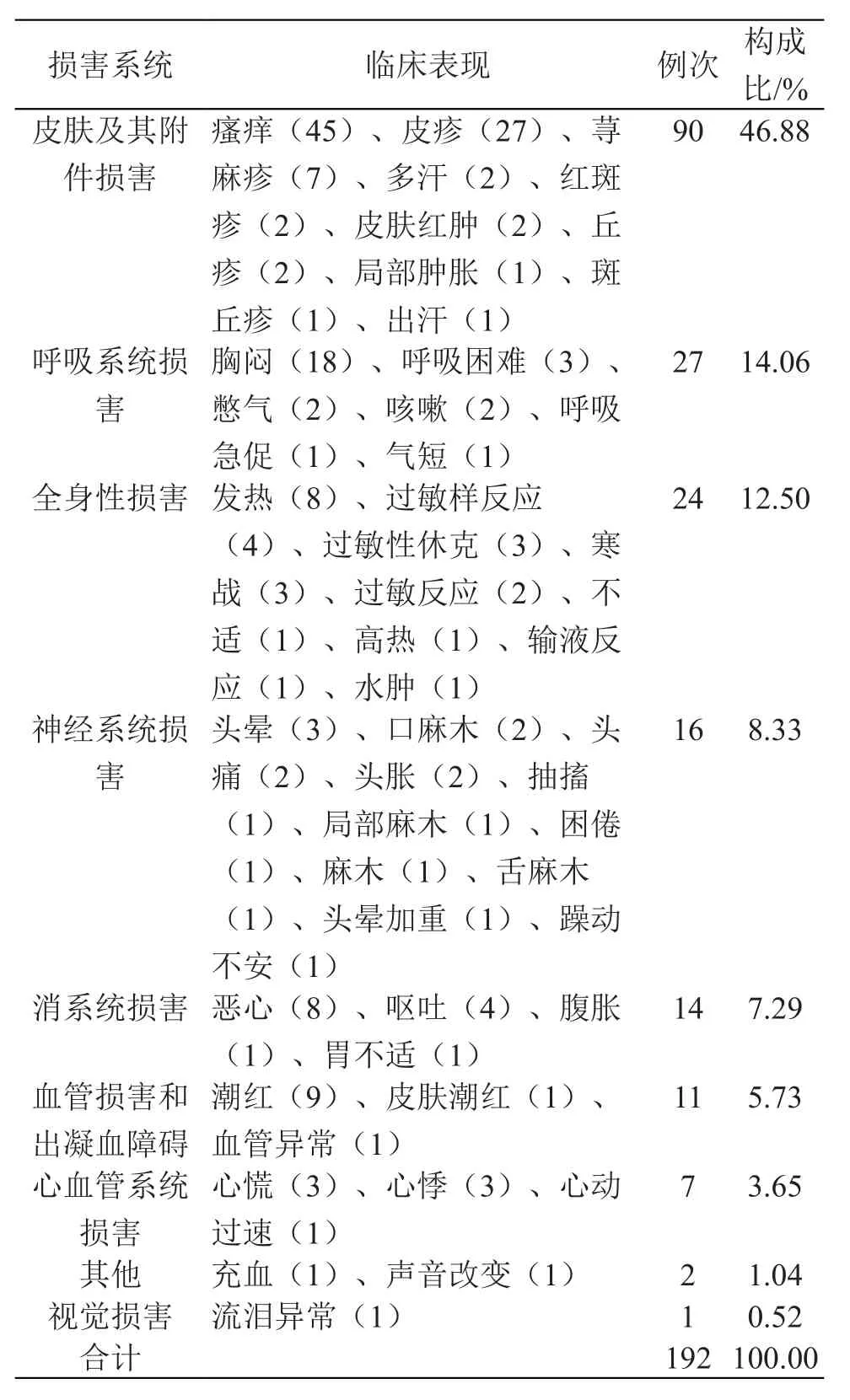
表4 ADR累及器官-系统及临床表现
2.5 严重ADR报告情况
102 例报告中,严重不良反应30例,占29.41 %。30例严重报告,男女比例为1.73:1,51~80岁患者占比高达80.00 %;日剂量为120 mg时不良反应发生率最高,其次为90 mg日剂量;ADR主要发生在30 min以内,共20例,占66.67 %;主要临床表现为瘙痒、胸闷、皮疹、过敏样反应、过敏性休克、呼吸困难等症状。
2.6 ADR转归
102 例报告中,ADR治疗64例,未治疗38例;29例好转,73例治愈,无死亡病例,说明由注射用脑蛋白水解物引起的不良反应可控可治。
3 讨论
3.1 中老年患者不良反应发生率高
102 例报告中,51~80岁患者占比达78.43 %,与注射用脑蛋白水解物的适用症有关。注射用脑蛋白水解物临床主要用于颅脑外伤、脑血管病后遗症伴有记忆减退及注意力集中障碍的症状改善的治疗,而此类疾病多发生于老年人中,故本品使用频率高,药品不良反应发生率相应增高[1]。因此,中老年患者用药时应注意用药反应,一旦发现不良反应,应及时停药,并给予对症治疗,防止不良反应恶化。
3.2 存在溶媒选择不合理情况
该药说明说中规定用法为静脉滴注,每日一次;用量为60~180 mg,用250 ml生理盐水稀释。102例报告中,用法均符合要求;94例给药剂量符合要求,8例给药剂量低于规定量;6例报告未按要求选择溶媒。葡萄糖注射液的pH值为3.2~6.5,为酸性溶液,而注射用脑蛋白水解物的《药品检验报告书》中其酸碱度检查要求溶剂pH值为6.5~7.5,故应选择偏中性的0.9 %氯化钠注射液。溶剂选择不当,药物的有效性及安全性难以保障[3]。医师应严格按照药品说明书规定的剂量、稀释溶媒用药,避免不合理用药。同时还应控制好给药速度,国家食品药品监督管理总局已于2016年11月10日下发公告,对脑蛋白脑蛋白水解物注射剂(包括注射用脑蛋白水解物及脑蛋白水解物注射液)说明书进行修订,要求增加“使用过程中应严格按照说明书中规定的用法用量缓慢滴注,建议用药起始10 min内滴注速度不超过30滴/min”警示语[4]。
3.3 不良反应多为速发型
102 例报告中,不良反应最早为首次用药2 min后,最迟为5 d后;其中,30 min以内出现不良反应的比例最高,达到53.92 %,说明注射用脑蛋白水解物引起的不良反应主要为速发型。因此,注射用脑蛋白水解物用药后30 min内应密切关注患者异常情况,发现不良反应,应立即停药并及时处理,防止不良反应发展而对患者造成严重损害[5-6]。
3.4 不良反应累及器官-系统临床表现
102 例报告累及多个系统-器官,其中以皮肤及其附件损害、呼吸系统损害及全身性损害不良反应较多。皮肤及其附件损害临床主要表现为瘙痒、皮疹、荨麻疹、皮肤红肿、红斑疹等症状;呼吸系统临床主要表现为胸闷、呼吸困难、憋气、咳嗽等症状;全身性损害主要表现为发热、过敏样反应、过敏性休克、寒战等症状。因此,医护人员应了解注射用脑蛋白水解物药品说明书最新动态,熟悉不良反应发规律及必要护理知识,最大限度减少患者的身体伤害。
3.5 过敏性休克原因分析
102 例报告中,有3例患者发生过敏性休克,经地塞米松、肾上腺素等药物治疗后好转或痊愈。文献[7-11]还报道了4例患者使用注射用脑蛋白水解物后发生过敏性休克病例。引起过敏性休克的原因可能是:(1)由于本品为猪脑提取物,若在制备过程中水解物提取不完全,有微量蛋白质存在,这些成分有可能作为抗原或半抗原物质,进入体内刺激机体产生抗体或致敏淋巴细胞,诱发变态反应[11]。(2)可能与患者体质有关,由于患者本身对本品中某种成份敏感所致,有文献[12]报道,1例对猪肉过敏患者在使用本品后发生过敏性休克。(3)可能与溶剂选择不当和静滴速度有关,本品说明书规定只能用生理盐水稀释,而且最新版药品说明书中警示语提示,在使用本品时应缓慢静滴,用药起始10 min内滴注速度不超过30滴/min。
3.6 不良反应的预防与处理
鉴于注射用脑蛋白水解物存在的以上不良反应,医护人员在使用本品前应仔细询问患者用药史和过敏史,对本品有过敏史的患者禁用,对过敏体质患者及有食物或药物过敏史的患者慎用本品[13]。充分掌握该药适用症,严格按照药品说明书规定选择溶媒,并控制好滴注速度,避免不合理用药。加强用药后监测,尤其是用药后30 min内,密切注意患者的用药反应,出现异常情况及时停药,并采取对症治疗,防止过敏性休克等严重不良反应的发生。
