shRNA干扰Nod样受体蛋白在新生大鼠脑缺血再灌注模型中的作用及机制*
2019-11-04杨丹丹张志良
穆 清,杨丹丹,杨 盛,张志良
南阳医专第一附属医院 心内科 (南阳473058)
心脑血管疾病是临床常见病、多发病,临床上经常出现“脑心综合症”、“心脑综合症”,可见两者的病变发生发展密不可分。Nod样受体蛋白(nod-like receptor protein 3, NLRP3)炎性小体,属于NOD样受体(NLR)家族,能识别病原体和损伤相关分子的胞内识别受体(PRR)[1]。研究[2-3]表明,受刺激的NLRP3与凋亡相关斑点样蛋白(ASC)和前半胱天冬酶-1相互作用,组装成大的胞浆复合物,激活半胱氨酸蛋白酶-1(Caspase-1),促进IL-1β的成熟和分泌,从而参与各种炎症性疾病的发展,如结肠炎[4]、乳腺炎[5]、急性肾损伤[6]、心肌缺血再灌注(ischemia-reperfusion, I/R)损伤[7]。 I/R损伤是经常发生的一种损伤[8],但是NLRP3在脑缺血再灌注模型(MCAO)建立之后对I/R的影响及其机理仍待研究。本实验采用新生大鼠构建MCAO,探讨sh-NLRP3对新生大鼠MCAO的心肌损伤、免疫反应方面的作用及其机制。
1 材料与方法
1.1 实验动物
SPF级新生7日龄SD大鼠,体重(17.5±2.5) g,雌雄不限,购自北京维通利华实验动物公司,许可证号为SCXK (京) 2014-0001(合格证号:0015675)。新生大鼠每笼10~15只饲养于标准笼内,雌性亲代大鼠自由喂养。
1.2 试剂与仪器
NLRP3的shRNA重组慢病毒(sh-NLRP3)由上海吉凯基因化学技术公司提供,上海博亚生物技术有限公司测序,滴度为109 TU/mL;增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)单克隆抗体购自北京中山生物技术公司;水合氯醛、心肌酶生化检测试剂购自上海复兴长征生化制剂公司;免疫组化试剂盒购自武汉博士德公司; TRIzol试剂盒、反转录试剂盒和荧光定量试剂盒购自美国ThermoFisher公司;一抗、二抗均购自英国Abcam公司;RIPA裂解液购自美国Sigma公司; ECL试剂盒购自上海碧云天生物科技公司;PCR仪、电泳仪及半干转膜仪均购自美国伯乐公司;Gel View 6000化学发光凝胶成像系统购自广州云星仪器有限公司。
1.3 实验方法
1.3.1 制备动物模型 动物模型的建立参照[9-12]报道的方法,用颈外动脉插入线栓法制作MCAO。大鼠麻醉后,无菌手术结扎左侧颈总动脉和颈外动脉,然后夹闭颈内动脉,在颈总动脉残端剪一小口,插入栓线,固定好栓线,结扎颈内动脉。大鼠清醒后,出现手术对侧肢体瘫痪、站立不稳、转圈运动时,提示模型建立成功。
1.3.2 分组给药 本实验分为4个小组:正常组大鼠、MCAO组、MCAO+阴性对照假手术(Scramble)组、MCAO+sh-NLRP3组,每组10只。其中,假手术组和MCAO组大鼠尾静脉给予灭菌生理盐水0.1 mL; MCAO+Scramble组大鼠尾静脉给予NLRP3空质粒0.1 mL; MCAO+sh-NLRP3组大鼠尾静脉给予含sh-NLRP3的慢病毒质粒0.1 mL。
1.3.3 RT-PCR 用Trizol试剂提取各组心肌组织总RNA,用反转录试剂盒合成NLRP3的cDNA,进行PCR扩增后,根据荧光定量PCR试剂盒对cDNA进行检测,以GAPDH为内参。实验所用引物由上海生工设计合成。
1.3.4 蛋白质印迹技术(Wertern blot) 用RIPA蛋白裂解液于冰上提取大鼠心肌组织总蛋白,BCA试剂盒检测蛋白浓度并调平。取等量蛋白质用12% SDS-PAGE分离后转移到PVDF膜。再用5%脱脂牛奶室温封闭2 h,以1∶1 000的浓度加入一抗,4 ℃孵育过夜弃去,加入对应二抗,室温封闭2 h后,滴加ECL于暗室曝光显影。
1.3.5 HE染色 取各组大鼠心脏组织,用4%多聚甲醛室温固定,制备4 μm厚的石蜡切片。然后进行HE染色,镜下观察。
1.3.6 免疫组织化学 对1.3.5所制作的石蜡切片进行免疫组化染色,操作严格按照试剂盒说明进行。染色结果显示阳性细胞核有棕色颗粒沉着,显微镜下随机选取5个不同视野,计算每个视野Ki67阳性率=Ki67阳性细胞/总细胞数×100%。
1.3.7 TUNEL染色 对1.3.5所制作的切片进行TUNEL染色。显微镜下随机选取5个不同视野,计算每个视野凋亡率=TUNEL阳性细胞/总细胞数×100%,取平均数。
1.3.8 Elisa 颈动脉插管取血2 mL,室温放置10~20 min后,离心速度2 000 r/min, 离心半径10 cm,离心20 min,收集上清液严格按照试剂盒说明书检测心损标记物肌红蛋白(Mb)、肌酸磷酸激酶同工酶(CK-MB)、肌钙蛋白(cTnⅠ)、心肌炎标记分子白介素-1β(IL-1β)、诱导型一氧化氮合成酶(iNOS)、白介素-6(IL-6)和白介素-10(IL-10)表达水平。
1.4 统计学方法
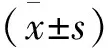
2 结果
2.1 sh-NLRP3对4组大鼠心肌组织中NLRP3表达的干扰作用
与Ctrl组相比较,MCAO组和MCAO+Scramble组大鼠心肌组织中NLRP3表达量均有明显上升,差异有统计学意义(P<0.01);而MCAO+sh-NLRP3组大鼠心肌组织中NLRP3表达量比MCAO组明显减少(P<0.01)(图1)。
2.2 sh-NLRP3对4组大鼠心肌病理损伤的比较
与Ctrl组相比较,MCAO组和MCAO+Scramlbe组镜下观察明显可见心肌细胞核消融、消失和成纤维细胞浸润等病理学改变,而MCAO+sh-NLRP3组心肌细胞未见明显异常(图2)。
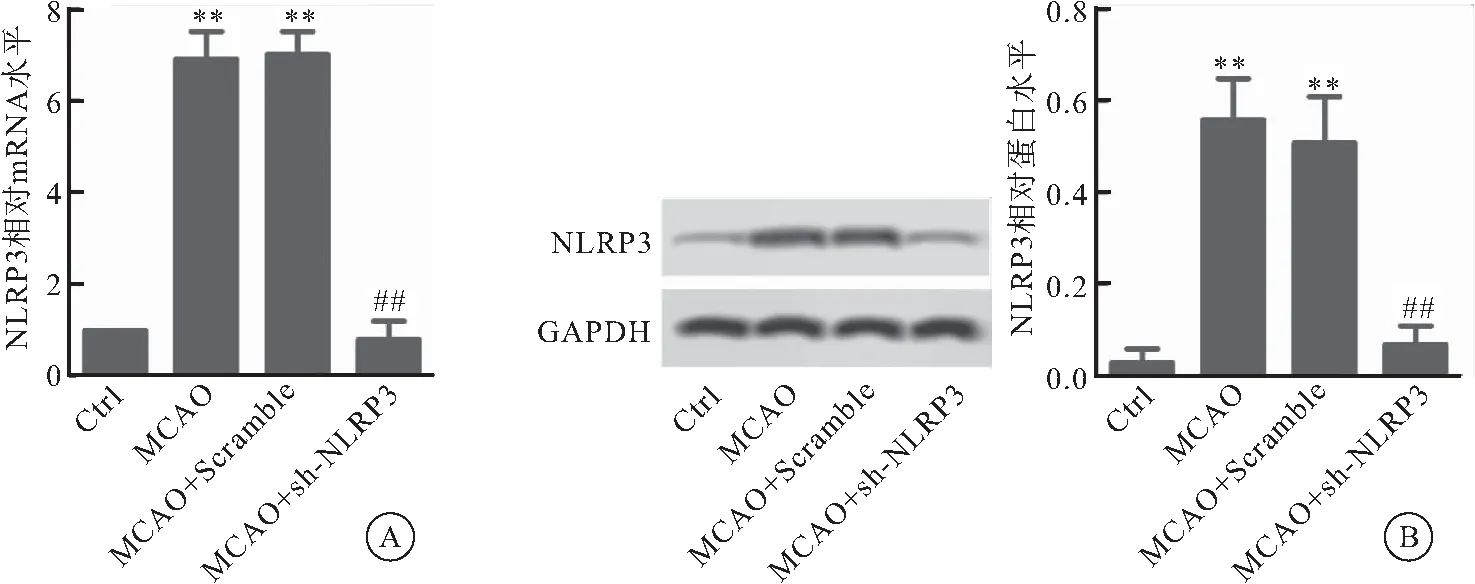
图1 sh-NLRP3对4组大鼠心肌组织中NLRP3表达的干扰作用
注:A:RT-PCR检测心肌组织中NLRP3的mRNA表达水平,与Ctrl组相比较,**P<0.01; 与MCAO组相比较,##P<0.01;B: Western blot检测心肌组织中NLRP3的相对蛋白表达水平,与Ctrl组相比较,**P<0.01; 与MCAO组相比较,##P<0.01
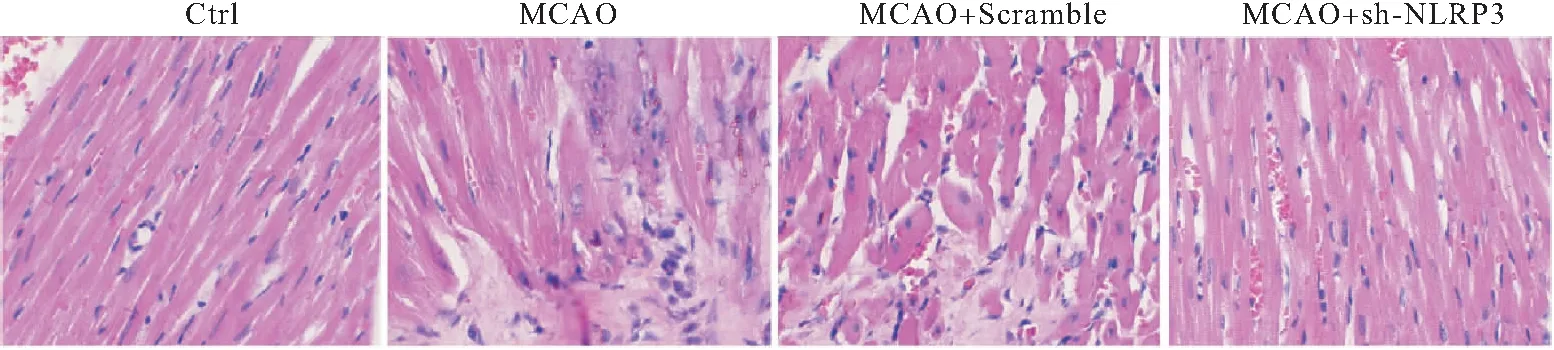
图2 HE染色检测心肌组织病变(400×)
2.3 sh-NLRP3对4组大鼠心肌组织Ki67、PCNA表达的影响
MCAO组和MCAO+Scramlbe组细胞胞浆被染成棕黄色的细胞比例基本相当,但比Ctrl组明显降低(P<0.01);而MCAO+sh-NLRP3组Ki67阳性细胞率较MCAO组有明显上调(P<0.01)(图3A~B)。与Ctrl组相比较,MCAO组和MCAO+Scramlbe组均低表达Ki67、PCNA(P<0.01);而MCAO+sh-NLRP3组心肌组织中两者的表达水平较MCAO组却又明显上升(P<0.01)(图3C)。
图3 sh-NLRP3对4组大鼠心肌组织Ki67、PCNA表达的影响(400×)
注:A:免疫组化检测各组心肌组织中Ki67;B: Ki67阳性细胞数统计结果,与Ctrl组相比较,**P<0.01,与MCAO组相比较,##P<0.01;C:Western blot检测心肌组织中Ki67、PCNA相对蛋白表达水平,与Ctrl组相比较,**P<0.01,与MCAO组相比较,##P<0.01
2.4 sh-NLRP3对4组大鼠心肌细胞凋亡的影响
与Ctrl组相比较,MCAO组和MCAO+Scramlbe组镜下TUNEL阳性细胞数量明显增多,而MCAO+sh-NLRP3组则明显较少。与Ctrl组相比较,MCAO组和MCAO+Scramlbe组细胞凋亡率明显上升(P<0.01);而MCAO+sh-NLRP3组凋亡率较MCAO组明显下降(P<0.01)(图4A~B)。与Ctrl组比较,MCAO组和MCAO+Scramlbe组心肌组织高Caspase-3、Caspase-9(P<0.01);而MCAO+sh-NLRP3组心肌组织中两者的表达水平较MCAO组有明显下降(P<0.01)(图4C)。
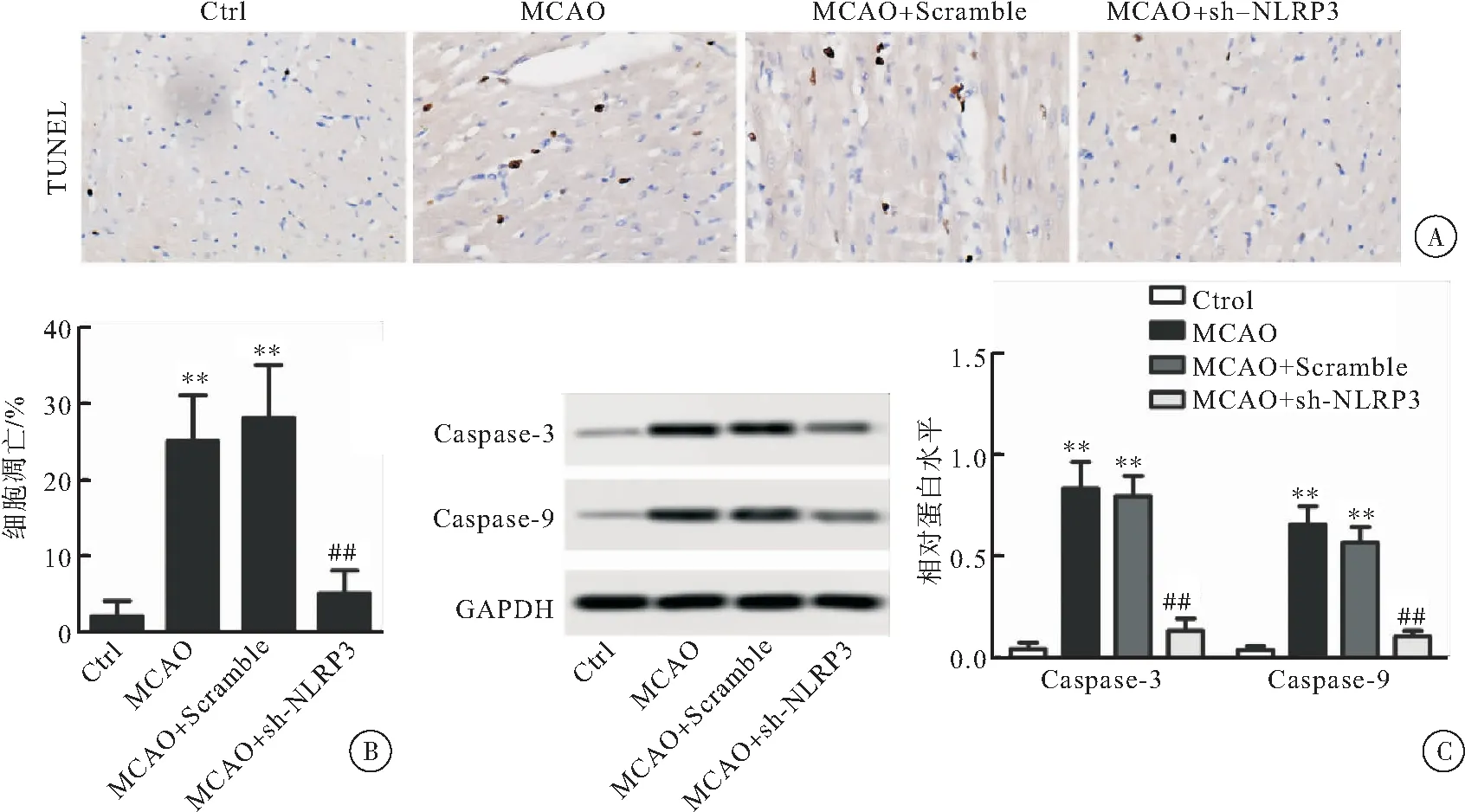
图4 sh-NLRP3对4组大鼠心肌细胞凋亡的影响(400×)
注:A: TUNEL检测心肌组织细胞凋亡情况;B:细胞凋亡统计结果,与Ctrl组相比较,**P<0.01,与MCAO组相比较,##P<0.01;C: Western blot检测各组Caspase-3和Caspase-9的相对蛋白表达水平及其统计结果.与Ctrl组相比较,**P<0.01,与MCAO组相比较,##P<0.01
2.5 sh-NLRP3对4组大鼠心肌损伤标记物含量的影响
与Ctrl组相比较,MCAO组和MCAO+Scramlbe组心肌组织中Mb、cTnⅠ和CK-MB的表达明显上调(P<0.01);而MCAO+sh-NLRP3组心肌组织中三者的表达水平较MCAO组明显下降(P<0.01)(图5)。
2.6 sh-NLRP3对4组大鼠TGF-β1、P-NF-κB p65和下游TNF-α表达的影响
MCAO组和MCAO+Scramlbe组心肌组织中TGF-β1、P-P65/P65和TNF-α的表达水平比Ctrl组明显升高(P<0.01);而MCAO+sh-NLRP3组中三者的表达水平较MCAO组明显降低(P<0.01)(图6)。
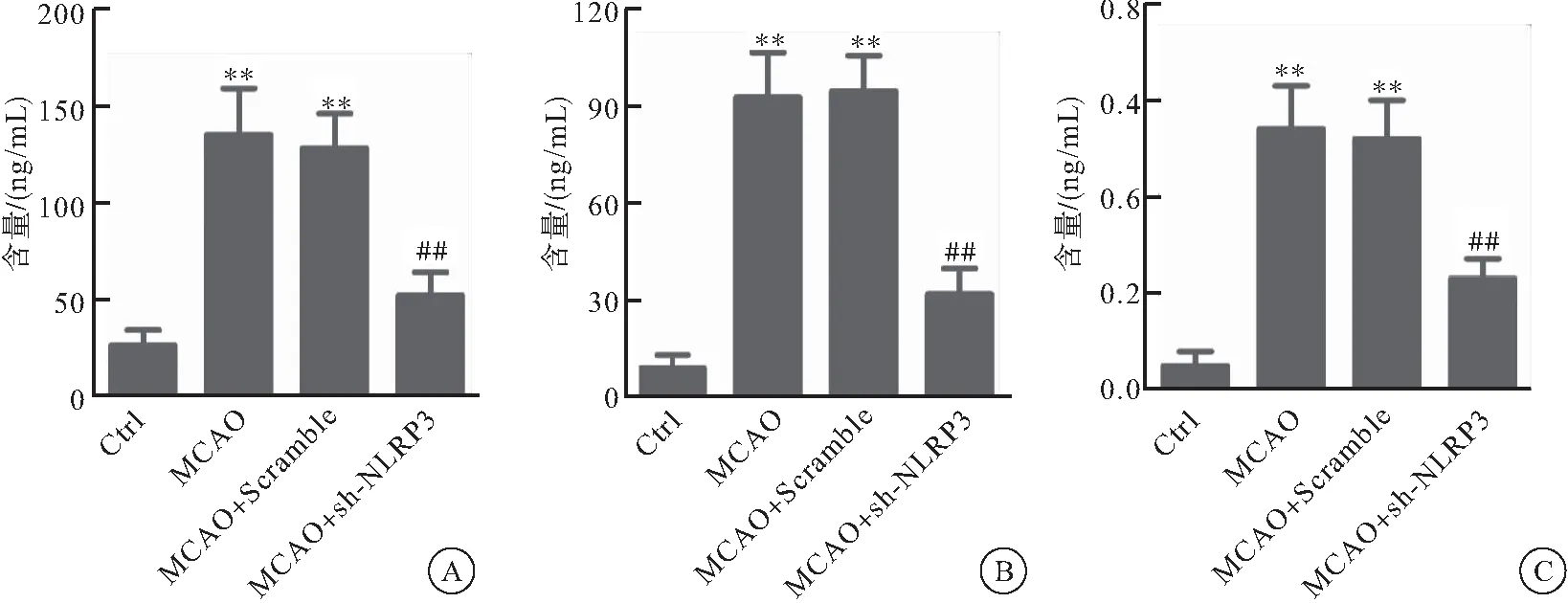
图5 sh-NLRP3对4组大鼠心肌损伤标记物含量的影响
注:A:心肌组织中Mb的ELISA检测结果,与Ctrl组相比较,**P<0.01,与MCAO组相比较,##P<0.01; B:心肌组织中CK-MB的ELISA检测结果,与Ctrl组相比较,**P<0.01,与MCAO组相比较,##P<0.01;C:心肌组织中cTnⅠ的ELISA检测结果,与Ctrl组相比较,**P<0.01,与MCAO组相比较,##P<0.01
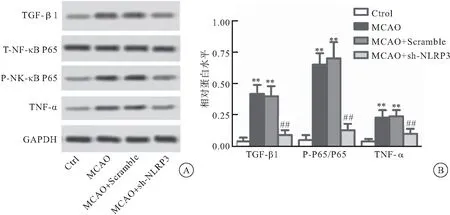
图6 sh-NLRP3对4组大鼠NF-κB p65磷酸化、TGF-β1和TNF-α表达的影响
注:A: Western blot检测TGF-β1、P-P65/P65和TNF-α的相对蛋白表达水平;B:TGF-β1、P-P65/P65和TNF-α的相对蛋白表达水平的统计结果,与Ctrl组相比较,**P<0.01,与MCAO组相比较,##P<0.01
2.7 sh-NLRP3对4组大鼠心肌炎标记分子表达的影响
与Ctrl组相比较,MCAO组和MCAO+Scramlbe组IL-1β、iNOS、IL-6的表达水平明显上调(P<0.01),IL-10则明显下调(P<0.01);而与MCAO相比较,MCAO+sh-NLRP3组下调IL-1β、iNOS、IL-6,而上调IL-10 表达(P<0.01)(图7)。
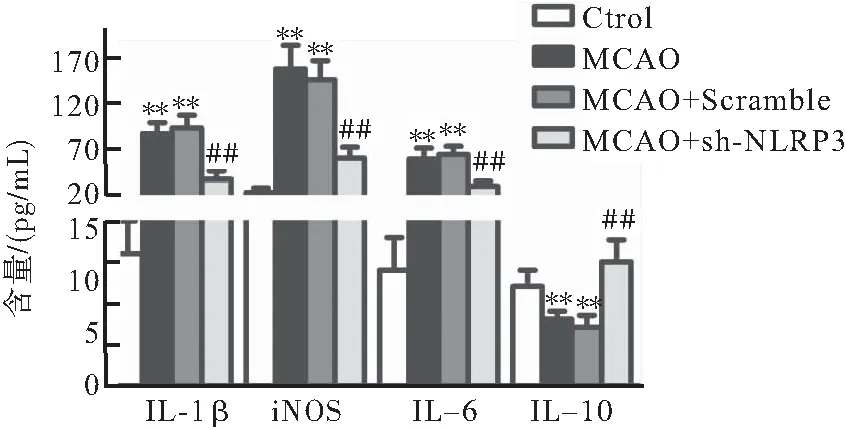
图7 sh-NLRP3对4组大鼠心肌炎标记分子表达的影响
注:与Ctrl组比较,**P<0.01,与MCAO组比较,##P<0.01
3 讨论
缺血性心脏病是全世界最致命的病因之一,I/R损伤是治疗该疾病难以克服的难题,目前并没有一种有效保护心脏免受I/R损伤的治疗方案。因此,迫切需要对I/R损伤的分子机制和潜在治疗方法进行研究[13-14]。通过抑制/沉默机体某些基因表达,可能是疾病治疗的新方法,研究者[15]采用siRNA对新生MCAO大鼠脑损伤起保护作用。而Bauer等[16]研究表明,葡聚糖硫酸钠(DSS)诱导活化NLRP3炎症小体,进而促进成熟IL-1β的释放,最终引发严重的肠道炎症,而NLRP3基因敲除小鼠可以有效的避免DSS诱导的结肠炎的发生。基于此,本课题采用新生大鼠建立MCAO,探讨sh-NLRP3对MCAO新生大鼠的保护作用。
研究[17]表明,心肌细胞在哺乳动物出生后迅速停止增殖,而另外的研究[18]则表明心肌细胞具有一定的再生能力。心肌细胞凋亡和坏死与严重心脏病如心力衰竭、心肌梗死和I/R损伤有关[19]。研究[20]表明,NLRP3炎症小体的激活先于心肌损伤和凋亡的发生,而其对I/R损伤的细胞损伤和炎症反应具有调节作用,在NLRP3基因敲除大鼠体内,缺血引起的梗死面积明显减小[21-24]。除此之外,NLRP3对多种细胞的增殖有很大的影响,其下调可促进P2X7R表达和淋巴细胞生长,而表达增强可抑制细胞增殖并诱导凋亡[25],敲除NLRP3基因可明显减少心脏细胞凋亡发生[26]。本课题研究也表明sh-NLRP3能有效改善模型大鼠心肌坏死,减少细胞凋亡、促进心肌细胞的增殖再生能力。
作为机体复杂生理反应的一部分,细胞内炎症微环境的改变在各类疾病发生发展过程中越来越被重视。NLRP3参与多种促炎因子的激活,包括IL-1β、IL-18和TNF-α[27],心肌I/R损伤患者血浆中IL-18明显升高,其表达水平与心肌功能障碍的严重程度直接关系[28]。严重I/R损伤大鼠高表达NLRP3,同时大鼠心肌组织中TNF-α、IL-1β及血浆中cTnⅠ的表达明显升高,心肌细胞凋亡率升高,表明NLRP3与上述分子及I/R损伤发生密切相关[29]。本文研究发现得出类似的结果,sh-NLRP3能明显减少MCAO新生大鼠心肌细胞损伤标记物的含量,降低炎症因子表达,从而减轻MCAO模型建立造成的心肌损伤,这点从HE染色和TUNEL染色可以得到更直观的反映。
NF-κB信号通路是炎症反应的关键转录因子,通常情况下以无活性状态被保存在细胞质中,可被多种刺激激活,通过与基因启动子和增强子(如TGF-β、TNF-α、IL-1β等)结合,参与机体内多种靶基因的调控[30-32]。如TNF-α活化NF-κB增加lncRNA Lethe的表达,上调的lncRNA Lethe与NF-κB结合来阻断靶基因的激活,达到减少炎症因子的作用[33]。通过调节NF-κB/TGF-β1/Smada2途经,3种补肺肾颗粒对慢性阻塞性肺疾病(COPD)大鼠炎症反应和气道重塑表现出明显的抑制作用[31]。激活NF-κB后诱导TGF-β1表达可以调节肠上皮细胞的迁移作用[34]。本文研究表明,sh-NLRP3可以抑制MCAO新生大鼠心肌组织中TGF-β1、P-P65/P65和TNF-α的表达,即sh-NLRP3抑制NF-κB信号通路活化,从而对MCAO诱导的心肌损伤和免疫反应产生抑制作用。
综上所述,本研究以MCAO新生大鼠为研究对象,初步探讨sh-NLRP3对模型大鼠心肌损伤和免疫反应的保护作用及其机制,丰富了MCAO中心肌损伤数据,为围产期并发症及心肌缺血/再灌注损伤等疾病提供了一些理论基础。
