鲍曼不动杆菌耐药结节化细胞分化家族外排泵基因对耐药性的影响*
2019-11-04刘献清王清会凌保东
刘献清,蔺 飞,彭 勤,王清会,凌保东△
1.成都医学院 结构特异性小分子药物研究四川省高校重点实验室(成都 610500);2.成都医学院第一附属医院 药剂科 (成都 610500)
鲍曼不动杆菌(Acinetobacterbaumannii)是一种广泛存在于自然环境中的兼性厌氧、非发酵的革兰阴性杆菌,可致呼吸机相关性肺炎,泌尿道、伤口、血液等感染,有较高的发病率与死亡率[1-2]。近年来,抗菌药物使用更加频繁,鲍曼不动杆菌的多重耐药菌株、泛耐药株在临床感染中越来越常见[3]。2017年2月,世界卫生组织(WHO)发布了首份抗生素耐药“重点病原体”清单,其中碳青霉烯耐药的鲍曼不动杆菌为紧急项之一[4]。
耐药结节化细胞分化家族(resistance-nodulation-cell-division family, RND)外排泵能将多种抗菌药物泵出细胞外,与临床菌株多重耐药结果密切相关[5-6]。本研究采用自杀性载体pMo130-Telr,通过同源重组的方法对标准耐药鲍曼不动杆菌AYE的主要RND外排泵基因:adeB、adeB-like、adeFGH、adeIJK分别进行敲除,对比检测敲除前后菌株抗菌药物的最低抑菌浓度(minimal inhibitory concentration, MIC),探讨RND外排泵对鲍曼不动杆菌耐药性的影响。
1 材料与方法
1.1 菌株来源
鲍曼不动杆菌AYE和 ATCC19606购自美国标准菌库(American type culture collection, ATCC)。质控菌株(大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853)由实验室前期保存。
1.2 材料与试剂
引物合成及测序(成都擎科);核酸染料4s Red Plus(上海生工);2 × Taq Master Mix (Dye Plus)(南京诺唯赞);PrimeStar HS DNA Polymerase(Takara);DNA Marker(成都福际);限制性内切酶及T4连接酶(Thermo);庆大霉素、亚胺培南、美罗培南、头孢哌酮、舒巴坦、头孢西丁、头孢他啶、阿米卡星、左氧氟沙星、米诺环素、替加环素购自大连美仑,氨苄西林、卡那霉素、环丙沙星、亚碲酸钾、蔗糖购自上海生工;酵母提取物及胰蛋白胨(OXOID);水解酪蛋白(Mueller-Hinton, MH)琼脂培养基及阳离子调节肉汤(cationadjusted Mueller-Hinton broth, CAMHB)培养基购自青岛海博。
1.3 仪器
恒温培养箱(中国一恒科学仪器);生物安全柜、恒温摇床(Thermo);PCR扩增仪(Eppendorf);核酸水平电泳仪、凝胶成像仪(Bio-Rad);多点接种仪(日本佐久间)等。
1.4 基因敲除步骤及方法
1.4.1 菌株鉴定及质控 AYE的鉴定引物如下(表1)。
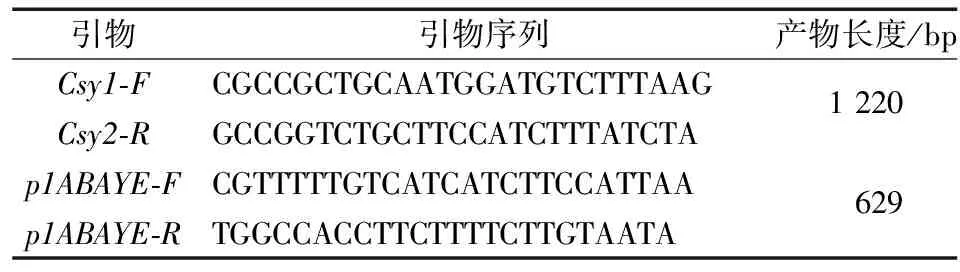
表1 AYE鉴定引物
1.4.2 实验步骤 实验过程主要参考文献[7]进行,具体步骤如下:1)实验前准备:通过NCBI数据库资料确定AYE的RND外排泵基因adeB、adeB-like、adeFGH、adeIJK,并进行相关引物的设计。使用引物如下(表2)。2)载体构建:以敲除adeB基因为例:①通过PCR法构建敲除基因的上下游同源序列并以重叠PCR链接;②将上下游链接序列以Not1和BamH1进行双酶切后插入自杀性载体pMo130-Telr;③构建载体的筛选及鉴定:a.引物PCR鉴定;b.双酶切鉴定:构建成功载体,电泳可见两条带:一条较小条带约2 000 bp(链接片段),一条较大条带约9 000~10 000 bp(线性质粒片段);c.PCR及双酶切鉴定后质粒进行测序验证,取无突变的质粒进行下一步实验。载体构建基本流程如下(图1)。3)基因敲除步骤:以敲除adeB基因为例:①接合:将携带自杀性载体的47055菌株与敲除目的菌株AYE的菌液混合浓集于NC膜上,37 ℃培养6~8 h后筛选:取接合后的稀释菌液涂布于T+G(亚碲酸钾30 mg/L+庆大霉素16 mg/L)固体培养板上,待长出单菌落后以引物AYEAdeB1上-FNot1/AYEAdeB1下-RBamH1,p130-F/p130-R及AYE鉴定引物进行鉴定。②第2步筛选:以含10%蔗糖的YT液体养基(每升培养基中包括10 g胰蛋白胨+10 g酵母提取物)传代培养,含10% 蔗糖的YT固体培养基分离单菌落。挑单菌落分别于LB固体培养基板和T板(亚碲酸钾30 mg/L)划线,37 ℃培养。选在LB固体培养板上长而在T板上不长的单菌落,以引物AYEAdeB1上-FNot1/AYEAdeB1下-RBamH1,p130-F/p130-R,AYEAdeB1检F/AYEAdeB1检R及AYE鉴定引物进行鉴定。③对PCR鉴定成功的菌株进行测序,检验基因敲除准确性。基因敲除的基本流程如下(图2)。

表2 用于基因敲除的PCR和DNA测序引物
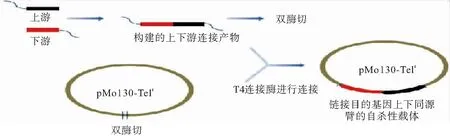
图1 载体构建的基本流程图
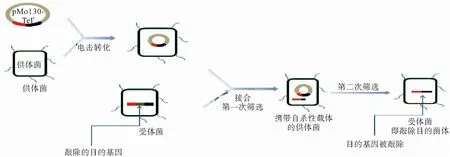
图2 敲除的基本流程图
1.5 MIC方法
根据2017年美国临床实验室标准化协会(clinical and laboratory standards institute, CLSI)标准对基因敲除前后菌株采用琼脂50%稀释法或微量肉汤法进行MIC检测。结果判读根据美国食品药品监督管理局(food and drug administration, FDA)及2017年CLSI标准。替加环素与多粘菌素E采用微量肉汤法,其余药物采用琼脂50%稀释法。
2 结果
2.1 外排泵基因敲除株AYE△adeB、AYE△adeB-like鉴定结果
与野生株对比,敲除株检测不到该基因,而AYE野生株可以检测到对应基因(1、5对比及13、17对比)。以敲除基因的上游同源序列F/下游同源序R(AYEAdeB1上-FNot1AYEAdeB1下-RBamH1、AYEAdeB2上-FNot1/AYEAdeB2下-RBamH1)检测时,敲除株检测产物比AYE野生株检测产物小约3 000 bp(2、6对比及14、19对比)。引物Csy1-F/Csy2-R使用以确保菌株都为AYE(3、7、15、18)。引物p130-F/p130-R使用以确保第2次筛选后载体pMo130-Telr彻底从AYE中丢失(4、8、16、20)。其余泳道未检测PCR产物(图3)。

图3 外排泵基因adeB、adeB-like敲除结果图
注:M:DNA Marker;1~8:adeB敲除结果鉴定,其中1~4为AYE△adeB结果,5~8为AYE结果;1、5:使用引物AYEAdeB1检F/AYEAdeB1检R,AYE△adeB检测不到产物,AYE产物约400 bp;2、6:使用引物AYEAdeB1上-FNot1/AYEAdeB1-RBamH1,AYE△adeB产物约2 000 bp,AYE产物>5 000 bp;13~20:adeB-like敲除结果鉴定,其中13~16为AYE△adeB-like结果,17~20为AYE结果;13、17:使用引物AYEAdeB2检F/AYEAdeB2检R,AYE△adeB-like检测不到产物,AYE产物约700 bp;14、19:使用引物AYEAdeB2上-FNot1/AYEAdeB2-RBamH1,AYE△adeB-like产物约2 000 bp,AYE产物>5 000 bp;3、7、15、18:使用引物Csy1-F/Csy2-R以确保菌株来源AYE,产物约1 200 bp;4、8、16、20:使用引物p130-F/p130-R以确保第2次筛选后载体pMo130-Telr彻底从AYE中丢失,检测不到产物。其余泳道未检测PCR产物
2.2 外排泵基因敲除株AYE△adeFGH、AYE△adeIJK鉴定结果
与野生株对比,AYE△AdeFGH检测不到该基因,而野生株可以检测到对应基因(1、5对比);AYE△AdeIJK相较于AYE野生菌株检测到的产物小约3 400 bp(13、17对比)。以敲除基因的上游同源序列F/下游同源序列R[AdeG上(Not1)F/AdeG下(SphⅠ)R、AdeJ上PstIF/AdeJ下SphⅠR]检测时,AYE△AdeFGH检测产物较AYE野生株检测产物小约5 500 bp(2、6对比),AYE△AdeIJK检测产物较AYE野生株检测产物小约3 300 bp(14、18对比)。引物Csy1-F/Csy2-R使用以确保菌株都为AYE(3、7、15、19)。引物p130-F/p130-R使用以确保第2次筛选后载体pMo130-Telr彻底从AYE中丢失(4、8、16、20)。其余泳道未检测PCR产物(图4)。

图4 外排泵基因adeFGH、adeIJK敲除结果图
注:M:DNA Marker;1~8:adeFGH敲除结果鉴定,其中1~4为AYE△adeFGH结果,5~8为AYE结果;1、5:使用引物AdeGRTF/AdeGRTR,AYE△adeFGH检测不到产物,AYE产物约260 bp;2、6:使用引物AdeG上(Not1)F/AdeG下(SphⅠ)R,AYE△adeFGH产物约2 000 bp,AYE产物约7 500 bp;13~20:adeIJK敲除结果鉴定,其中13~16为AYE△adeIJK结果,17~20为AYE结果;13、17:使用引物AdeJF/AdeKR,AYE△adeIJK检测不到产物,AYE产物约260 bp;14、19:使用引物AdeJ上PstIF/AdeJ下SphIR,AYE△adeIJK产物约2 000 bp,AYE产物约5 300 bp;3、7、15、18:使用引物Csy1-F/Csy2-R以确保菌株来源AYE,产物约1 200 bp;4、8、16、20:使用引物p130-F/p130-R,以确保第2次筛选后载体pMo130-Telr彻底从AYE中丢失,检测不到产物。其余泳道未检测PCR产物
2.3 MIC结果
实验检测了AYE及其RND相关外排泵基因敲除菌株对17种抗菌药物的MIC值,结果显示,敲除RND外排泵相关基因后,抗菌药物的MIC值呈现不同程度降低。1)对AYE△adeB,MIC值降低到原MIC的1/4或更低的抗菌药物有:亚胺培南、舒巴坦、氨苄西林舒巴坦、头孢西丁、阿米卡星、卡那霉素、环丙沙星、米诺环素、替加环素;MIC值降低到原MIC的1/2的抗菌药物有:美罗培南、氨苄西林、头孢哌酮、头孢哌酮舒巴坦、头孢他啶、左氧氟沙星、多粘菌素E。2)对AYE△adeB-like,MIC值降低到原MIC的1/2的抗菌药物有:美罗培南、氨苄西林、头孢西丁、环丙沙星、左氧氟沙星、米诺环素、替加环素、多粘菌素E。3)对AYE△adeIJK,MIC值降低到原MIC的1/2的抗菌药物有:美罗培南、氨苄西林、左氧氟沙星。4)对AYE△adeFGH,MIC值降低到原MIC的1/2的抗菌药物只有多粘菌素E。其中adeB敲除后MIC值变化最明显,具体结果如下(表3)。
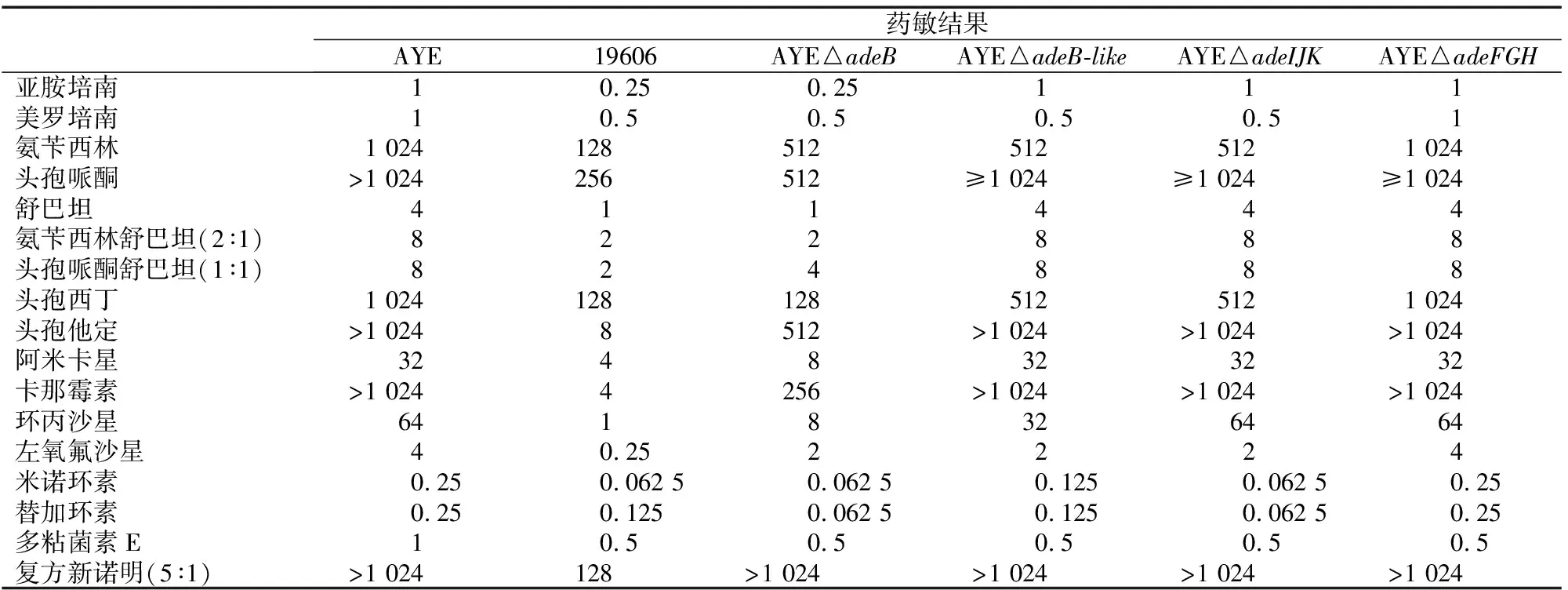
表3 AYE RND外排泵基因敲除前后菌株的MIC(mg/L)
3 讨论
外排泵作为细菌主要耐药机制之一,在鲍曼不动杆菌中普遍存在,且大多数的分离株至少表达一种RND型外排泵[8]。RND外排泵系统涉及多种功能,包括细胞内稳态、毒力因子和有毒化合物的排出[9],具有广泛的作用底物,包括抗菌药物和防腐剂等[8]。越来越多的证据[6,10]显示,RND外排泵系统的过度表达与细菌耐药性密切相关。本研究对鲍曼不动杆菌AYE的RND外排泵基因敲除前后菌株进行了17种抗菌药物的MIC检测,结果显示:adeB的缺失,具有最广泛抗菌药物的药敏结果改变,增强AYE对β-内酰胺类、氨基糖苷类、喹诺酮类、四环素类、替加环素及多粘菌素E的的敏感性;adeIJK的缺失,增强AYE对美罗培南、氨苄西林、头孢西丁、左氧氟沙星、四环素类、替加环素及多粘菌素E的敏感性,而对氨基糖苷类抗菌药物和环丙沙星的敏感性无影响,与Coyne等[8,11]文献内容相符。adeB-like的缺失,增强AYE对美罗培南、氨苄西林、头孢西丁、喹诺酮类、四环素类、替加环素及多粘菌素E的敏感性;adeFGH的缺失,仅增强了AYE对多粘菌素E的敏感性,证实了adeFGH的缺失不影响菌株对氨基糖苷类及β-内酰胺类的耐药性,且对抗菌药物敏感性的影响最小[10]。
综上所述,不同的RND外排泵基因的缺失对鲍曼不动杆菌耐药性具有不同程度影响,其中adeB对鲍曼不动杆菌AYE的耐药结果影响最明显。鲍曼不动杆菌AYE菌株与 RND外排泵基因敲除菌株对比,对多种抗菌药物药敏结果的改变,进一步证实了RND外排泵在鲍曼不动杆菌耐药中的重要作用。
