插田泡果实花色苷萃取方法比较及微波萃取条件优化
2019-11-04蒋华梅王向前
蒋华梅, 王向前, 杨 丹
(1.贵阳学院 化学与材料工程学院, 贵州 贵阳 550005;2.贵阳学院图书馆, 贵州 贵阳 550005)
蔷薇科悬钩子属类植物插田泡(RubuscoreanusMaq.),全世界分布广泛,中国主要分布于贵州、陕西、安徽、四川等地。插田泡果实6-8月成熟,营养丰富,富含花色苷、超氧化物歧化酶、维生素C、蛋白质等营养成分[1-3]。花色苷属水溶性黄酮多酚类化合物,具有抗氧化、抗炎、调节血脂、改善胰岛素抵抗、抗肿瘤、抗突变及预防心肌缺损等生物活性[4-7]。
植物花色苷的萃取方法有溶剂法、微波辅助法、超声波辅助法、酶法、超临界流体萃取法等[4,8-11]。溶剂法操作简便,但提取率不高;酶法提取率高,但反应条件的微小波动会使酶活大大降低,且提取过程中可能产生新的化学物质,影响提取物纯度;超临界流体萃取法提取率高,但仪器昂贵;微波、超声辅助法操作简便,省时省力,节约试剂且提取率高。
目前,插田泡果实花色苷的研究仅涉及溶剂振荡萃取和抗氧化活性方面的内容[2]。为完善插田泡果实花色苷的萃取方法及提高花色苷得率,实验首先比较了微波辅助法、超声波辅助法、超声- 微波协同萃取法3种方法对花色苷得率的影响,并采用响应曲面法优化插田泡果实花色苷的微波萃取条件,以期为插田泡植物资源利用及其花色苷的研究提供借鉴。
1 材料与方法
1.1 材料与试剂
插田泡果实于2018年6月采自贵州省安顺市西秀区,挑选紫黑色成熟果实超纯水洗净,-40 ℃冰箱冷冻储存备用。无水乙醇、氢氧化钠、醋酸钠、氯化钾,均为分析纯,重庆川东化工有限公司;盐酸(分析纯),西陇化工有限公司。
1.2 仪器与设备
FA1104型电子分析天平,上海西艾电子有限公司;BluStar- A型紫外- 可见分光光度计,北京莱伯泰科仪器股份有限公司;CW- 100型超声- 微波协同萃取仪,上海比朗仪器制造有限公司;PHS- 3C型精密酸度计,上海雷磁创益仪器仪表有限公司。
1.3 实验方法
1.3.1最大吸收波长的确定
准确称取5.00 g插田泡果实,研钵研碎,转移至250 mL三口烧瓶中,加入体积分数75%乙醇溶液(pH值 2)150 mL,于超声- 微波协同萃取仪中微波反应2 min,过滤,收集滤液。滤液在200~700 nm范围内进行扫描,确定花色苷的最大吸收波长。
1.3.2花色苷得率的测定
参照插田泡果实花色苷及玫瑰茄红素[2,12-13]测定方法。插田泡果实解冻后准确称取5.00 g研碎,不同条件下萃取、抽滤,收集滤液,滤液定容至250 mL得到插田泡果实花色苷粗提液。准确移取2 mL插田泡果实花色苷粗提液与盐酸缓冲液(pH 值1.0)6 mL混合,摇匀;再准确移取2 mL花色苷粗提液与醋酸缓冲液(pH值 4.5)6 mL混合,摇匀。分别用相应的缓冲溶液为空白对照,于最大吸收波长538 nm处测吸光度,花色苷得率计算见式(1)。
(1)
式(1)中,w为插田泡果实花色苷得率,mg/100 g;ΔA为ApH 1和ApH 4.5的吸光度差值;V为插田泡果实花色苷提取液的总体积,mL;F为稀释倍数;M为矢车菊素-3-葡萄糖苷的摩尔质量,449 g/mol;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数,29 600 L/(mol·cm);b为比色皿厚度,1 cm;m为样品质量,g。
1.3.3花色苷萃取方法的确定
准确称取3份各5.00 g样品,在料液比1∶30(g/mL)、体积分数75%乙醇(pH 值2)的条件下,分别以微波150 W、超声波150 W、超声- 微波协同300 W,按1.3.2节方法进行萃取反应1 min,平行实验3次。
1.3.4单因素实验设计
按1.3.2节方法,料液比1∶30(g/mL)、萃取温度35 ℃,选取微波功率(90、120、150、180、210 W)、微波提取时间(0.5、1.0、1.5、2.0、2.5 min)、酸化乙醇体积分数(55%、65%、75%、85%)、酸化乙醇pH值(1、2、3、4)4个因素进行实验,考察单一因素改变对插田泡果实花色苷得率的影响,平行重复3次,结果取平均值。
1.3.5响应面试验设计
根据单因素实验结果,选择3个因素微波功率(X1)、微波提取时间(X2)、酸化乙醇体积分数(X3)进行响应面试验,根据Box- Behnken试验设计原理,以插田泡果实花色苷得率(Y)为响应值,利用Design-Expert 8.0.6进行三因素三水平响应面优化试验,以确定插田泡果实花色苷的最佳微波萃取条件,因素水平见表1。

表1 响应面试验因素水平Tab.1 Factors and levels of response surface design
1.4 数据处理
采用Excel、 Design-Expert 8.0.6和Origin软件进行数据处理。
2 结果与分析
2.1 最大吸收波长的确定结果
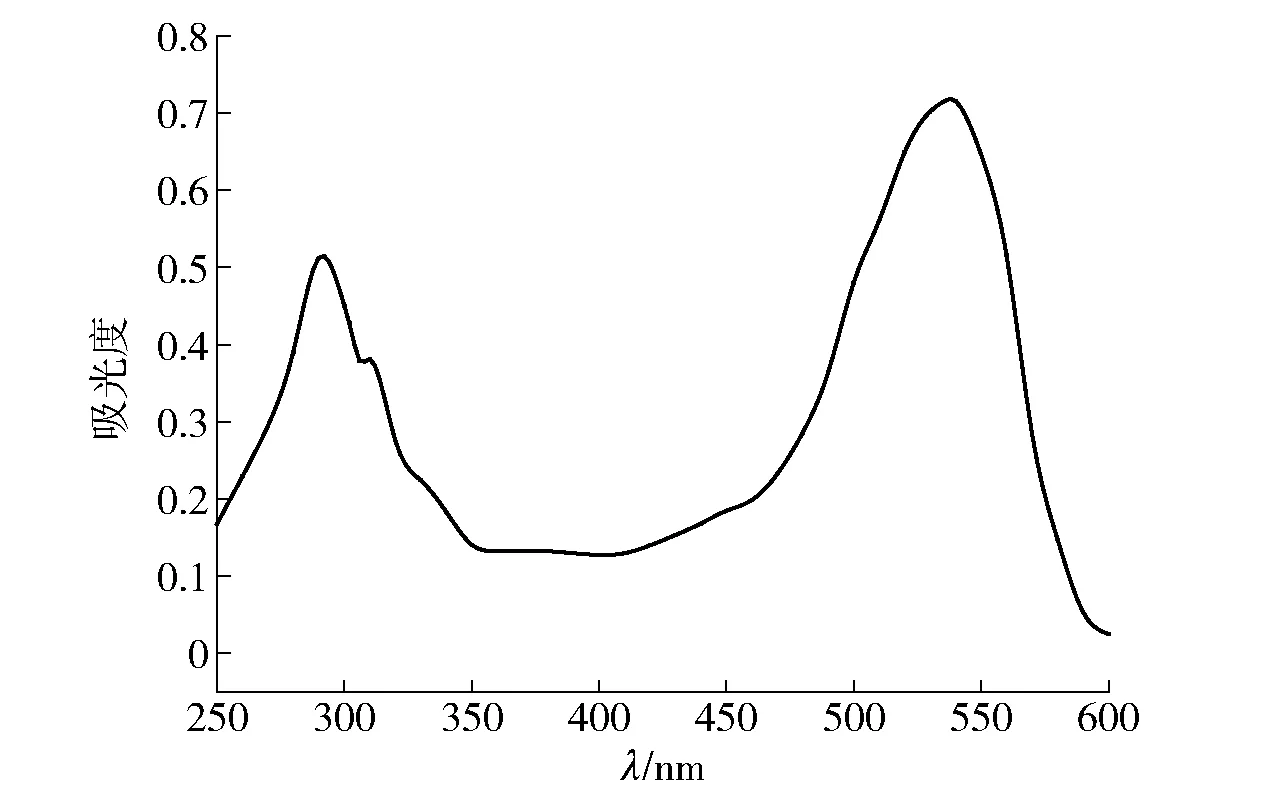
图1 插田泡花色苷紫外可见光谱Fig.1 UV- Vis spectroscopy of anthocyanin from Rubus coreanus Maq.
花色苷类物质经紫外- 可见光谱扫描后有2个特征峰,一个在紫外光区270~290 nm附近,与苯甲酰基有关;另一个在可见光区500~540 nm,与肉桂酰基有关。图1显示插田泡果实花色苷在292 nm和538 nm波长处有特征吸收峰。310 nm处吸收峰,表明插田泡果实花色苷含有酰基化基团,酰化的酸为对香豆酸[4,14]。因此,实验选取538 nm作为测定波长。
2.2 花色苷萃取方法的确定结果
微波辅助法、超声波辅助法、超声- 微波协同萃取法的花色苷得率分别为317.75、257.19、253.10 mg/100 g。结果表明,微波辅助法比超声波和超声- 微波协同萃取法更有利于插田泡果实花色苷的快速溶出,提高花色苷得率。超声- 微波协同萃取法花色苷得率稍低,可能是由于微波、超声波同时作用,体系温度较高(最高至36 ℃),造成部分花色苷分解(花色苷在此介质中的最低分解温度是35 ℃),得率降低。因此实验选用微波辅助萃取的方法对插田泡果实花色苷进行提取。
2.3 单因素实验结果

图2 各因素对花色苷得率的影响Fig.2 Effects of factors on anthocyanin yield
各因素对花色苷得率的影响如图2。由图2(a)可知,插田泡果实花色苷得率随着微波功率的升高出现明显的上升趋势。当功率到达150 W时,花色苷得率最大,随后出现下降趋势。功率的升高使花色苷更易溶出,花色苷得率增大。但当微波功率过大,体系温度太高,促使花色苷分解,得率减少[8]。由图2(b)可知,插田泡果实花色苷得率随微波提取时间延长先快速增加,提取1.0 min时达到最大294.39 mg/100 g;之后随着微波提取时间的延长,体系温度升高,由于花色苷较差的热稳定性,花色苷得率反而减小。由图2(c)可知,插田泡果实花色苷得率随着乙醇体积分数的增加逐渐增大;当乙醇体积分数超过75%时,花色苷得率降低,这是由于有机溶剂乙醇体积分数的增加降低了亲水性花色苷的提取率,导致总花色苷得率降低[15-16]。由图2(d)可知,插田泡果实花色苷得率随酸化乙醇pH值的增大而增加,当pH 值2时达到最大;之后花色苷得率随pH值的增大而缓慢下降。说明花色苷类物质的提取应在适宜酸度范围内进行,酸度过高(如pH 值1)或过低将降低花色苷稳定性,导致花色苷的水解及降解[17]。
2.4 微波萃取条件优化结果
2.4.1响应面试验设计及结果分析


表2 响应面试验设计与结果Tab.2 Experimental design and results for response surface analysis


2.4.2交互作用对花色苷得率的影响
根据回归方程绘出响应面图及等高线图,见图3~图5,分析微波功率、微波提取时间、酸化乙醇体积分数3个因素对插田泡果实花色苷得率的交互影响。
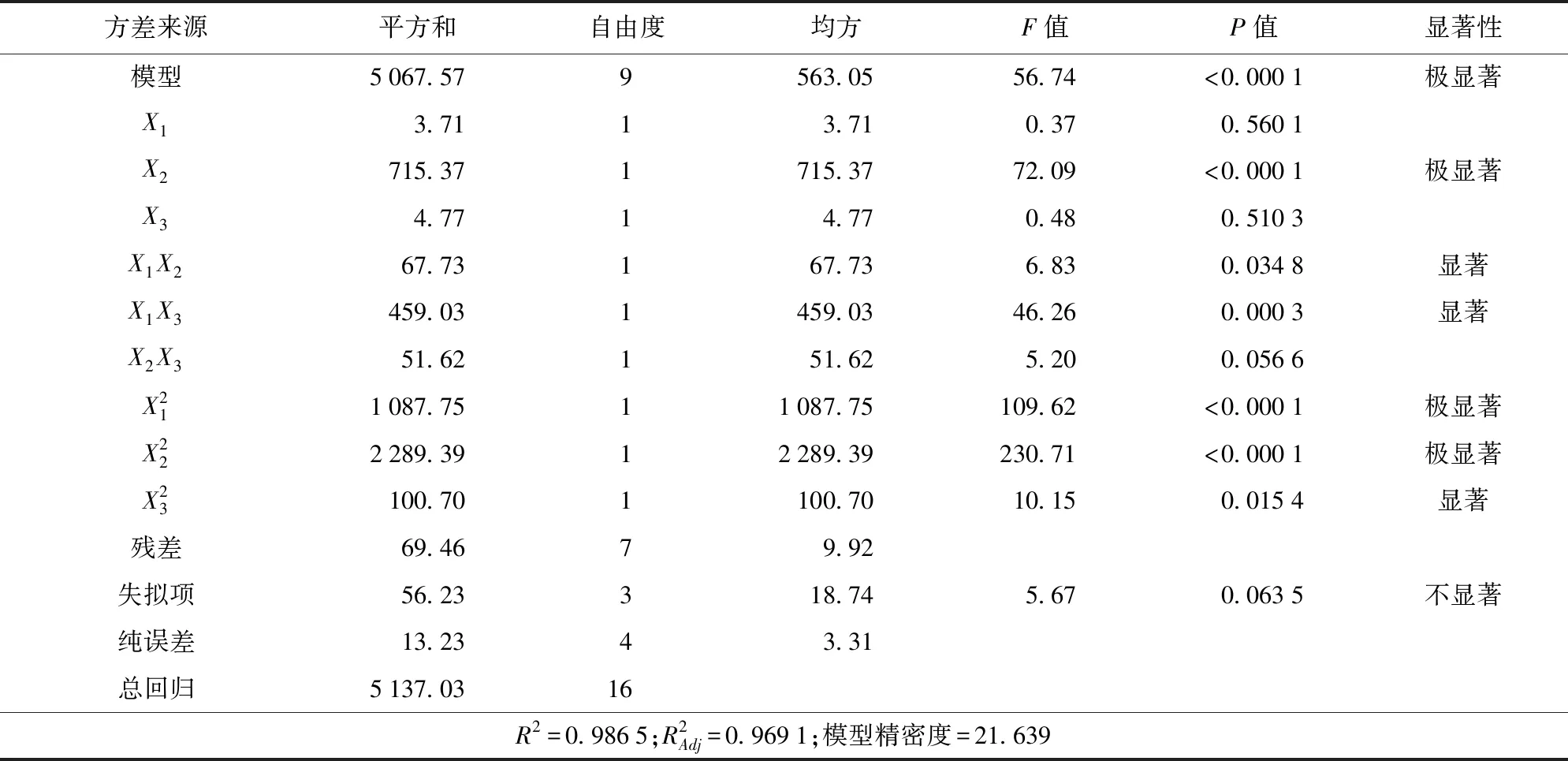
表3 花色苷得率的方差分析Tab.3 Variance analysis of anthocyanin yield
差异显著,P<0.05;差异极显著,P<0.000 1;差异不显著,P>0.05。

图3 微波功率与提取时间对花色苷得率的交互影响Fig.3 Interactions of microwave power and extraction time on anthocyanin yield
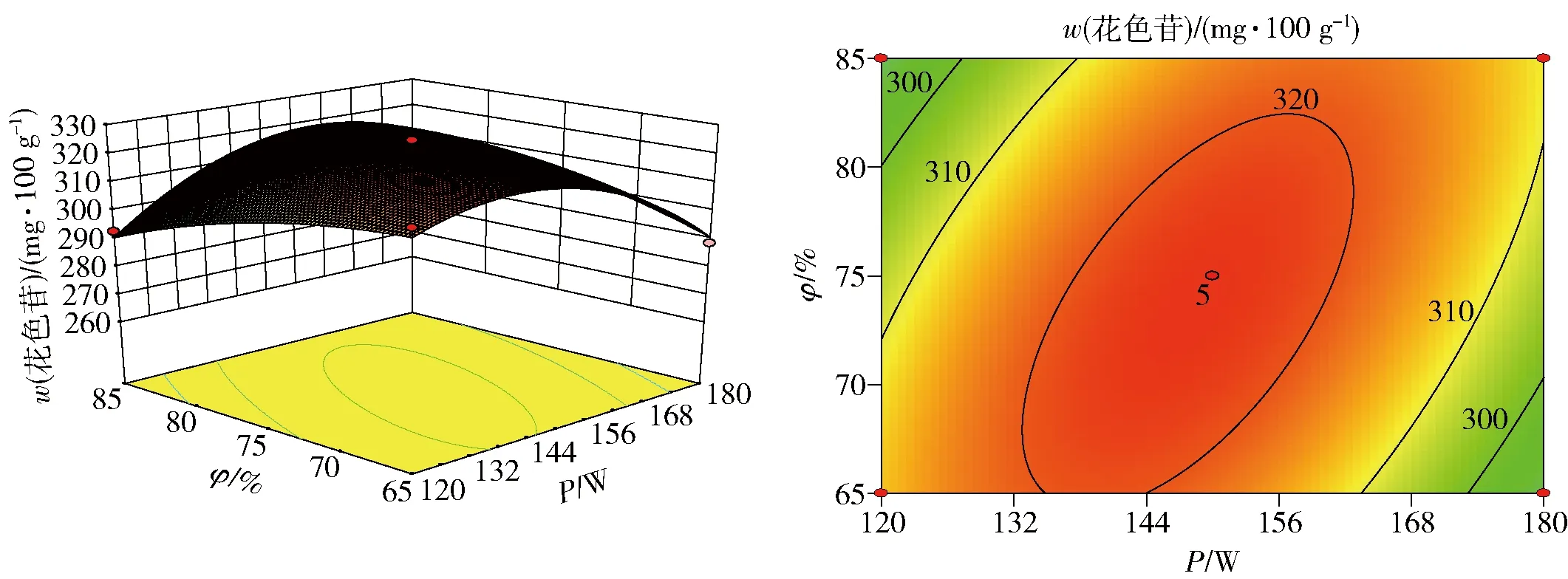
图4 微波功率与乙醇体积分数对花色苷得率的交互影响Fig.4 Interactions of microwave power and ethanol concentration on anthocyanin yield

图5 乙醇体积分数与提取时间对花色苷得率的交互影响Fig.5 Interactions of ethanol concentration and extraction time on anthocyanin yield
由图3可知,随着微波提取时间和微波功率的增加,插田泡花色苷得率先增大后减少,响应面的坡度陡峭,表明交互效应显著。由图4可知,随着酸化乙醇体积分数和微波功率的增加,插田泡花色苷得率先增大后减少,坡度更为陡峭,等高线呈椭圆形,说明交互作用更为显著。由图5可知,随着酸化乙醇体积分数和微波提取时间的增大,插田泡花色苷得率先缓慢地增大后减少,坡度较平缓,说明两因素的交互作用不显著。从等高线可知3个因素对花色苷得率的影响由大到小依次为微波提取时间、酸化乙醇体积分数、微波功率。
2.4.3优化提取条件的确定及验证实验结果
通过Design-Expert 8.0.6软件分析得到插田泡果实花色苷的优化提取条件为微波功率147.70 W、微波提取时间1.10 min、酸化乙醇体积分数74.13%(pH值2)。考虑实际操作的简便性,将以上条件调整为微波功率148 W、微波提取时间1.10 min、酸化乙醇体积分数74%(pH值2),并进行5次平行实验,测得插田泡果实花色苷得率为372.39 mg/100 g,与模拟计算值基本接近,表明预测值与真实值之间有很好的拟合性,进一步验证了模型的可靠性[9]。
3 结 论
微波萃取法的插田泡果实花色苷得率高于超声波和超声- 微波协同萃取法,也高于溶剂振荡萃取法的花色苷得率[2],说明微波辅助萃取技术更有利于插田泡果实细胞中花色苷组分的浸出,萃取效率更高。通过单因素实验和响应面试验,确定插田泡果实花色苷的优化微波萃取工艺参数为微波功率148 W、微波提取时间1.10 min、酸化乙醇体积分数74%(pH值 2),该条件花色苷得率可达372.39 mg/100 g。
该研究为插田泡果实花色苷萃取提供了一种经济、环保、高效可行的方法,但插田泡花色苷资源的纯化、鉴定、生物活性及作用机制、作用基因、靶器官、受体等方面的研究仍然任重而道远。随着插田泡植物资源研究的深入,插田泡花色苷必将充分发挥其在医药、食品、化妆品等领域的价值,为人类健康做出积极有益的贡献。
