GGTA1/β4GalNT2双基因敲除的巴马小型猪PFFs细胞系的建立
2019-11-04厉小雪李楚任雪洋王盈杨海元戴一凡南京医科大学江苏省异种移植重点实验室江苏南京211166
厉小雪,李楚,任雪洋,王盈,杨海元,戴一凡(南京医科大学江苏省异种移植重点实验室,江苏 南京 211166)
器官移植是治疗终末期器官衰竭患者的重要途径,但是受到供体器官严重不足的制约[1]。异种器官移植为解决同种供体器官短缺的问题提供了新思路。猪与人类在解剖、代谢、生理学器官大小、基因组和细胞周期特征等方面具有极高的相似性,所以猪被视为理想的人类器官供体来源[2-3]。目前,猪全基因测序已经完成,且体细胞核移植(somatic cell nuclear transfer,SCNT)已经广泛应用,致使猪成为生物医学中最受关注的大动物模型之一。广西巴马小型猪具有遗传稳定、产仔多、体型小等特征,在异种移植研究中受到越来越多的重视[4-5]。
然而,将猪器官应用到临床面临着免疫排斥的难题。α-1,3- 半乳糖(α-1,3-galactose,α-Gal)是一种存在于猪细胞表面的抗原,由α-1,3-半乳糖基转移酶基因(α-1,3-galactosyltransferase,GGTA1)编码。GGTA1基因在人体内失活,人体内存在大量的能够识别α-Gal的抗体。将猪器官或者组织移植给人时,会导致急性排斥反应(hyper acuterejection,HAR)[6-7]。将猪体内的 GGTA1 基因敲除,克服了异种移植中的超急性排斥反应[8-11]。然而,近期的研究发现,将敲除猪的器官进行移植后仍然会出现抗体沉积、补体激活和血栓形成的问题[12],表明猪细胞表面仍然存在着多种非Gal抗原[13-14]。Byrne等[12-16]研究发现猪体内还存在着一种由β-1,4 N-乙酸氨基半乳糖转移酶(β-1,4 N-acetylgalactosaminyltransferase 2,β4GalNT2)催化合成SD(a)抗原。当猪的器官移植到灵长类动物后,SD(a)能被免疫球蛋白结合而引起免疫排斥反应。因此,将巴马小型猪的GGTA1和β4GalNT2基因敲除,可以极大降低其器官/组织的免疫原性。
本研究利用CRISPR/Cas9基因编辑技术制备GGTA1/β4GalNT2双基因敲除的巴马猪胚胎成纤维细胞(porcine fetal fibroblasts,PFFs)细胞系,以期能为异种器官移植的研究提供更好的研究材料。
1 材料与方法
1.1 实验材料:待孕母猪为长白猪。妊娠37 d野生型原代巴马小型猪胚胎成纤维细胞由南京医科大学江苏省异种移植重点实验室提供;pX330质粒(Addgene plasmid 423230);细胞转染仪(Lonza,德国);G418(Gibco,美国);FBS(Pansera ES,America);DMEM(Gibco,美国);DPBS(Gibco,美国);pMD18-T载体(TaKaRa,日本);感受态DH5α(天根,北京);胶回收试剂盒(QIAGEN,德国);DMSO(Gibco,美国);引物序列和磷酸化的寡糖核苷酸序列 (北京擎科新业生物技术,北京)。
1.2 实验方法
1.2.1 构建质粒:根据Genbank公布的猪GGTA1、β4GalNT2基因序列,并在http://crispr.mit.edu上设计靶向GGTA1、β4GalNT2的单导向RNA (single guide RNA,sgRNA)序列,合成序列。Oligo序列退火后,与pX330载体连接,转化、涂板、挑取单克隆菌后测序,将测序结果正确的单克隆菌扩大,提取GGTA1-sgRNA、β4GalNT2-sgRNA打靶质粒。
1.2.2 细胞培养:复苏野生型妊娠37 d巴马小型猪胚胎成纤维细胞,用16% FBS的完全培养基于10 cm皿中,38℃,5% CO2培养箱中培养48 h。取培养48 h的37 d巴马猪胚胎成纤维细胞,DPBS洗3遍,取0.025%胰酶消化1.5 min,加入2 ml完全培养基终止消化,收集到15 ml离心管中1500转离心5 min得到细胞。按照Lonza成纤维细胞转染试剂盒的说明书配制核转液,向配制好的核转液中加入 GGTA1-sgRNA,2.5 μg;β4GalNT2-sgRNA,2.5 μg;TD tomato,1.0 μg,用配制的核转液重悬细胞,缓慢加入核转杯中,将核转杯放在核转仪上用V-013程序转染。转染结束后用2 ml 20% FBS培养基重悬,铺板,10 cm的培养皿中每个视野下的细胞数为30~50个细胞(本实验铺20个10 cm皿),将铺完细胞的10 cm放在5%CO2,38℃的恒温培养箱中培养。
1.2.3 克隆细胞筛选与鉴定:筛选单克隆细胞,加G418筛选细胞,加药后的第十天左右会出现单克隆,在4倍镜下观察单克隆的生长情况,将状态好的单细胞克隆用记号笔在皿底标注单克隆的具体位置。将相应的10 cm皿中的培养基去除,再用DPBS洗两遍,选取合适的克隆环放在标记好的克隆位置上,加入0.025%胰酶(胰酶刚刚铺满整个克隆环底部),计时器计时,消化2~3 min,加入20% FBS培养基终止消化,轻轻吹打,将消化下来的克隆细胞吸入48孔板中,在48孔板中标记挑取克隆的日期,待48孔板中的克隆长满时,胰酶消化传代到12孔板中,并留取1/5以备鉴定使用。4倍镜下观察,待12孔板中的克隆入长满时胰酶消化下来,加入细胞冻存液,将冻存盒放于-80℃冰箱中冻存,液氮中长期保存。
单克隆的鉴定:将留下的1/5细胞从48孔板中消化下来,8000转离心3 min加入20~30 μl NP40细胞裂解液,按照55℃ 1 h,95℃ 10 min的程序裂解得到单细胞克隆的基因组。再用得到的基因组进行PCR,PCR体系(2×Taq Master Mix,25 μl;DNA,2 μl;前引物,2 μl;后引物,2 μl;ddH2O,19 μl),按照(GGTA1:95℃预变性,5 min;95℃变性,30 s;64℃退火,30 s;72℃延伸,30 s;β4GalNT2:95℃预变性,5 min;95℃变性,30 s;62℃退火,30 s;72℃延伸,30 s)的程序进行PCR(引物序列如表1)。浓度为1%的琼脂糖凝胶跑琼脂糖凝胶电泳,DL2000作为为标记物(Maker),胶回收试剂盒做切胶,得到胶回收产物,测浓度,然后与pMD18-T载体连接(体系 :Solition Ι,5 μl;pMD18-T,1 μl;目的片段,1.5 μl;ddH2O ,2.5 μl),程序:16℃,70 min。将连接产物转化到感受态(DH5α)中,涂布到氨苄抗性的平板上,37℃恒温箱过夜,挑取单菌落送公司测序。与WT的序列比对得到敲除的基因型。

表1 GGTA1/β4GalNT2基因组靶序列引物
1.2.4 T7EN1酶切检测突变效率:转染后剩余的细胞放入10 cm皿中,待细胞长满皿后,消化提取基因组,扩增目的片段,反应条件:GGTA1:98℃预变性,30 s;98℃变性,10 s;64℃退火,15 s;72℃延伸,30 s,35 个循环;β4GalNT2:98℃预变性,30 s;98℃变性,10 s;64℃退火,15 s;72℃延伸,30 s,35个循环。对以上PCR产物进行琼脂糖凝胶电泳后切胶回收,30 μl去离子水洗脱。
T7EN1酶切实验体系:纯化产物,5 μl;10×NEB Buffer 2,2 μl ;去离子水,12 μl,每个 PCR管中19 μl体系在PCR仪中退火,退火结束后各取9.5 μl产物,加入 0.5 μl T7EN1 酶,剩下的 9.5 μl不加酶作为对照,37℃孵育15 min,每管加入0.5 μl Proteinase K使T7EN1酶失活,1%琼脂糖凝胶,100V,电泳50 min后分析结果。
1.2.5 体细胞克隆:从鉴定为GGTA1/β4GalNT2双敲的巴马细胞中选取状态良好的单细胞克隆进行SCNT。SCNT是将卵母细胞的核用盲吸法除去,然后再使用电融的方法使胚胎重构,并使它激活,将重新构建的胚胎培养10~24 h,选取形态和发育较好的胚胎移植到待孕的母猪子宫内。
1.2.6 获得双基因双敲的巴马小型猪:胚胎移植手术完毕后,护理受体猪,1个月后,B超仪检查受孕母猪是否怀孕。
1.2.7 取高压灭菌的手术器械,从怀孕母猪子宫中取出妊娠37 d的猪胚胎,分别置于10 cm皿中,并将取出的胚胎放在38℃的培养箱中(勿要将胎膜剪破,否则容易造成污染)。将取得小猪胚胎在75%酒精中快速润洗一遍,再用PBS洗两遍,在第二遍的DPBS中将胎膜剪破取出胚胎,再置于DPBS中润洗第三遍。用眼科剪和眼科镊取猪胚胎的体表皮肤置于无菌的6 cm皿中,尽可能剪碎。向皿中加入4~5 ml的胶原酶38℃消化30 min左右,镜下观察,当组织块变得疏松即可,终止消化,1 ml枪轻轻吹打,把消化好的组织加入到15 ml离心管中,1 500转离心5 min。去上清,再加入完全培养基重悬清洗一次,离心1 500转离心5 min,去上清,1 ml完全培养基重悬。每个胚胎的细胞分到3~5个10 cm培养皿中培养,48 h后观察,待细胞长满皿底,消化下来冻存,做好标记,在液氮中保存,以备后用。
2 结 果
2.1 GGTA1/β4GalNT2基因 CRISPR/Cas9靶向载体的构建:本研究根据Genbank公布的猪GGTA1和β4GalNT2基因序列,于GGTA1 的3号外显子和β4GalNT2的 8号外显子分别设计1条sgRNA(图1),退火后与线性化的pX330连接。重构后的质粒进行测序,结果(图2)显示sgRNA均已成功连接进入pX330,成功构建GGTA1-sgRNA、β4GalNT2-sgRNA打靶质粒。
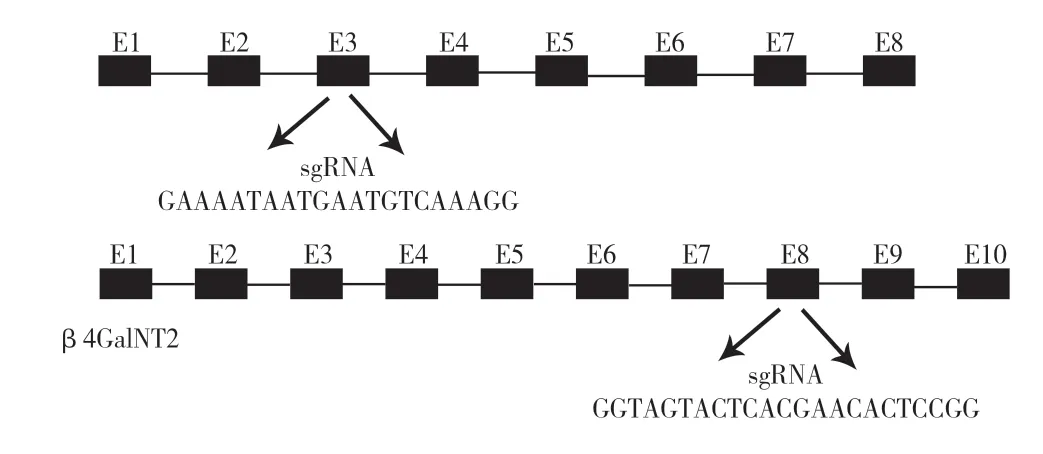
图1 GGTA1和β4GalNT2基因的sgRNA靶点设计
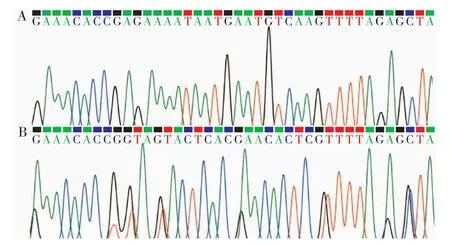
图2 基因重组载体的测序图
2.2 T7EN1酶酶切实验验证sgRNAs敲除效率:PCR产物退火后经T7EN1酶酶切电泳结果可以看到GGTA1和β4GalNT2各被剪切成两段。本实验在GGTA1的3号外显子上设计1个sgRNA,且在β4GalNT2的8号外显子设计1个sgRNA。实验结果经灰度扫描用公式计算转染敲除效率:GGTA1-sgRNA 13.9%;β4GalNT2-sgRNA 3.3% (图3)。
2.3 单细胞克隆的获得和鉴定:复苏后的野生巴马胚胎成纤维细胞,共转染GGTA1-sgRNA和β4GalNT2-sgRNA质粒,经过G418筛选,共挑取70个单细胞克隆,选取其中31个状态很好的单细胞克隆进行冻存,经过基因型鉴定,其中有5个单细胞克隆发生碱基删除或增加(图4)(-3,+3,-6bp的细胞除外),GGTA1/β4GalNT2,双基因敲除的突变率为16.1%。

图3 sgRNA敲除效率验证
3 讨 论
巴马小型猪的体型较小、性成熟早、遗传稳定,作为异种移植供体,具有多种优势:易饲养、繁殖、器官大小和生理结果与人类较为匹配,巴马猪作为供体,在伦理方面也比较容易接受。猪胰岛移植、猪角膜移植、猪皮肤移植、甚至猪红细胞到人类输血都是很有前景的研究。但是猪的器官应用于临床前,还面临很多问题,首先异种器官间的免疫排斥反应需解决。
GGTAI基因敲除的猪的问世虽然能够有效地抑制超急性排斥反应,但是在异种移植的过程中由抗体介导的免疫排斥反应仍然存在,因为在猪的体内仍然含有多种非Gal糖类抗原[17]。而最近的研究发现猪体内的β4GalNT2基因产物是一种非Gal抗原。Estrada等首次制备并获得了β4GalNT2基因敲除猪,发现与未敲除β4GalNT2基因的猪比较,β4GalNT2 基因敲除后,猪的PBMC与人IgM 和IgG 的结合显著减少。可见GGTA1/β4GalNT2双基因敲除巴马小型猪在异种移植中的重要性。
以CRISPR/Cas9为代表的基因编辑技术结合体细胞克隆为构建基因敲除动物模型创造了前所未有的发展机遇。在创建动物模型领域,CRISPR/Cas9基因编辑技术的应用突破了一些制约体细胞克隆发展的关键技术瓶颈,如某些动物ES细胞限制、传统基因打靶技术和体外基因定点整合效率低等问题。如今,CRISPR/Cas9系统结合现已成熟的体细胞核移植技术极大地推动了基因敲除或敲入动物模型的创建和该产业的发展。袁益琳[18]利用CRISPR/Cas9构建ApoE基因敲除巴马猪,成功获得动脉粥样硬化的猪模型。张纬[19]利用CRISPR/Cas9技术构建C3基因敲除猪模型,成功获得免疫缺陷猪模型。

图4 GGTA1和β4GalNT2单细胞测序结果
近期,有通过其他方法得到基因敲除的猪,如胚胎注射一步法[20]、体细胞 LOH 突变法等[21-22]。有研究得到了GGTA1/β4GalNT2双基因敲除巴马小型猪,但是,其研究得到的GGTA1/β4GalNT2双基因敲除巴马小型猪是利用CRISPR/Cas9技术,在GGTA1基因敲除猪基础上再一次克隆敲除β4GalNT2基因[23]。这些方法使用单细胞培养的方法得到单细胞克隆效率低、周期长。本研究是利用CRISPR/Cas9技术同时将GGTA1/β4GalNT2两个基因从细胞水平敲除得到的,大大提高了双基因敲除的效率,节省了时间,而且,筛选单克隆细胞的方法也有所不同,本研究的步骤简化,技术也更加成熟。测序的结果显示,在设计的靶点位置会出现不同形式碱基缺失和插入的突变,双基因敲率为16%,说明CRISPR/Cas9技术在双基因编辑中的高效性。在后期的实验中我们会继续优化实验设计和操作以期得到更高的敲除效率。
本实验得到大量GGTA1/β4GalNT2双基因敲除巴马小型猪胚胎成纤维细胞为后续大批量获得双敲的巴马猪打下实验基础。
本研究利用CRISPR/Cas9技术,成功获得了GGTA1/β4GalNT2双基因同时敲除的PFFs细胞系,经SCNT获得双敲的巴马小型猪猪胚胎,为异种移植提供研究材料。
