灰黄霉素在土壤环境中的生物效应影响研究
2019-11-02段路路黄河清
段路路,黄 婧,黄河清
(上海化工研究院有限公司/上海化学品公共安全工程技术研究中心 上海 200062)
抗生素是指由细菌、霉菌或其他微生物在繁殖过程中产生的,能够杀灭或抑制其他微生物的一类物质及其衍生物,用于治疗敏感微生物(通常为细菌或真菌)所致的感染,现多用作生长促进剂以加快牲畜及水产品的生长。虽然抗生素的半衰期不是很长,但由于其在环境中大量、频繁地使用,可导致抗生素的污染[1]以及抗药性的产生。目前,在世界多个区域的农田中均检测到了抗生素,其中又以四环素类、磺胺类、大环内酯类、喹诺酮类抗生素为典型[2-5]。我国是世界上最大的抗生素原料药生产国和出口大国,生产70多种抗生素,占全球生产总量的70%。近年来,由于抗生素在养殖业、畜牧业以及医疗卫生上的大量使用,导致其对环境污染的问题日趋严重,已成为当前国内外的研究热点之一[6-8]。
灰黄霉素是由Oxford等[9]从灰黄青霉培养液中分离得到的一种含氯代谢产物,分子式为C17H17ClO6,为白色或类白色结晶性粉末,无臭,味微苦,可溶于丙酮、无水乙醇和二甲基甲酰胺,但在水中极微溶解[10]。灰黄霉素是一种非多烯类的物质,作为抗真菌抗生素,在临床上主要用于治疗皮肤癣菌属等引起的各种疾病。灰黄霉素作用机理一般,其化学结构与鸟嘌呤相似,因此能竞争性抑制鸟嘌呤进入DNA分子,从而干扰了真菌DNA的合成以达到抑制真菌生长的目的;另外,它能与微管蛋白相结合,从而阻止真菌细胞分裂。灰黄霉素作为一种抗生素,不仅能普遍应用于临床治疗皮肤和角质层真菌感染,其在农业植物保护方面也有着潜在的应用价值。
在我国,灰黄霉素的应用范围已逐渐扩大到畜牧业、水产及植物真菌性病害的防治等,包括以内服的方式治疗牦牛毛癣、制成药饵进行鱼类水霉病的预防与防治、用质量分数5%~10%的灰黄霉素膏剂涂抹茎部病处来防治瓜类枯萎病等[11-12]。由于土壤或沉积物是灰黄霉素的最终归宿之地,进入环境中的灰黄霉素将在土壤或沉积物中积累,对土壤生态环境产生一定的影响,如灰黄霉素进入农田后可能会对土壤植物、土壤动物、土壤微生物等产生影响,但有关这方面的影响目前还了解不多。为此,通过试验模拟的方法研究了灰黄霉素对种子发芽和根伸长的毒性试验、对土壤中蚯蚓急性毒性试验、对土壤微生物(细菌、真菌、放线菌)的影响以及对土壤中脱氢酶、磷酸酶和脲酶活性的影响,旨在揭示灰黄霉素引入农田后对土壤中生物效应的影响,为正确评价灰黄霉素的生态环境效应提供依据。
1 材料与方法
1.1 供试材料
(1) 供试样品
灰黄霉素,分子式为C17H17ClO6,分子量352.77,质量分数99.0%。
(2) 供试土壤
试验用土壤采自内蒙古自治区赤峰市宁城县八里罕镇赵家沟村的棕壤土,采样深度0~20 cm,质地为砂壤土。新鲜土样采集后拣去植物残体,分成两部分,一部分土样直接过2.00 mm筛,混合均匀后于4 ℃下保存,供培养试验使用;另一部分土样风干后,研磨分别过2.00 mm和0.25 mm筛,用于土壤基本理化性质的测定。经测定,土壤基本理化性质:pH为8.16,有机质为12.0 g/kg,全氮为1.21 g/kg,有效磷为9.12 mg/kg,速效钾为112.5 mg/kg,土壤容重为1.3 g/cm3,田间持水量为30%。
(3) 供试植物
10种受试植物信息如表1所示。
表1 10种受试植物信息

受试植物品系来源有效期发芽率/%青菜特矮青菜上海兴绿蔬菜种苗研究所2018-08≥85甘蓝京丰一号四川省绵阳市南峰蔬菜研究所2018-05≥85洋葱金冠洋葱王河北省邢台兴达种业有限公司2018-08≥85白菜夏抗王河北省青县兴运种苗蔬菜种子站2018-09≥85生菜意大利全年耐抽苔生菜北京科力达神禾种子有限公司2017-12≥85菜豆无筋绿地豆天津市蓟农种子有限公司2018-02≥85玉米圣尼亚北京圣尼亚种业科技有限公司2017-12≥85豇豆双丰多收江西华农种业有限公司2017-12≥85黄瓜新津优1号山东泰安华益种业有限公司第一分公司2018-11≥85萝卜特级白玉兰上海瑞奇种业有限公司2018-09≥85
(4) 供试动物
赤子爱胜属蚯蚓,二月龄以上,体质量0.30~0.45 g,批次QY20170828003,由上海奉贤生态蚯蚓养殖场提供。试验开始前,将蚯蚓随机放入盛有未受污染的自然土壤培养箱中,土壤含水质量分数为31%~48%,土壤pH为6.12~6.27,温度在18.2~21.9 ℃,持续光照(400~800 Lux)下进行驯养,适应期大于7 d;在试验开始前一天,将蚯蚓放入人工土壤中驯化24 h,其间蚯蚓无异常情况,说明试材可靠。
1.2 试验方法
1.2.1 种子发芽和根伸长的毒性试验
根据《化学品测试方法 生物系统效应卷》(第2版)299 种子发芽和根伸长的毒性试验规定的方法[13]进行灰黄霉素对种子发芽和根伸长的毒性试验,具体操作方法为:称取2.020 2 g灰黄霉素溶于50 mL二甲基甲酰胺中,得到质量浓度40 000 mg/L的试验母液;吸取试验母液0.5、2.5、5.0和10.0 mL,分别用离子水定容至2 000 mL,配制成质量浓度分别为10、50、100和200 mg/L的试验溶液,另外设置空白对照和二甲基甲酰胺溶剂对照(5 mL/L);将10种受试植物种子暴露于上述溶液中,每个浓度组和对照组各设1个重复,每一重复用15粒种子,当对照组种子发芽率达到65%、根长达到20 mm时,可结束试验。灰黄霉素对10种植物的发芽抑制率和根伸长抑制率按式(1)和式(2)进行计算:

(1)
根伸长抑制率=(平均根长空白对照-平均根长其他处理)×100/平均根长空白对照
(2)
1.2.2 蚯蚓急性毒性试验
根据《化学品测试方法 生物系统效应卷》(第2版)207 蚯蚓急性毒性试验规定的方法[13]进行灰黄霉素对蚯蚓急性毒性试验,灰黄霉素的含量设定为1 kg干土壤分别含1、10、30、100、300和1 000 mg灰黄霉素,同时设置空白对照。具体操作方法:准确称量0.167 2 g灰黄霉素与99.80 g石英砂混合均匀作为母土1,称取0.333 2、3.333 2和10.000 5 g母土1并分别与石英砂混合至10.00 g后拌入545.56 g(干质量)人工土壤中,分别得到1 kg干土壤含1、10和30 mg灰黄霉素;另准确称量3.000 3 g灰黄霉素与27.00 g石英砂混合均匀作为母土2,称取0.556 1、1.667 2和5.556 3 g母土2并分别与石英砂混合至10.00 g后拌入545.56 g(干质量)人工土壤中,分别得到1 kg干土壤含100、300和1 000 mg灰黄霉素;充分搅拌均匀后,加入一定量去离子水,测试得到土壤含水质量分数在33.3%~34.4%,土壤pH在5.87~6.22;将处理土壤分别转入1 L玻璃杯中并放入受试蚯蚓,然后置于人工气候箱中培养,培养的暴露条件为温度(20±2) ℃、光周期24 h光照、光照强度400~800 Lux、湿度约80%。每个处理设2个平行,每个平行放置10条蚯蚓。空白对照除了不加受试物外,接受同样的处理。
人工土壤的配制:称取2 011.3 g草炭、4 023.9 g高岭黏土和14 037.4 g石英砂,将各组分混合并搅拌均匀,即得到20 072.6 g人工土壤。经测定,人工土壤pH为6.14,含水质量分数为4.7%。
1.2.3 土壤微生物的影响试验
吸取5 mg/mL灰黄霉素溶液1.0、2.5、5.0和10.0 mL,分别与干燥的10.00 g石英砂搅拌均匀,然后边搅拌边加入至基质土壤中,使土壤中灰黄霉素的含量分别达到10、25、50和100 mg/kg,同时设无灰黄霉素的对照。将配制好的土壤放置于人工气候箱中于温度25 ℃、湿度60%下培养,并分别在试验的第0、5、10、20和30 d测定土壤中三大类微生物数量和组成,利用平板菌落计数法对土壤中细菌、放线菌和真菌分别进行计数。
基质土壤的配制:取新鲜土壤5 g并悬浮于50 mL盛有玻璃珠的无菌水中震荡打散;细菌培养选择牛肉膏蛋白胨培养基(牛肉膏3.00 g、蛋白胨10.00 g、NaCl 0.50 g、琼脂15.00~20.00 g、水1 000 mL、pH 7.2~7.4,121 ℃下灭菌20 min;或购置现成的培养基),放线菌培养选择高氏l号培养基(可溶性淀粉20.00 g、KNO3l.00 g、NaCl 0.50 g、K2HPO40.50 g、MgSO40.50 g、FeSO40.01 g、琼脂 20.00 g、水 1 000 mL、pH 7.2~7.4,121 ℃下灭菌20 min;或购置现成培养基),真菌培养选择马丁培养基(葡萄糖10.00 g、蛋白胨5.00 g、KH2PO41.00 g、MgSO4·7H2O 0.50 g、1/3 000孟加拉红100 mL、琼脂15.00~20.00 g、水800 mL,112 ℃下灭菌20 min,临用前加入质量分数0.03%链霉素稀释液100 mL;或购置现成的培养基)。
1.2.4 土壤酶活性影响试验
吸取灰黄霉素(5 mg/mL)溶液1.0、2.5、5.0和10.0 mL,分别与干燥的10.00 g石英砂搅拌均匀,然后边搅拌边加入到土壤中,使土壤中抗生素含量分别达到10、25、50和100 mg/kg,同时设无抗生素的对照。将配制好的土壤放置于人工气候箱中于温度25 ℃、湿度60%下培养,并分别在试验的第0、5、10、20和30 d测定土壤中3种酶的活性。土壤磷酸酶活性测定采用Tabatabai法[14-15],脱氢酶活性测定采用TTC-脱氢酶比色法[16-17],脲酶活性测定采用靛酚蓝比色法[17]。
2 结果与讨论
2.1 灰黄霉素对植物种子发芽抑制率和根伸长抑制率的影响
不同灰黄霉素质量浓度梯度对10种植物种子发芽抑制率的试验结果(图1)表明:溶剂对照(即灰黄霉素质量浓度为0 mg/L)的10种受试植物的发芽率均在90%以上;受灰黄霉素的影响,青菜、甘蓝、洋葱和白菜的发芽率略有降低,其余6种植物受灰黄霉素的影响不大,甚至在灰黄霉素存在的情况下发芽率高于溶剂对照;不同浓度的灰黄霉素对10种受试植物的种子发芽抑制率都低于50%。
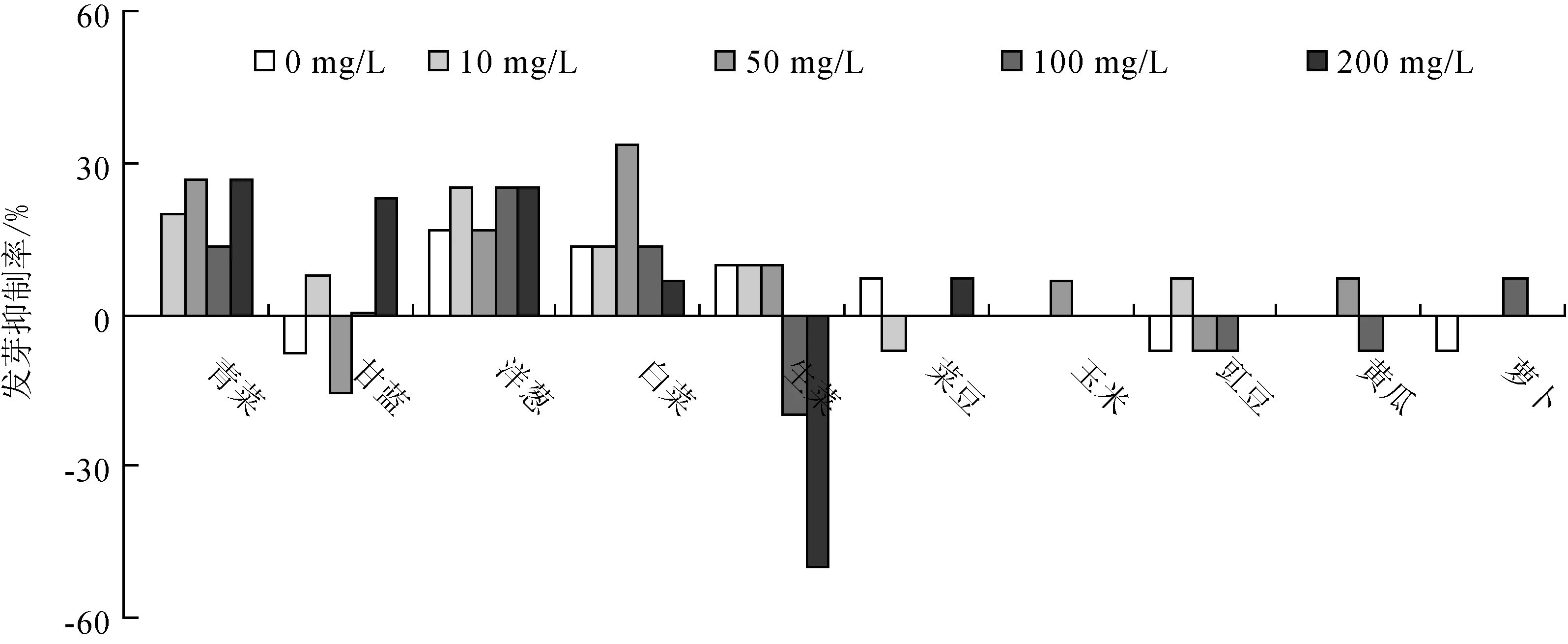
图1 不同灰黄霉素质量浓度梯度对10种植物种子发芽抑制率的影响
不同灰黄霉素浓度梯度对10种植物根伸长抑制率的试验结果(图2)表明:灰黄霉素对甘蓝、白菜和生菜的根伸长抑制率在10%~40%,对其余7种植物的根伸长抑制率没有明显的规律,甚至在某些浓度下还有促进作用;在灰黄霉素质量浓度控制在200 mg/L以内时,不同质量浓度的灰黄霉素对10种植物的根伸长抑制率均小于50%,这表明在此浓度范围内的灰黄霉素对植物根伸长抑制作用不显著。根据中国环保部化学品登记中心《化学品测试方法 生物系统效应卷》(第2版)299种子发芽和根伸长的毒性试验的规定,表明在200 mg/L范围内灰黄霉素对植物的毒性甚微。
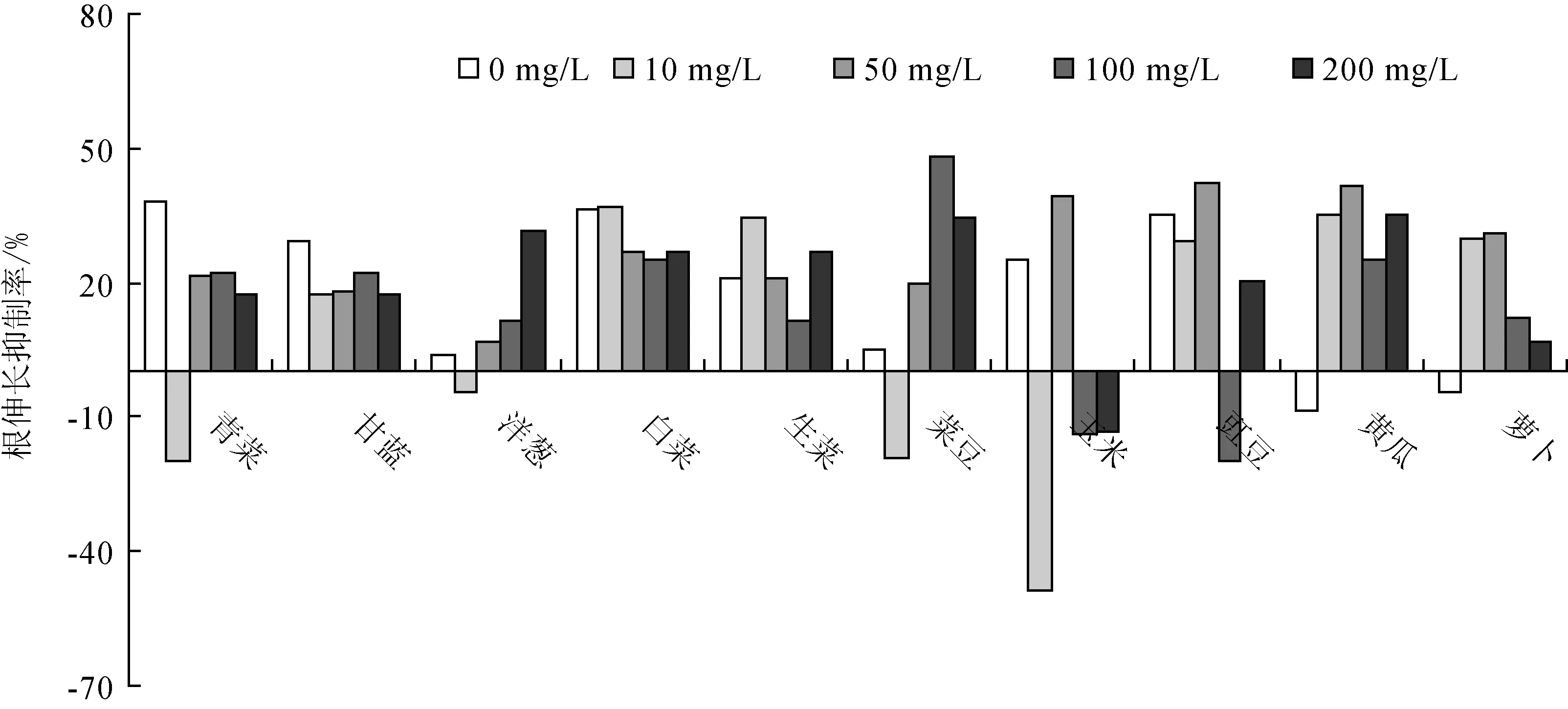
图2 不同灰黄霉素质量浓度梯度对10种植物根伸长抑制率的影响
2.2 灰黄霉素对蚯蚓急性毒性的影响
不同含量灰黄霉素处理对蚯蚓毒性症状及累积死亡率的试验结果(表2)表明,在1 kg干土壤含1、10、30、100、300和1 000 mg灰黄霉素的条件下,经7 d和14 d症状观察,各组供试蚯蚓未表现出明显的中毒症状并均无死亡。由此可知,灰黄霉素对蚯蚓的急性毒性:14 d半致死含量(14d-LC50)>1 000 mg/kg,14 d死亡率为0%的最高含量(14d-LC0)≥1 000 mg/kg,14 d死亡率为100%的最低含量(14d-LC100)>1 000 mg/kg。
表2 不同含量灰黄霉素处理对蚯蚓毒性症状及累积死亡率的试验结果
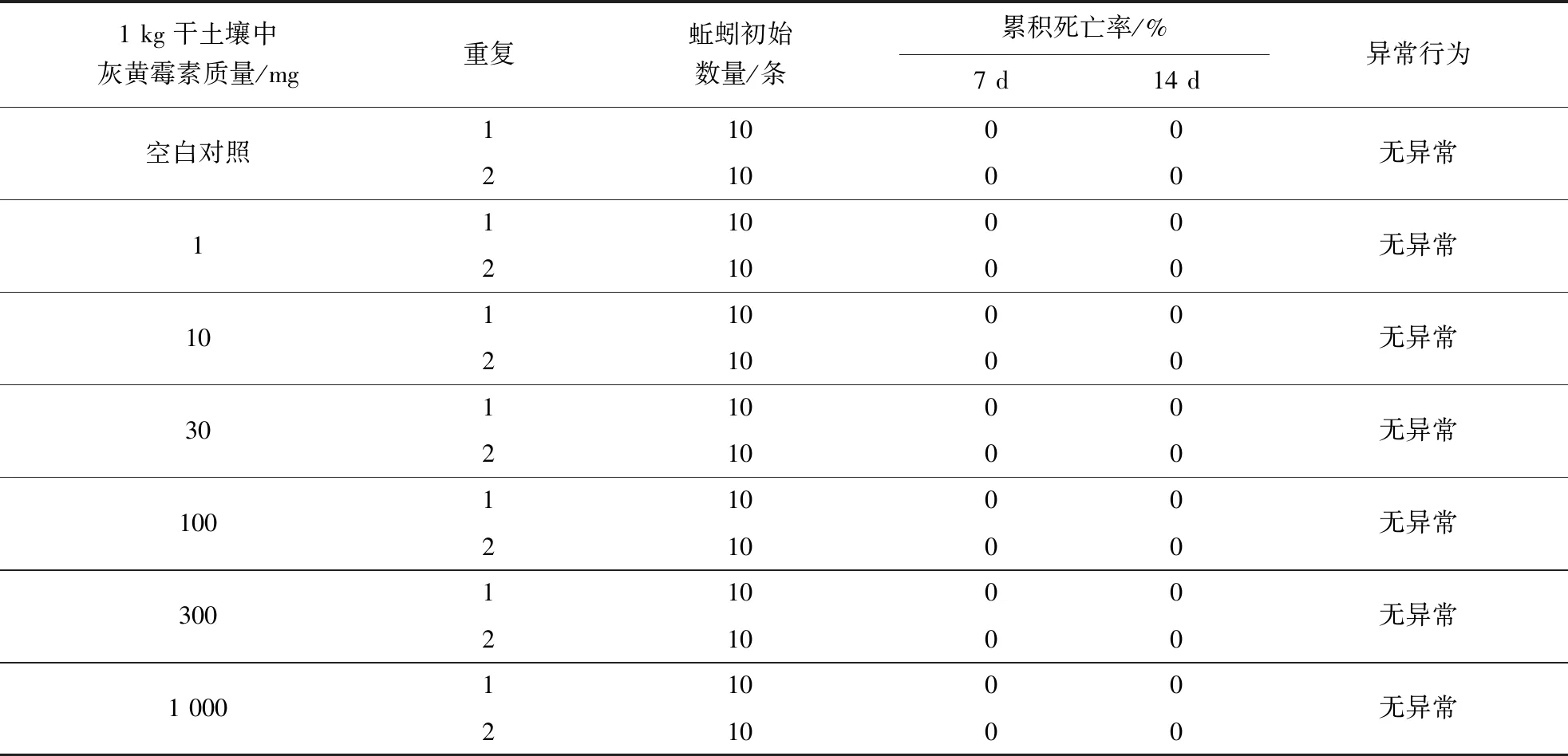
1 kg干土壤中灰黄霉素质量/mg重复蚯蚓初始数量/条累积死亡率/%7 d14 d异常行为空白对照1100021000无异常11100021000无异常101100021000无异常301100021000无异常1001100021000无异常3001100021000无异常1 0001100021000无异常
2.3 土壤微生物群落组成与灰黄霉素的剂量关系
将不同含量的灰黄霉素加入土壤中培养,利用选择性培养基在不同培养时间分别对细菌、真菌和放线菌计数,以培养时间为横坐标、菌落总数为纵坐标作图,研究灰黄霉素与微生物群落组成之间的剂量-效应关系随培养时间的动力学变化规律,结果如图3所示。
从图3可看出:在培养过程中,细菌、真菌和放线菌数量的变化范围分别是740.0、770.0和5.1万个/g;加入灰黄霉素之后,明显改变了土壤微生物的群落结构,尤其是细菌受到药物抑制的影响更大,最明显的抑制效果出现在培养的第5 d,暴露于10、25、50和100 mg/kg灰黄霉素下的土壤中细菌数量分别下降了23%、31%、59%和64%;随着培养时间的延长,抑制作用随灰黄霉素含量的增加而提高。
灰黄霉素是一种抗真菌抗生素,从图3(b)中可以看出真菌的变化趋势,试验中设置的灰黄霉素含量均影响了真菌的生长。在培养的第5 d,10、25、50和100 mg/kg的灰黄霉素对真菌的抑制率分别为75%、78%、83%和50%;在培养的第10 d,所有含量水平的灰黄霉素对真菌的抑制率都达50%以上;虽然在第30 d真菌的数量有所回升,但灰黄霉素的抑制作用仍然很大。
从图3(c)可以看出放线菌的变化趋势,在整个培养期间,灰黄霉素对土壤放线菌的抑制作用从前期影响不明显到后期影响较大,并且含量大于25 mg/kg的试验处理对放线菌的抑制效果明显。在培养的第10 d,10、25、50和100 mg/kg的灰黄霉素对放线菌的抑制率分别为17%、20%、58%和40%;在培养30 d后,不同含量水平的灰黄霉素对放线菌的抑制率分别达到了17%、42%、84%和86%。
2.4 灰黄霉素对土壤酶活性的影响
将不同含量的灰黄霉素加入土壤中培养,在每个培养时间段均进行了磷酸酶、脲酶和脱氢酶的活性测定,以培养时间为横坐标、酶活性为纵坐标作图,研究灰黄霉素对土壤中这3种酶活性的影响,结果如图4所示。


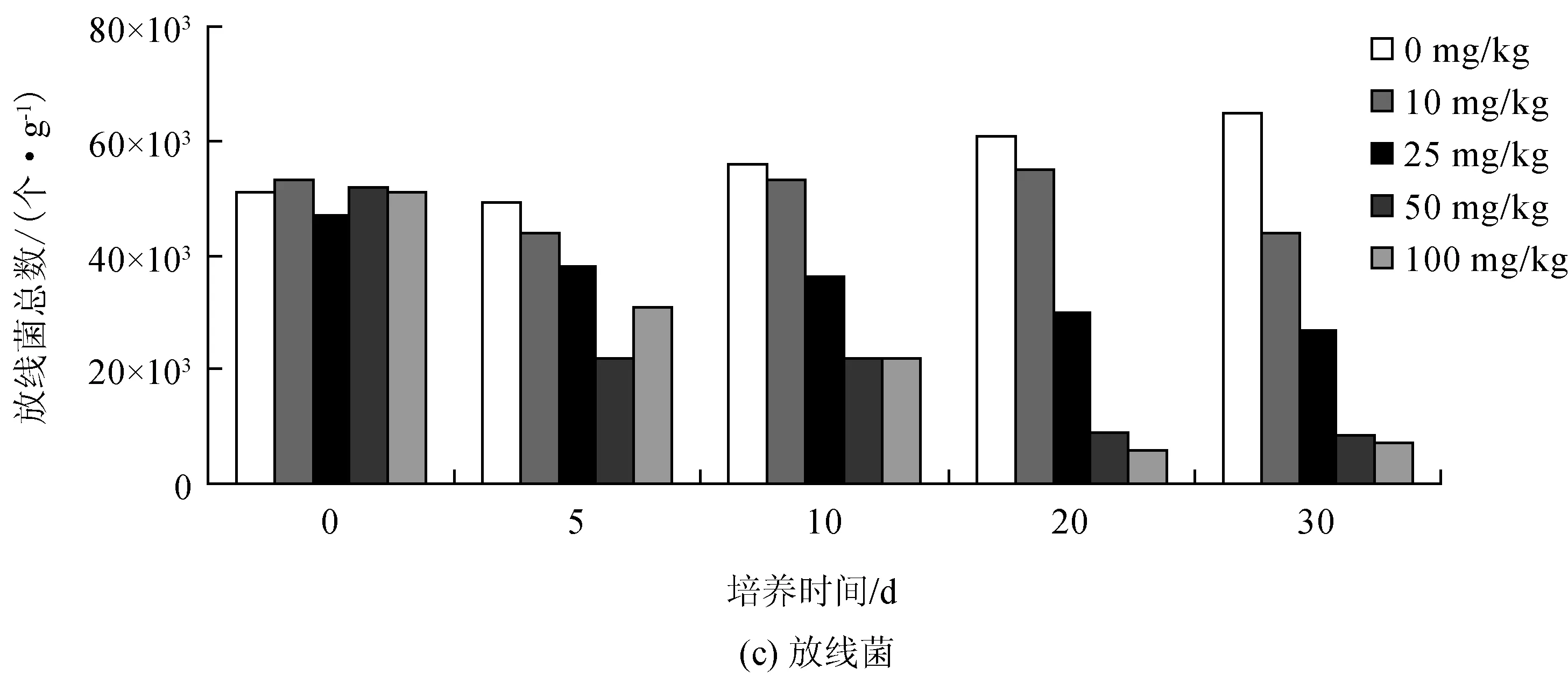
图3 暴露于不同灰黄霉素含量下的土壤微生物群落变化情况
从图4(a)可以看出:不同含量的灰黄霉素对土壤中磷酸酶活性的影响作用不大,但随着灰黄霉素含量的增大,酶活性下降;磷酸酶活性降低最明显的时间在培养的第20 d,暴露于不同含量灰黄霉素下的磷酸酶活性下降了21%~42%,在培养的第30 d时酶活性有所恢复。由于细菌和放线菌是土壤磷酸酶的主要提供者,在不同含量灰黄霉素的作用下,磷酸酶的活性变化与细菌、放线菌的群落变化数很相似。
由于灰黄霉素是一种非多烯类的抗真菌抗生素,而脲酶又主要是由真菌提供的,从图4(b)中可看出,灰黄霉素对脲酶的抑制效果很明显。加入灰黄霉素之后,土壤中脲酶的活性下降得很快,并随着培养时间的推移,灰黄霉素对脲酶的抑制率逐渐增大。最明显的抑制效果出现在培养的第10 d,暴露于10、25、50和100 mg/kg灰黄霉素下的脲酶活性分别下降了24%、39%、38%和52%,并且随着时间的推移,抑制效率基本保持不变。
对于脱氢酶来说,灰黄霉素对脱氢酶的活性影响趋势是先提高脱氢酶的活性,然后抑制脱氢酶的活性,而到了培养的第30 d,低含量的灰黄霉素仍然提高了脱氢酶的活性。

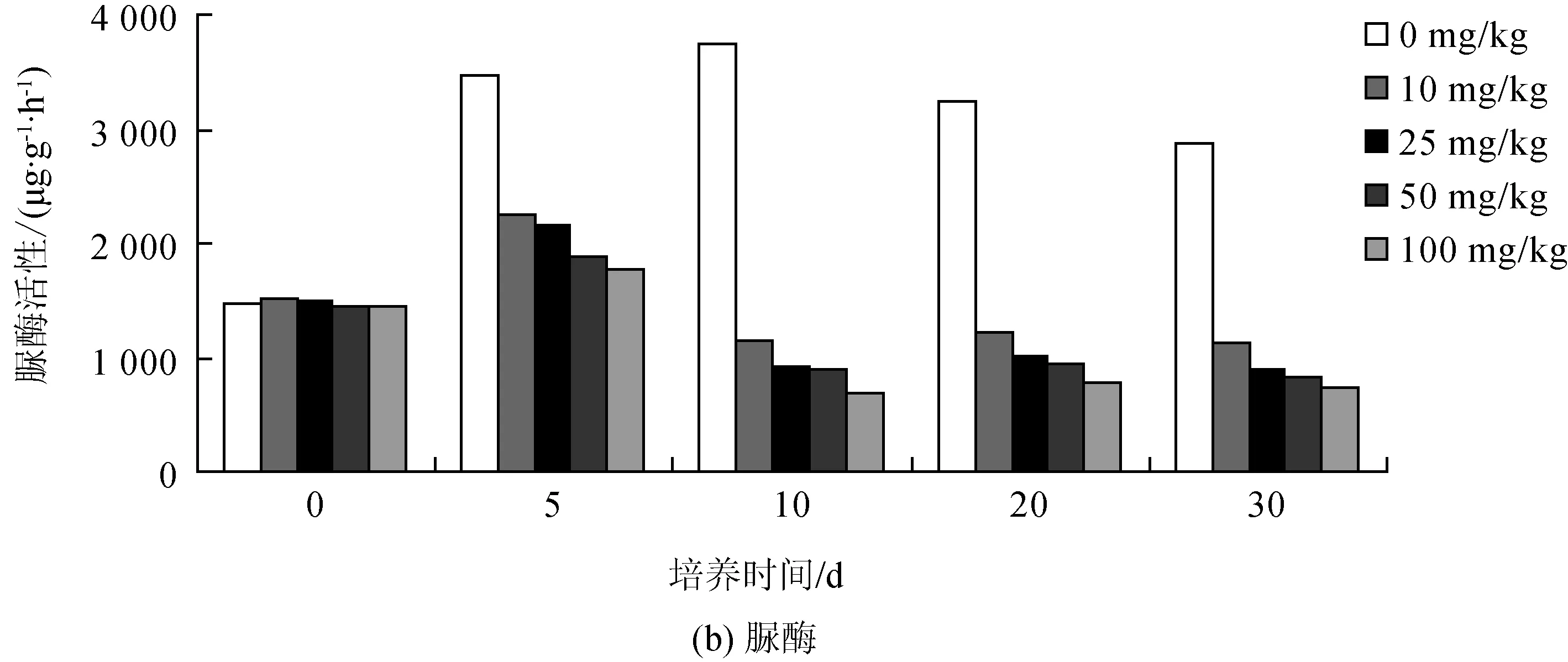
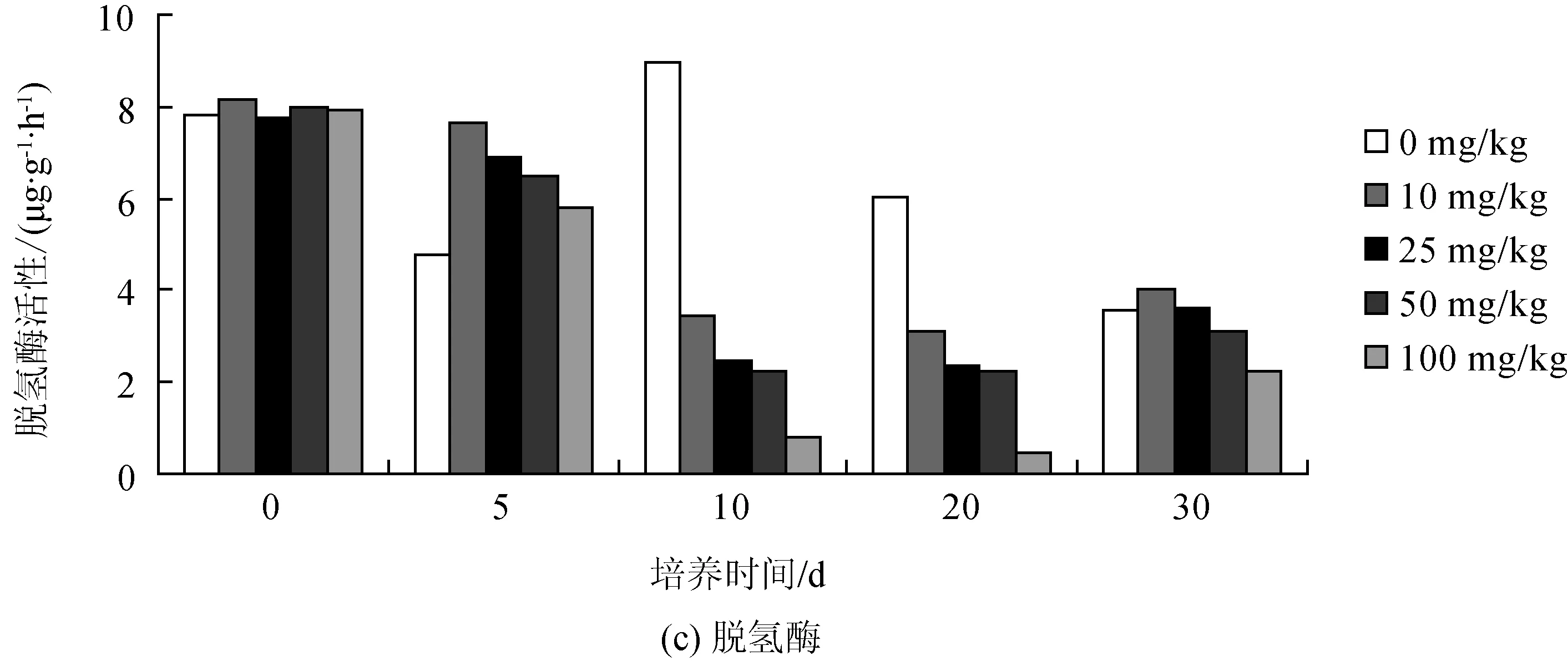
图4 暴露于不同灰黄霉素含量下土壤酶活性变化情况
3 结语
以植物、动物、微生物和酶活性为研究对象,试验研究了灰黄霉素对植物种子发芽和根伸长毒性的影响、对蚯蚓急性毒性的影响、对土壤微生物群落组成以及对土壤酶活性的影响,主要得出如下结论。
(1) 在200 mg/L浓度范围内的灰黄霉素对10种不同植物种子的发芽率和根伸长毒性没有明显变化,种子发芽抑制率和根伸长抑制率都在50%以内,故在200 mg/L范围内灰黄霉素对植物的毒性甚微。
(2) 在1 kg干土壤含0~1 000 mg灰黄霉素范围内,对蚯蚓生长的影响并无显著的剂量-效应关系,蚯蚓的14 d半致死含量(14d-LC50)>1 000 mg/kg,14 d死亡率为0%的最高含量(14d-LC0)≥1 000 mg/kg,14 d死亡率为100%的最低含量(14d-LC100)>1 000 mg/kg。
(3) 灰黄霉素加入到土壤中后,土壤微生物的群落结构发生了明显的变化,随着培养时间的推移,灰黄霉素对细菌、真菌、放线菌的抑制作用随灰黄霉素含量的增加而提高,并且对三类微生物的影响关系是细菌>放线菌>真菌。
(4) 不同含量的灰黄霉素对土壤中磷酸酶活性的影响作用不大,但随着灰黄霉素含量的增大,磷酸酶活性下降。灰黄霉素对脲酶的抑制作用比较大,并且随着灰黄霉素含量的增大抑制作用加强,持续作用的时间也较长。对于脱氢酶来说,灰黄霉素对脱氢酶的活性影响趋势是先提高其活性,然后抑制其活性。
