2型糖尿病肾病患者血清α1-MG、KNG1、KLK1与细胞因子及肾功能的相关性分析
2019-11-01吉雅菲
吉雅菲
(三门峡市中心医院肾内科,河南 三门峡 472000)
流行病学研究显示,糖尿病肾病(DN)发病率呈现出逐步升高的态势,长期临床随访研究显示,DN发病率可达234~455/10万人左右[1]。临床上DN病情持续性进展,能够导致患者终末期肾功能衰竭[2]。α1-微球蛋白(α1MG)在正常尿液中含量较少,在肾小球滤过膜明显损伤的人群中,由于肾脏基底膜通透性改变,α1-MG表达可明显上升[3]。激肽原1(KNG1)和激肽释放酶(KLK1)均是影响激肽释放系统的重要因子,两者均能够通过增加氧化应激性损伤、肾小球基底膜自身免疫性损伤等加剧基底膜滤过功能的下降[4,5]。本研究即旨在观察DN患者血清 α1-MG、KNG1、KLK1水平,并分析其临床意义,现报告如下。
1 资料与方法
1.1 一般资料 选取2015年8月-2017年5月在我院接受治疗的2型糖尿病患者为研究对象。纳入标准:年龄≥18周岁;符合中华医学会2型糖尿病的诊断标准;无其他系统严重疾病者。排除标准:临床资料不全者;合并其他肾脏疾病者。根据纳入、排除标准共纳入病例数120例,T2DM组60例,男 38例,女 22例,年龄 48~72岁,平均 59.23±3.45岁,病程 2~11年,平均 6.98±1.32年;DN 组 60例,男 35例,女 25例,年龄 45~78岁,平均 59.25±4.03岁,病程2~10年,平均7.02±1.13年。 对照组纳入标准:年龄≥18周岁;无糖尿病、肾脏系统严重疾病者,共纳入60例,男30例,女30例,年龄45~70岁,平均59.25±3.16岁。三组患者的年龄、性别等比较差异无统计学意义(P>0.05),具有可比性。本项研究经医院伦理委员会评审通过,且所有患者均知情同意。
1.2 检测方法 在入院后第二天常规采集患者肘部静脉血4ml,自然凝固后离心分离血清,-20℃放置冰箱保存。采用贝克曼库尔特公司生产的DX800免疫发光仪器及配套试剂进行α1-MG、KNG1、KLK1检测,室内质量控制符合标准。eGFR计算公式如下:eGFR(ml/min/1.73m2)=(186Scr)-1.154×(年龄)-0.203×0.742(女性)[3]。
1.3 统计学处理 采用SPSS 11.5软件进行分析。三组研究对象计量资料比较采用单因素方差分析、两两比较q检验,血清α1-MG等指标与其他指标的相关性分析采用Pearson相关分析法,P<0.05为差异有统计学意义。
2 结果
2.1 三组研究对象各指标的比较 DN组血清α1-MG、KNG1、KLK1、BUN、Cr、FPG、IL-6、hs-CRP、TNF-α水平显著高于T2DM组、对照组(P<0.05),eGFR显著低于T2DM组、对照组(P<0.05)。T2DM组血清 α1-MG、KNG1、KLK1、BUN、Cr、FPG、IL-6、hs-CRP、TNF-α 水平显著高于对照组 (P<0.05),eGFR 显著低于对照组(P<0.05)。 见表 1、表 2、表 3。2.2糖尿病肾病患者血清α1-MG等指标与其他指标的相关性分析 糖尿病肾病患者血清α1-MG、KNG1、KLK1 水平与其血清 BUN、Cr、FPG、IL-6、hs-CRP 和 TNF-α 水平均呈显著正相关(P<0.05),而与eGFR均呈显著负相关(P<0.05),见表4。
表1 三组研究对象α1-MG、KNG1、KLK1水平的比较()
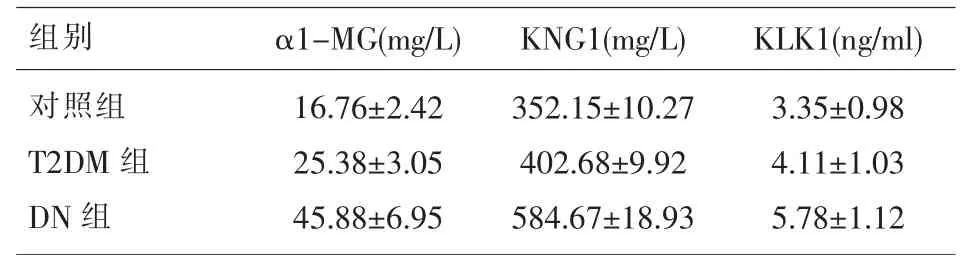
表1 三组研究对象α1-MG、KNG1、KLK1水平的比较()
组别 α1-MG(mg/L) KNG1(mg/L) KLK1(ng/ml)对照组T2DM组DN组16.76±2.42 25.38±3.05 45.88±6.95 352.15±10.27 402.68±9.92 584.67±18.93 3.35±0.98 4.11±1.03 5.78±1.12
表2 三组研究对象肾功能指标的比较()

表2 三组研究对象肾功能指标的比较()
组别 BUN(mmol/L)SCr(μmol/L)eGFR(mL/min/1.73m2)对照组T2DM组DN组5.03±1.05 8.69±1.23 14.35±2.02 38.15±3.72 45.38±5.03 122.48±10.17 112.79±9.77 101.63±8.34 52.46±4.28
表3 三组研究对象FPG和细胞因子水平的比较()
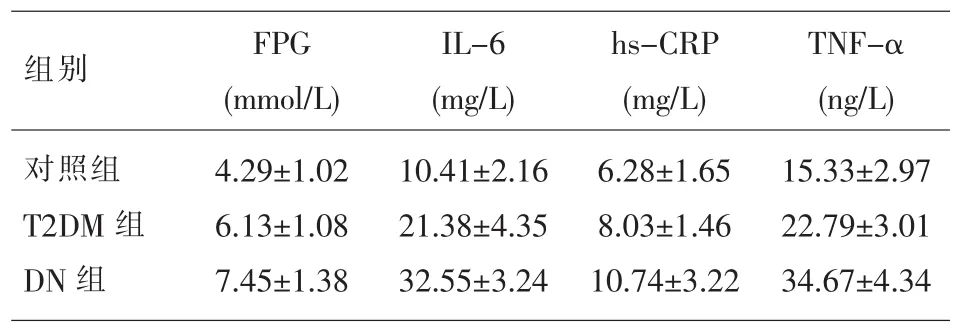
表3 三组研究对象FPG和细胞因子水平的比较()
组别 FPG(mmol/L)IL-6(mg/L)hs-CRP(mg/L)TNF-α(ng/L)对照组T2DM组DN组4.29±1.02 6.13±1.08 7.45±1.38 10.41±2.16 21.38±4.35 32.55±3.24 6.28±1.65 8.03±1.46 10.74±3.22 15.33±2.97 22.79±3.01 34.67±4.34
3 讨论
DN与长期血糖控制不佳导致患者肾单位局部氧化应激损伤密切相关,特别是在具有相关高危因素的人群中,DN发病率更高[6-8]。α1-MG羧基末端结构上包含了多个可结合的结构,当其结合肾小球基底膜细胞上的配体后,能够快速诱导局部下游炎症因子富集,增加炎症反应风险。基础方面研究也显示,α1-MG在破坏肾小管上皮细胞的完整性方面具有一定的作用,其可直接性损伤近端小管、远端小管,从而导致后者重吸收障碍[9,10]。KNG1、KLK1则能够提高缓激肽的浓度及活性,进一步改变局部氧化应激性指标,从而破坏基底膜组织的完整性,造成足突细胞形态改变[11,12]。此外,KNG1、KLK1还能够影响肾小球滤过膜硫酸盐电荷,降低负电荷含量,从而影响代谢废物的滤过作用。
本次研究发现,DN患者血清α1-MG、KNG1、KLK1等指标均存在较为明显的高表达趋势,分析其原因,血清α1-MG上升与肾脏远曲小管的重吸收增加有关,而血清KNG1、KLK1上升则考虑激肽酶激活,缓激肽分解释放增加有关[13]。细胞炎症因子在直接损伤肾小球功能过程中发挥了重要的作用。本次研究中,DN组患者血清中白细胞介素6(IL-6)、超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)水平均明显上升,这考虑患者体内炎症反应激活所致。值得注意的是,过度上升的炎症因子对血管内皮细胞的损伤、局部肾小球系膜血管平滑肌的痉挛作用、血流灌注的障碍等,均能够进一步增加DN患者临床预后的恶化风险。
本研究结果显示,DN患者血清 α1-MG、KNG1、KLK1水平与患者肾功能指标、炎症因子指标密切相关,这提示了血清α1-MG、KNG1、KLK1水平与患者病情具有一定的相关性,因此临床上可以检测这些指标,进而评估DN患者的病情进展。综上所述,糖尿病肾病患者的α1-MG、KNG1、KLK1水平较高,其与肾功能、血糖和细胞因子等水平密切相关。
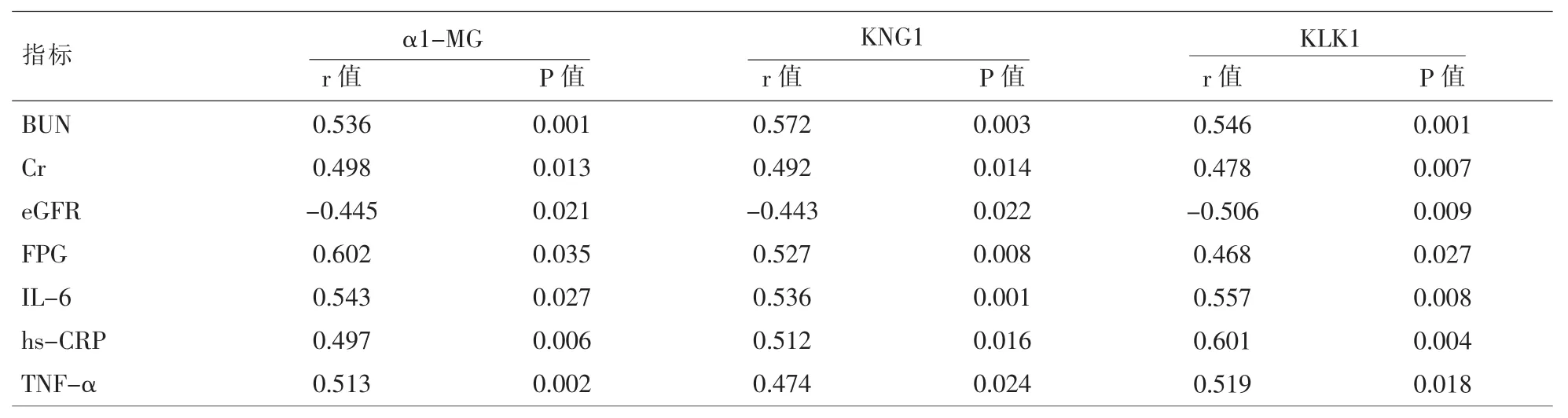
表4 糖尿病肾病患者血清α1-MG等指标与其他指标的相关性分析
