四水合氯化亚铁晶体流态化煅烧过程实验研究
2019-11-01郑燕萍张许力邱树锋2杨阿三
郑燕萍,张许力,邱树锋2,程 榕,王 玲,杨阿三,孙 勤
(1.浙江工业大学 化学工程学院,浙江省生物燃料利用技术研究重点实验室,浙江 杭州 310014;2.杭州中昊科技有限公司,浙江 杭州 311102)
冶金行业酸洗过程将产生大量含氯化亚铁酸性废液,直接排放会造成环境污染。自20世纪70年代,中国冶金行业陆续从国外引进Lurgi-Keramchemie和Ruthner废盐酸再生工艺[1],Lurgi-Keramchemie废盐酸再生工艺[2]是将浓缩废酸液送入流化床直接煅烧,Ruthner废盐酸再生工艺[3]是将浓缩废酸液喷入喷雾煅烧室进行煅烧。这两种工艺均采用溶液直接煅烧,存在投资大、运行成本高和占地面积大等缺点[4-5]。因此提出将酸性废液浓缩、结晶,得到四水合氯化亚铁晶体,晶体流态化煅烧[6]生成氧化铁粉体,尾气经吸收得HCl溶液的循环利用工艺。
胡熙恩等[7]用固定床反应器研究了二水合氯化亚铁焙烧过程反应动力学,文中提及焙烧过程除氧化生成HCl和氧化铁的反应外,可能存在生成Cl2的副反应。王玲等[8]研究了四水合氯化亚铁晶体流态化煅烧过程,实验过程发现当空气湿含量较低时,四水合氯化亚铁晶体流态化煅烧过程生成较大量Cl2。从工业应用角度,煅烧后尾气采用低浓度HCl溶液吸收得到浓度较高的HCl溶液循环利用,而Cl2的产生在吸收过程中将导致生成HClO,有必要考察四水合氯化亚铁晶体流态化煅烧过程中工艺条件对HCl,Cl2生成状况及HCl选择性的影响,为进一步工程应用研究提供基础数据。
1 实验内容和装置
1.1 实验内容
四水合氯化亚铁晶体煅烧反应可表示为
4FeCl2·4H2O(s)+O2(g)→
2Fe2O3(s)+8HCl(g)+12H2O(g)
(1)
4FeCl2·4H2O(s)+3O2(g)→
2Fe2O3(s)+4Cl2(g)+16H2O(g)
(2)
实验用原料为西陇化工股份有限公司生产的四水合氯化亚铁晶体,蓝绿色,颗粒密度1.93 g/cm3,经筛分实验选用平均粒径为0.74 mm的晶体。实验参数选择:表观气速0.73 m/s(室温),床层温度295~500 ℃,空气湿含量(y)29~71 g/kg。
1.2 实验设备和流程
图1为实验流程图,根据实验流程将实验装置分为三个部分,分别是进风装置、煅烧装置和尾气处理装置。其中01~08为进风装置,调节风速、进风温度和湿度;09~14为煅烧装置,对原料进行流态化煅烧;17~19为尾气处理装置,充分吸收尾气中有害气体再排入大气。
实验流程:开启鼓风机送入空气,通过转子流量计控制风速,空气经电加热器A加热、增湿罐增湿、电加热器B加热后进入流化床煅烧炉。管式炉将床层加热至实验温度后,从煅烧炉顶部加入物料进行流态化煅烧,生成的氧化铁粉体由旋风分离器收集,尾气被取样装置取样分析后进入尾气处理装置,最后排入大气。

01—鼓风机;02—调节阀;03—转子流量计;04—电加热器A;05—增湿罐;06—温湿仪;07—排水阀;08—电加热器B;09—分布板;10—管式炉;11—流化床煅烧炉;12—加料口;13—旋风分离器;14—集料斗;15—取样泵;16—湿式流量计;17—循环泵;18—尾气填料吸收塔;19—丝网除雾器;T—测温点;P—测压口;A—取样口。图1 实验流程图Fig.1 Experimental flowchart
1.3 实验方法及分析
实验开始时,按顺序启动鼓风机、电加热器A、电加热器B、管式炉、湿式流量计及循环泵,控制进流化床煅烧炉空气流量及湿含量。待床层温度达到实验温度后,加入称量好的物料同时打开取样泵连续取样,根据实验安排定时记录煅烧过程中各点温度、压力或湿度。
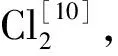
吸收的HCl质量使用高精度分析天平,由称量法得到[11],Cl2物质的量经样品定容,用氯离子选择电极PCl-1-01和参比电极测定溶液中氯离子浓度[12-13]得到。由此得到各反应时间生成的HCl物质的量(nHCl)、Cl2物质的量(nCl2)、HCl生成速率(rHCl)、Cl2生成速率(rCl2)、HCl选择性(SHCl/Cl2),相应计算式为
(3)
(4)
SHCl/Cl2=rHCl/rCl2
(5)
(6)
(7)
式中:m0为四水合氯化亚铁晶体原料质量,g;V为样品定容后溶液体积,L;C为定容后溶液中氯离子浓度,mol/L;t为取样吸收时间,min;m1为吸收的HCl质量,g;MHCl为HCl相对分子质量,g/mol;Vm为气体摩尔体积,L/mol;V湿为取样吸收时间内湿式气体流量计记录体积,L。数据处理过程中所有体积示数都经温度、压力校核。
2 实验结果与讨论
2.1 空气湿含量对煅烧过程的影响
称取38.5 g平均粒径为0.74 mm的四水合氯化亚铁晶体,控制流化床床层温度500 ℃,表观气速0.73 m/s(室温),研究不同空气湿含量下煅烧生成HCl和Cl2物质的量、HCl和Cl2生成速率及HCl选择性随煅烧时间的变化。
图2为不同空气湿含量下生成HCl物质的量随煅烧时间变化曲线。图3为不同空气湿含量下HCl生成速率随煅烧时间变化曲线。从图2看到:随着煅烧时间增加,生成HCl物质的量增大,煅烧初期生成HCl物质的量随时间增加较快,后期趋于缓和至稳定;相同煅烧时间,生成HCl物质的量随空气湿含量增大而增大。从图3看到:HCl生成速率随煅烧时间增加而减小,反应初期HCl生成速率随时间衰减较快,后期趋于缓和直至为零;相同煅烧时间,空气湿含量越大,HCl生成速率越大。当空气湿含量≤36 g/kg时,HCl生成速率很小,而且只在煅烧开始15 min有HCl生成,15 min以后,HCl生成速率为零。表明水蒸气对煅烧生成HCl有促进作用,空气湿含量越高,四水合氯化亚铁晶体煅烧越易生成HCl,即遵循反应方程(1),HCl生成速率越大,生成HCl物质的量越多。
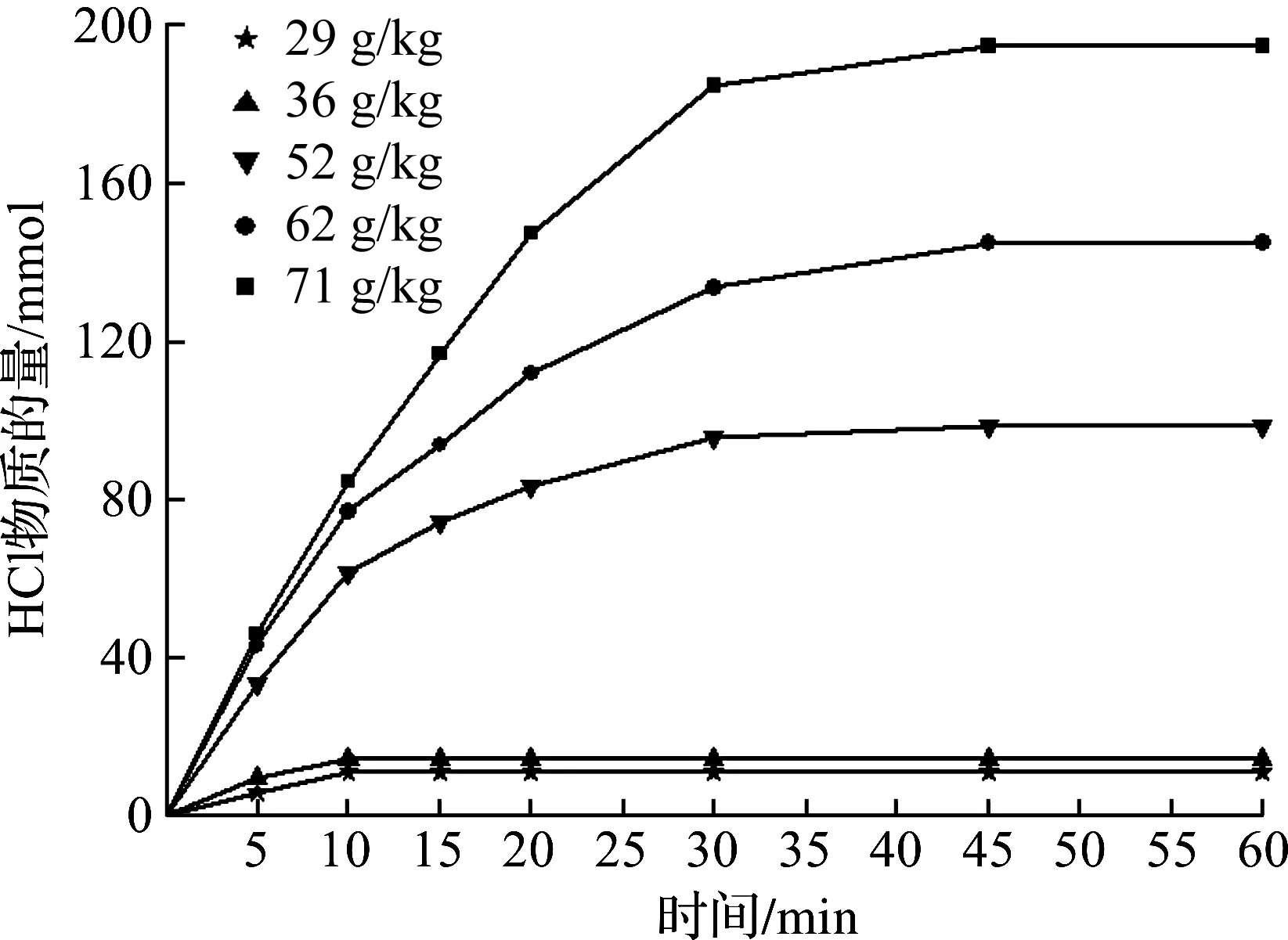
图2 不同空气湿含量下生成HCl物质的量随煅烧时间变化曲线Fig.2 Variation of the amount of substance for HCl with reaction time at different air moisture contents
图3 不同空气湿含量下HCl生成速率随煅烧时间变化曲线Fig.3 Variation of the HCl generation rate with reaction time at different air moisture contents
图4为不同空气湿含量下生成Cl2物质的量随煅烧时间变化曲线。图5为不同空气湿含量下Cl2生成速率随煅烧时间变化曲线。从图4看到:随着煅烧时间增加,生成Cl2物质的量增大,反应初期生成Cl2物质的量随时间增加较快,后期趋于缓和至稳定;相同煅烧时间,生成Cl2物质的量随空气湿含量增大而减小。从图5看到:Cl2生成速率随煅烧时间增加先增大再减小,在10~15 min内出现极值,之后Cl2生成速率逐渐减小,直至为零;相同煅烧时间,空气中湿含量越小,Cl2的生成速率越大。表明水蒸气对煅烧生成Cl2反应有抑制作用,空气湿含量越小,四水合氯化亚铁晶体煅烧越易生成Cl2,即遵循反应方程(2),Cl2生成速率越大,生成Cl2物质的量越多。煅烧初始10~15 min,体系中水蒸气除空气湿含量外还有四水合氯化亚铁晶体中的结晶水,抑制Cl2生成,使Cl2生成速率较小。随着煅烧进行,结晶水被逐渐脱除,体系中水蒸气量减小,Cl2生成速率逐渐增大出现极值,之后随反应进行,反应物减少,Cl2生成速率逐渐减小。

图4 不同空气湿含量下生成Cl2物质的量随煅烧 时间变化曲线Fig.4 Variation of the amount of substance for Cl2 with reaction time at different air moisture contents

图5 不同空气湿含量下Cl2生成速率随煅烧时间 变化曲线Fig.5 Variation of the Cl2 generation rate with reaction time at different air moisture contents
表1为不同空气湿含量下HCl选择性随煅烧时间变化数据。从表1中看到:相同煅烧时间,空气湿含量越高,HCl选择性越大;空气湿含量为71 g/kg时,煅烧初始HCl选择性>5,随着煅烧进行,HCl选择性迅速减小,煅烧15 min后,HCl选择性大约稳定在2;空气湿含量≤36 g/kg时,煅烧初始HCl选择性<0.5,15 min之后HCl选择性为0,即无HCl生成。比较反应方程(1,2)可以看到:生成HCl需消耗水蒸气,因此,体系中水蒸气能促进HCl生成;空气湿含量大,有利于HCl生成,HCl选择性大。煅烧初始的10~15 min,体系中水蒸气除空气湿含量外还有四水合氯化亚铁晶体中的结晶水,随煅烧进行结晶水被逐渐脱除,HCl选择性由最大值逐渐减小至某一定值。空气湿含量≤36 g/kg时,只在煅烧初期因结晶水参与生成少量HCl。
表1 不同空气湿含量下HCl选择性SHCl/Cl2随煅烧时间变化
Table 1 Variation of the HCl selectivity(SHCl/Cl2) at different air moisture contents
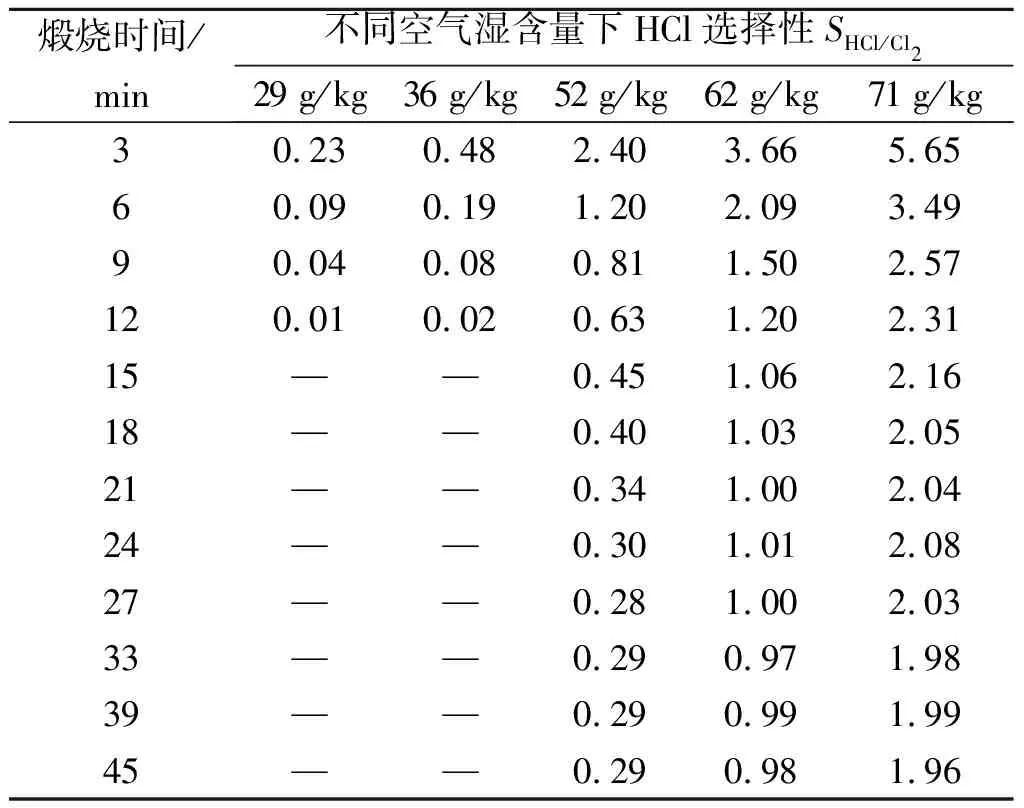
煅烧时间/min不同空气湿含量下HCl选择性SHCl/Cl229 g/kg36 g/kg52 g/kg62 g/kg71 g/kg30.230.482.403.665.6560.090.191.202.093.4990.040.080.811.502.57120.010.020.631.202.3115——0.451.062.1618——0.401.032.0521——0.341.002.0424——0.301.012.0827——0.281.002.0333——0.290.971.9839——0.290.991.9945——0.290.981.96
2.2 床层温度对煅烧过程的影响
称取38.5 g平均粒径为0.74 mm的四水合氯化亚铁晶体,控制空气湿含量为62 g/kg,表观气速为0.73 m/s(室温),研究不同床层温度下反应煅烧HCl和Cl2物质的量、HCl和Cl2生成速率及HCl选择性随煅烧时间的变化。
图6为不同床层温度下生成HCl物质的量随煅烧时间变化曲线。图7为不同床层温度下HCl生成速率随煅烧时间变化曲线。
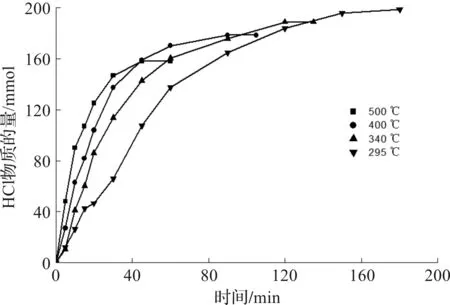
图6 不同床层温度下生成HCl物质的量随煅烧时间变化曲线Fig.6 Variation of the amount of substance for HCl with reaction time at different bed temperatures
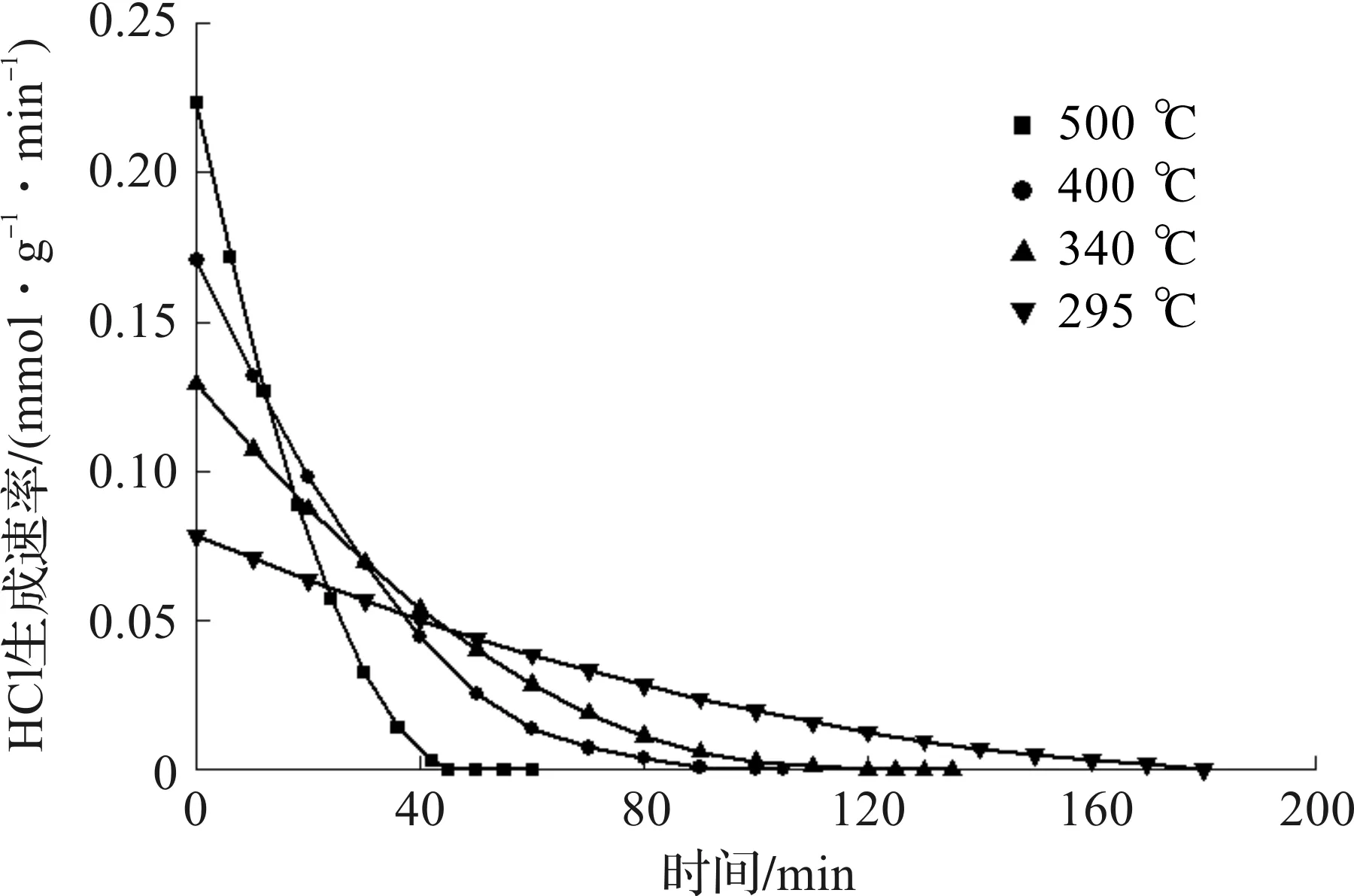
图7 不同床层温度下HCl生成速率随煅烧时间变化曲线Fig.7 Variation of the HCl generation rate with reaction time at different bed temperatures
从图6看到:煅烧初期,HCl物质的量随煅烧时间增加迅速增大,随即趋于平缓达稳定,即煅烧结束;床层温度越高,煅烧所需时间越短,当床层温度为500 ℃时,45 min完成煅烧,生成HCl物质的量最少。从图7看到:床层温度越高,煅烧初期HCl生成速率越大,HCl生成速率随时间衰减越快。根据阿伦尼乌斯方程[14],床层温度越高,速率常数越大,HCl生成速率越大,相同煅烧时间生成HCl物质的量就越大,煅烧所需时间越短。床层温度越高,四水合氯化亚铁晶体脱结晶水速率也越快,结晶水消失对HCl生成不利,HCl生成速率随时间衰减越快,导致床层温度越高,煅烧过程最终生成的HCl物质的量越小。
图8为不同床层温度下生成Cl2物质的量随煅烧时间变化曲线。图9为不同床层温度下Cl2生成速率随煅烧时间变化曲线。从图8看到:生成Cl2物质的量随煅烧时间增加而增大,床层温度越高,煅烧生成Cl2物质的量越大。从图9看到:随煅烧时间增加Cl2生成速率先增大后减小,存在极值点;床层温度越高,达极值点所需时间越短,峰值越大,床层温度500 ℃时,10~15 min达到极值;床层温度295 ℃时,40~45 min达到极值。根据阿伦尼乌斯方程[14],床层温度越高,速率常数越大,Cl2生成速率越大,相同煅烧时间生成Cl2物质的量越大。床层温度越高,四水合氯化亚铁晶体脱结晶水速率也越快,结晶水脱除对Cl2生成有利,Cl2生成速率达极值所需时间越短,最终生成Cl2物质的量越大。

图8 不同床层温度下生成Cl2物质的量随煅烧时间变化曲线Fig.8 Variation of the amount of substance for Cl2 with reaction time at different bed temperatures

图9 不同床层温度下Cl2生成速率随煅烧时间变化曲线Fig.9 Variation of the Cl2 generation rate with reaction time at different bed temperatures
表2为不同床层温度下HCl选择性随煅烧时间变化数据。从表2中看到:煅烧初期,HCl选择性较大,逐渐减小至平稳;床层温度越高,HCl选择性越小,HCl选择性达稳定所需时间越短;床层温度500 ℃,15 min后HCl选择性达稳定,稳定的HCl选择性约为1;床层温度295 ℃,40 min后HCl选择性后达稳定,稳定的HCl选择性约为1.5。这是因为煅烧初期体系中除空气湿含量外还含有四水合氯化亚铁晶体中的结晶水,对生成HCl有利,HCl选择性较大;随着煅烧进行,晶体水脱除,体系中水蒸气含量减少,对HCl生成不利,HCl选择性迅速减小。根据床层温度对HCl选择性的影响,可以判断生成Cl2反应活化能较生成HCl反应活化能高,相对于HCl生成速率,Cl2生成速率对温度较敏感,相同条件下温度升高,HCl生成速率增大较小,而Cl2生成速率增大较大,导致HCl选择性随床层温度升高而减小。
表2 不同床层温度下HCl选择性SHCl/Cl2随煅烧时间变化
Table 2 Variation of the HCl selectivity(SHCl/Cl2) at different bed temperatures
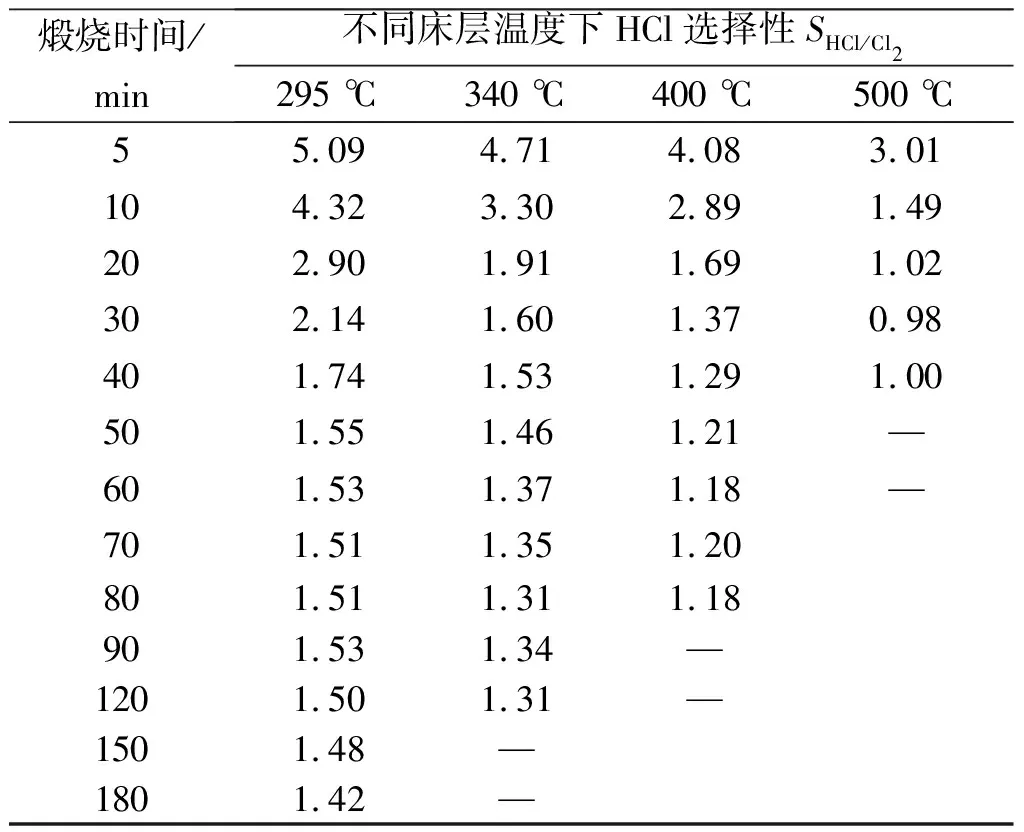
煅烧时间/min不同床层温度下HCl选择性SHCl/Cl2295 ℃340 ℃400 ℃500 ℃55.094.714.083.01104.323.302.891.49202.901.911.691.02302.141.601.370.98401.741.531.291.00501.551.461.21—601.531.371.18—701.511.351.20801.511.311.18901.531.34—1201.501.31—1501.48—1801.42—
3 结 论
相较文献[8],研究空气湿含量对四水合氯化亚铁晶体流态化煅烧过程的影响,为进一步工业应用研究提供更细致的基础数据。研究发现:煅烧过程中,随空气湿含量增大,HCl生成量增大,生成速率提高,Cl2生成量减小,生成速率降低。床层温度500 ℃,空气湿含量为29~71 g/kg下进行四水合氯化亚铁晶体流态化煅烧:空气湿含量为71 g/kg时,煅烧初始HCl选择性>5,15 min后稳定在2;空气湿含量≤36 g/kg时,煅烧初始HCl选择性<0.5,15 min后HCl选择性为0,即无HCl生成。空气湿含量为62 g/kg,床层温度在295~500 ℃范围内进行四水合氯化亚铁晶体流态化煅烧:床层温度越高,HCl选择性越小,HCl选择性达稳定所需时间越短;床层温度500 ℃,15 min后HCl选择性达稳定,稳定的HCl选择性为1;床层温度295 ℃,HCl选择性45 min后达稳定,稳定的HCl选择性为1.5。相对于HCl生成速率,Cl2生成速率对温度较敏感。四水合氯化亚铁晶体流态化煅烧过程中,增大空气湿含量或降低床层温度都会提高HCl选择性。
