S1P、Eotaxin在不同PAI-1基因型老年支气管哮喘中的表达及其与气道高反应及肺功能的相关性研究
2019-10-31
近年来,随着我国老龄化进程的加快以及生态环境的恶化,老年支气管哮喘的发病率、死亡率呈递增趋势。老年哮喘发病机制复杂,目前暂无特异性的治疗方法。研究者认为哮喘与气道重塑、平滑肌收缩、肥大细胞的活化脱颗粒等有关,受炎症因子、基因多态性的影响[1]。据报道,1-磷酸鞘氨醇(S1P)通过S1P/鞘氨醇激酶信号通路促进炎症介质释放,诱导应力纤维形成,促进气道平滑肌和纤维细胞生长分化,导致气道重塑[2];嗜酸性粒细胞趋化因子(Eotaxin)通过引发嗜酸性的粒细胞炎症诱导哮喘发生[3];纤溶酶原激活物抑制剂1(PAI-1)基因4G/5G基因型是老年哮喘发病的易感基因,通过加重细胞外基质沉积促进气道重塑进程[4]。S1P、Eotaxin水平及PAI-1基因多态性均与哮喘气道高反应性和气道重塑有关,而PAI-1基因多态性是否与S1P、Eotaxin水平有关,目前临床报道较少。本研究探讨S1P、Eotaxin水平在不同PAI-1基因型老年支气管哮喘中的表达差异及与气道高反应及肺功能的相关性,现将结果报道如下。
1 病例资料
1.1 基本资料 选取我院2017年1月至2018年1月收治的55例缓解期老年哮喘病人作为哮喘组,男30例,女25例,年龄65~90岁,平均(76.1±3.5)岁,病程2~17年,平均(12.2±2.2)年。另选择同期来我院体检的50例健康人群作为对照组,男30例,女20例,年龄65~90岁,平均(75.2±3.1)岁。2组性别、年龄等基线资料差异无统计学意义(P>0.05),具有可比性。本研究获得我院伦理委员会批准。
纳入标准:(1)符合《中国支气管哮喘防治指南 (基层版)》中的哮喘诊断标准[5];(2)年龄≥60岁;(3)无其他呼吸系统疾病合并症;(4)所有病人及其家属知情同意,并签署知情同意书。
排除标准:(1)合并严重肝、肾、心脑血管疾病者;(2)入组前4周使用全身糖皮质激素者;(3)入组前1周使用抗组胺、抗白三烯及缓释茶碱药物者;(4)合并肺炎、慢性阻塞性肺疾病、自身免疫性疾病或其他部位炎症病人;(5)合并肿瘤者。
1.2 方法
1.2.1 PAI-1基因型检测:入院次日,取空腹肘静脉血2 mL,EDTA抗凝,采用STMT缓冲液处理,采用苯酚/氯仿法提取DNA。引物序列:扩增序列位于5’端启动子区域,上游、下游引物分别为:5′-CACAGAGAGAGTCTGGCCAGT-3′、5′-CAGCCACGTGATTGTCTAGGT-3′。PCR扩增反应条件:25μL反应体系(含100 ng基因组DNA、0.3μmol引物、1.0 U的Tag DNA聚合酶),94 ℃预变性5 min,94 ℃/30 s、57 ℃/30 s、72 ℃/30 s循环35次,72 ℃延伸10 min;采用限制性内切酶消化PCR产物,25μL反应体系(5μL PCR扩增产物,10 U限制性内切酶BseLI),37 ℃持续3 h,采用12%的PAGE电泳分型,硝酸银染分析基因型。共产生3种基因型: 5G/5G 、4G/5G、4G/4G,分别产生2(96bp、46bp)、3(74 bp、46 bp、22 bp)、4(96 bp、74 bp、46 bp、22 bp)条带。
1.2.2 血清PAI、S1P、Eotaxin检测:取空腹肘静脉血,置于肝素抗凝管中,37 ℃孵育10 min,3000 r/min离心10 min,取上层血清,采用ELISA测定血清PAI、S1P、Eotaxin水平,具体操作参照试剂盒(购自于上海信帆生物科技有限公司)说明书进行。
1.2.3 气道反应性评估:采用德国JEAGER公司的定量雾化装置、日本美能的AS-407肺功能仪及激发药物磷酸组织胺测定哮喘病人气道反应性,具体步骤如下:病人依次吸入生理盐水、0.01/0.02/0.04/0.16/0.26/0.68/1.27 mg的激发药物,每吸入1剂2 min后测定第1秒用力呼气量(FEV1),然后吸入下一剂量,直至FEV1下降20%或最高吸入剂量累计达到2.44 mg。数据评估:若累计剂量低于2.44 mg,FEV1降低20%视为激发试验阳性,记录激发药物累计剂量(PD20)。参照气道反应性分级标准,采用PD20评估气道高反应性:极轻度(PD20在0.99~2.20 mg)、轻度(PD20在0.25~0.98 mg)、中度(PD20在0.03~0.24 mg)和重度(PD20<0.03 mg)。
1.2.4 肺功能评估:采用德国Yeager肺功能检测仪器测定哮喘病人FEV1和用力肺活量(FVC),计算FEV1/FVC,采用FEV1/FVC评估病人肺功能。

2 结果
2.1 支气管哮喘病人与健康人群PAI-1基因型分布、S1P、Eotaxin、PAI-1水平比较 哮喘组与对照组PAI-1基因型分布、S1P、Eotaxin、PAI-1水平差异具有统计学意义(P<0.01),哮喘组PAI-1基因型以4G/4G为主,血清S1P、Eotaxin、PAI-1水平高于对照组。见表1。
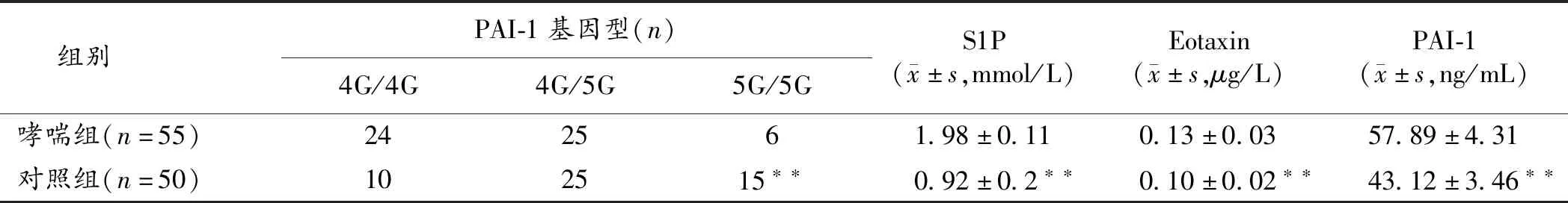
表1 支气管哮喘病人与健康人群PAI-1基因型分布及S1P、Eotaxin、PAI-1水平比较
注:与哮喘组比较,**P<0.01
2.2 不同PAI-1基因型病人S1P、Eotaxin、PAI-1水平比较 老年哮喘病人不同PAI-1基因型血清S1P、Eotaxin、PAI-1水平差异具有统计学意义(P<0.05),基因型4G/4G的病人血清S1P、Eotaxin、PAI-1水平显著高于基因型为4G/5G、5G/5G的哮喘病人。见表2。


PAI-1基因型PAI-1(ng/mL)S1P(mmol/L)Eotaxin(μg/L)4G/4G(n=24)64.32±3.47∗2.48±0.190.139±0.0334G/5G(n=25)52.12±3.121.40±0.10∗0.099±0.011∗5G/5G(n=6)51.82±3.921.41±0.08∗0.099±0.014∗
注:与4G/4G组比较,*P<0.05
2.3 PAI-1、S1P、Eotaxin与气道反应性、肺功能相关性分析 单因素、Logistic回归分析显示,吸烟史(定义无吸烟史=1,有吸烟史=2)、PAI-1基因型(定义5G/5G=1,4G/5G=2,4G/4G=3)、PAI-1水平(定义“PAI-1< 49 ng/mL”=1,“PAI-1≥49 ng/mL”=2)、S1P水平(定义“S1P<1.42 mmol/L”=1,“S1P≥1.42 mmol/L”=2)、Eotaxin水平(“Eotaxin<0.1μg/L”=1,“Eotaxin≥0.1μg/L”=2)均与气道反应性(定义极轻度和轻度=1,中度和重度=2)、肺功能(定义“FEV1/FVC≥55%”=1,“FEV1/FVC<55%”=2)显著相关(P<0.05),是影响气道反应性、肺功能的独立危险因素。见表3、4、5。
2.4 PAI-1与S1P、Eotaxin相关性分析 Spearman相关性分析显示,PAI-1基因型(定义5G/5G=1,4G/5G=2,4G/4G=3)、PAI-1水平与S1P、Eotaxin呈显著正相关(r=0.455~0.653,P<0.05);S1P与Eotaxin呈显著正相关(r=0.705,P<0.001)。见表6。

表3 影响气道反应性、肺功能的单因素分析
注:项目组内比较,*P<0.05
3 讨论
支气管哮喘是在环境因素、遗传因素共同作用引起的慢性气道炎症,进而出现气道结构和功能变化,即气道重塑。气道重塑和炎症反应密不可分,但多数学者认为气道重塑是炎症长期作用的结果[6]。然而,遗传学研究表明,气道重塑和炎症反应同时作用,共同介导了支气管哮喘的疾病进程[7],但二者如何相互作用,导致哮喘进展,业界尚未形成共识。
随着遗传学研究的深入,人们发现,基因多态性与气道重塑密切相关[8]。PAI-1是纤维蛋白溶解系统的主要抑制剂,PAI-1基因调控血浆PAI-1的表达,抑制纤维蛋白溶酶原转化为纤溶酶,导致细胞外基质沉积,产生气道重塑。据报道,PAI-1基因是影响血清PAI-1水平的主要基因因素,PAI-1基因4G/5G的基因多态性与哮喘相关,其中4G/4G为哮喘的易感基因型[9]。本研究中,哮喘病人与健康人群PAI-1基因型存在差异,哮喘病人以4G/4G基因型为主;4G/4G基因型病人肺功能较4G/5G、5G/5G差,气道高反应性程度高,证实了PAI-1基因型与肺功能、气道反应性存在相关性。PAI-1基因调控血浆PAI-1的表达,其中4G/4G易感基因型病人血浆PAI-1表达较高。高表达的PAI-1除了通过抑制纤维蛋白溶解诱导气道重塑之外,还通过以下途径发挥作用:(1)抑制凝血酶、金属蛋白酶抑制细胞外基质降解;(2)降低转化生长因子-β释放,促进胶原合成;(3)促进新生血管生成,与嗜酸性粒细胞、肥大细胞形成调控网络,促进气道重塑[10],导致病人肺功能变差。
炎症反应是诱发哮喘和气道重塑的另一重要原因。S1P是鞘磷脂代谢产物[11],由巨噬细胞、肥大细胞分泌,通过促进支气管评价细胞收缩和应力纤维形成,诱导肥大细胞活化以及促进气道纤维细胞、平滑肌细胞生长分化成肌成纤维细胞,导致炎性介质渗出,出现气道高反应性和气道重构。Eotaxin是趋化因子家族成员[12],通过选择性趋化嗜酸性粒细胞,趋使其向炎症部位靠拢而诱发哮喘和气道高反应性。据报道[13],急性发作哮喘病人血清SIP和Eotaxin水平急剧升高。本研究中,哮喘病人血清SIP和Eotaxin高于健康人群,且血清SIP和Eotaxin是气道高反应性、肺功能减弱的独立危险因素,提示血清SIP和Eotaxin严重影响哮喘疾病进程。
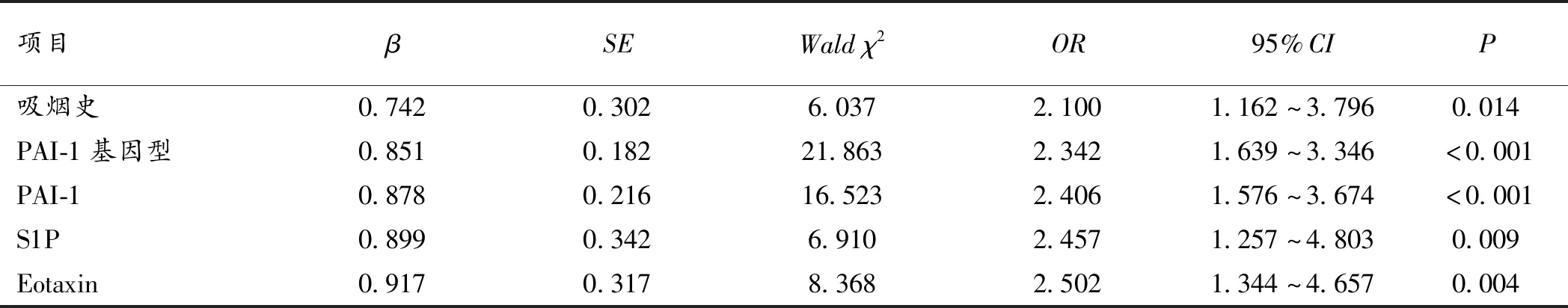
表4 影响气道反应性的Logistic回归分析
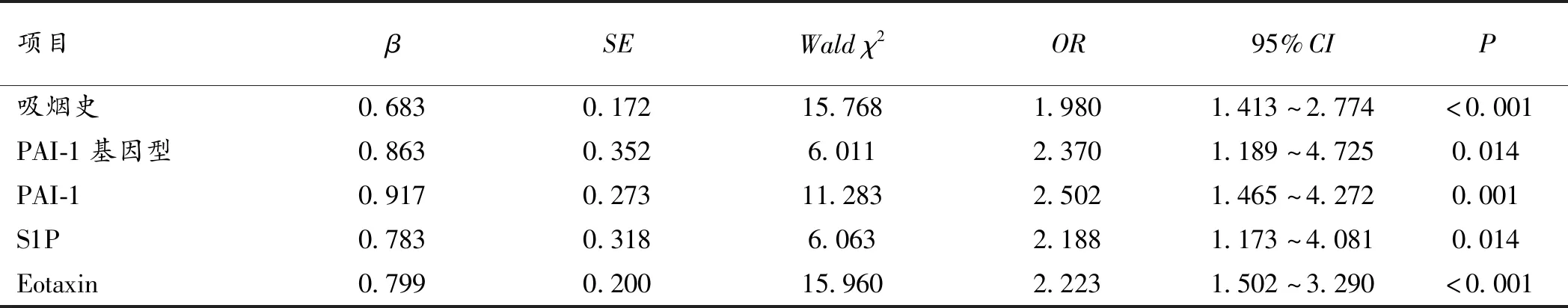
表5 影响肺功能的Logistic回归分析

表6 PAI-1与S1P、Eotaxin相关性分析(r)
PAI-1基因型、血清SIP和Eotaxin均与老年支气管哮喘气道高反应性、肺功能密切相关,但二者之间的相关性研究报道仍较少。本研究中,基因型4G/4G的病人血清S1P、Eotaxin水平显著高于基因型为4G/5G、5G/5G的哮喘病人,相关性分析显示,S1P与Eotaxin呈显著正相关,PAI-1基因型(定义基因型5G/5G=1,4G/5G=2,5G/5G=3)、PAI-1水平与S1P、Eotaxin呈显著正相关,提示PAI-1基因型与炎症反应相互作用,共同介导哮喘的气道高反应性和肺功能下降,从而导致气道重塑。PAI-1位于7q2.13-2.2,它的3种多态性与血清PAI-1水平相关。PAI-1 4G/4G上调PAI-1的表达,一方面促进气道分泌金属蛋白酶-9增加,另一方面促进肺泡上皮细胞分泌白细胞介素-8(IL-8)、白三烯B4(LTB-4)等上游促炎因子,趋化炎症细胞,共同加重炎症反应,介导巨噬细胞、肥大细胞等分泌SIP、Eotaxin等炎症因子,形成炎性调节网络,协同加重哮喘。
总之,PAI-1基因型、S1P、Eotaxin是影响老年支气管哮喘气道高反应性、肺功能的主要因素,PAI-1基因型与S1P、Eotaxin之间具有相关性,共同介导哮喘的进展,详细的PAI-1基因型调控S1P、Eotaxin表达的机制有待于后续研究。因此,对于老年支气管哮喘的治疗,应同时抑制PAI-1基因型引起的血清PAI-1及S1P、Eotaxin的高表达,提高疗效。
