两种乙肝肝纤维化小鼠复合模型的比较
2019-10-31黄恺孙鑫赵志敏彭渊陶艳艳刘成海
黄恺,孙鑫,赵志敏,彭渊,陶艳艳,刘成海,*
(1. 上海市中医临床重点实验室,上海 201203; 2. 上海中医药大学附属曙光医院 肝病研究所,上海 201203)
乙型肝炎病毒(hepatitis B virus,HBV)是一种嗜肝性DNA病毒,可导致慢性肝炎、肝硬化与肝癌[1-2]。建立稳定的HBV诱导的慢性肝炎肝纤维化动物模型对于乙肝肝纤维化病理机制及其药物评价具有重要意义。本研究采用C57BL/6 N-Tg(1.28HBV)/Vst乙肝病毒转基因(HBV-Tg)与rAAV8-1.3HBV腺相关病毒转染(rAAV)小鼠,联合CCl4腹腔注射,诱导慢性乙肝肝纤维化发生。观察比较两种模型的病毒学及纤维化病理特点,为研究时选择相关动物模型提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性C57BL/6野生型小鼠20只,C57BL/6 N-Tg (1.28 HBV)/Vst乙肝病毒转基因小鼠10只,购自并饲养于北京维通达生物技术有限公司【SCXK(京)2014-0001】【SYXK(京)2014-0015】,体重(20 ± 5)g,自由饮食饮水。
1.1.2 实验试剂与仪器
rAAV8-1.3HBV 重组腺相关病毒,购自北京五加和分子医学研究所有限公司。四氯化碳(Carbon tetrachloride,CCl4),化学纯;橄榄油,化学纯,均购自上海国药集团化学试剂有限公司;血清HBsAg、HBeAg检测试剂盒(酶联免疫法,ELISA),HBV-DNA定量检测试剂盒(PCR-荧光探针法),购自上海科华生物工程股份有限公司;谷丙转氨酶(ALT/GPT)测试盒(货号:C009-1)、谷草转氨酶(AST/GOT)测试盒(货号:C010-1)、碱性磷酸酶(AKP)测试盒(货号:A059-1)、苏木精-伊红染液(货号:D006),均购自南京建成生物工程研究所;兔抗HBcAg多克隆抗体(货号:ab140243)、小鼠抗HBsAg单克隆抗体(货号:ab859)、兔鼠通用HRP/DAB二抗显色试剂盒(货号:ab64264),均购自Abcam公司;羟脯氨酸(Hyp)标准品购自Sigma公司。Bio-Tek Power Wave XS微孔板分光光度计,购自美国Bio-Tek公司;石蜡脱水机、病理切片机购自德国徕卡公司;高倍显微镜购自日本奥林巴斯有限公司。
1.2 实验方法
1.2.1 动物造模与分组
将C57BL/6N野生型小鼠随机分为野生型对照组(WT)、rAAV8-1.3HBV转染组(rAAV)、CCl4组(CCl4)、rAAV8-1.3HBV转染复合CCl4组(rAAV+CCl4),将同周龄C57BL/6 N-Tg(1.28HBV)/Vst乙肝病毒转基因小鼠随机分为HBV转基因组(Tg)、HBV转基因复合CCl4组(Tg+CCl4)。每组小鼠各设5只。rAAV8-1.3HBV转染采用尾静脉注射方式,实验首日注射1次,每只小鼠尾静脉注射病毒载量为1E+10v.g.;CCl4以橄榄油稀释至10%浓度,按照2 mL/kg小鼠体重腹腔注射造模,隔天1次。造模12周后麻醉处死小鼠,留取血清与肝组织。
1.2.2 血清HBV病毒学指标测定
血清HBsAg、HBeAg采用ELISA试剂盒检测,按照试剂盒说明书要求操作;血清HBV-DNA采用荧光探针PCR试剂盒检测,UNG酶反应50℃ 2 min,预变性94℃ 2 min, 变性94℃ 10 s 循环60次,退火、延伸及检测荧光60℃ 30 s检测通道:530 nm(FAM)。
1.2.3 血清肝功能测定
血清谷丙转氨酶(ALT)、谷草转氨酶(AST),采用赖氏比色法试剂盒检测;血清碱性磷酸酶(AKP),采用金氏法试剂盒检测,均按照试剂盒说明书要求操作。
1.2.4 肝组织Hyp含量测定
参照Jamall’s盐酸水解法[3],称取100 mg肝组织放入50%盐酸中105℃水解过夜。后取三层滤纸过滤水解液并吸取100 μL烘干处理。取Hyp标准品0.2 ~ 1.6 μg设为标准曲线,经氯胺T溶液0.2 mL,含25%对二甲基氨基苯甲醛和27.3%高氯酸的异丙醇溶液反应,50℃水浴1 h, 558 nm测定吸收值。
1.2.5 肝组织病理
小鼠肝组织 4%甲醛浸泡固定、脱水后石蜡包埋切片;进行HE染色后封片,显微镜(×200倍)观察。天狼猩红采用饱和苦味酸配制,显微镜(×100倍)观察,利用Image-Pro Plus 6.0软件对胶原面积作半定量分析。
1.2.6 肝组织免疫组织化学染色
肝组织脱蜡逐级复水,柠檬酸盐缓冲液高压热修复,3%双氧水去酶处理内源性酶。5% BSA室温30 min,滴加一抗4℃过夜。洗去一抗滴加二抗37℃ 1 h,洗去后滴加SABC链霉素10 min。DAB显色后苏木素染核封片。阳性区域总面积半定量分析采用Image-Pro Plus 6.0软件。
1.3 统计学分析
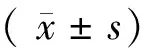
2 结果
2.1 两种复合模型小鼠血清病毒学指标比较
结果显示:除WT组、CCl4组外,其余组血清HBsAg、HBeAg均为阳性,两种复合模型组相比,Tg+CCl4组血清HBsAg和HBeAg水平高于rAAV+CCl4组(P< 0.01、P< 0.05)(图1A、1B)。PCR结果显示,除WT组、CCl4组外,其余组别血清HBV-DNA载量均高于1.0×104IU/mL, rAAV组与rAAV+CCl4组HBV-DNA载量高于Tg组与Tg+CCl4组(P< 0.01、P< 0.05)(图1C)。
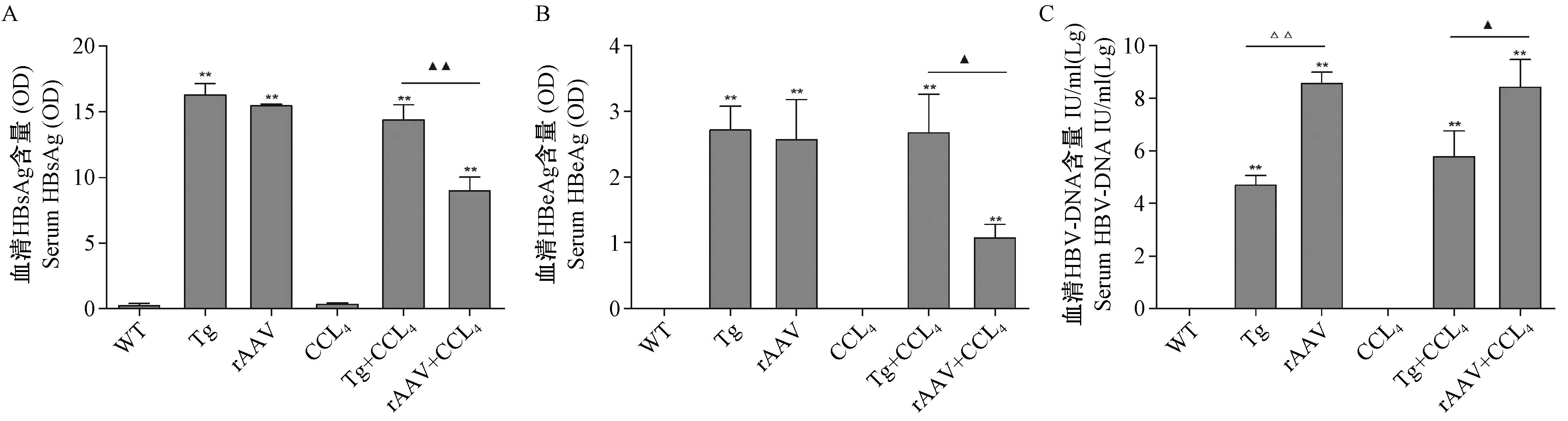
注:**P< 0.01 vs WT;ΔΔP< 0.01 vs rAAV;▲P< 0.05,▲▲P< 0.01 vs rAAV+CCl4;n=5。图1 小鼠血清乙肝病毒学检测结果Note. **P<0.01 vs WT.ΔΔP<0.01 vs rAAV.▲P< 0.05,▲▲P< 0.01 vs rAAV+CCl4.n=5.Figure 1 Virological detection of HBV in the mouse serum
2.2 两种复合模型小鼠肝组织免疫组化染色指标比较
肝组织石蜡切片免疫组化结果显示,WT组、CCl4组均未见HBsAg、HBcAg阳性表达,其余组别小鼠肝组织中HBsAg和HBcAg均可见不同程度阳性表达(图2A);通过图片半定量分析后发现,rAAV组较Tg组HBsAg阳性表达面积明显减少(P< 0.01),而rAAV组较Tg组肝细胞核HBcAg阳性数量明显增多(P< 0.01);两种复合模型组相比,HBsAg在肝组织中的表达未见明显差异(P> 0.05),但rAAV+CCl4组肝细胞核HBcAg阳性数量显著高于Tg+CCl4组(P< 0.01)(图2B、2C)。

注:**P< 0.01 vs WT,ΔΔP< 0.01 vs rAAV,▲▲P< 0.01 vs rAAV+CCl4,n=5。图2 小鼠肝组织HBsAg、HBeAg免疫组化染色与半定量分析Note. **P< 0.01 vs WT,ΔΔP< 0.01 vs rAAV,▲▲P< 0.01 vs rAAV+CCl4,n=5.Figure 2 Immunohistochemical staining(A) and semi-quantitative analysis of HBsAg(B) and HBeAg(C) in the mouse liver tissues
2.3 两种复合模型小鼠肝组织炎症与纤维化生化学指标的比较
血清生化检测结果显示(表1),与WT组比较,CCl4复合造模12周后,CCl4组、Tg+CCl4组与rAAV+CCl4组血清ALT与AST水平均明显上升(P< 0.01),Tg组与rAAV组对比WT组没有明显变化(P> 0.05)。Tg组与rAAV组ALT水平具有差异(P< 0.01)。两种复合模型组相比;Tg+CCl4组与rAAV+CCl4组ALT、AST水平均未见显著差异(P> 0.05);各组AKP水平均未见明显差异(P> 0.05)。肝组织Hyp含量检测结果显示,与WT组比较,CCl4复合造模12周后,CCl4组、Tg+CCl4组与rAAV+CCl4组肝组织中Hyp含量均显著升高(P< 0.01),两种复合模型组相比,Tg+CCl4组对比rAAV+CCl4组肝内Hyp含量具有明显差异(P< 0.01)。

表1 小鼠血清肝功能及肝组织羟脯胺酸含量的测定Table 1 Serum ALT, AST, AKP levels and Hyp levels in the mouse liver tissues
注:*P< 0.05,**P< 0.01vsWT,ΔΔP< 0.01vsrAAV,▲▲P< 0.01vsrAAV+CCl4,n=5。
Note.*P< 0.05,**P< 0.01vsWT,ΔΔP< 0.01vsrAAV,▲▲P< 0.01vsrAAV+CCl4,n=5.
2.4 两种复合模型小鼠肝组织炎症与纤维化病理特点的比较
HE染色结果显示,WT组小鼠肝小叶结构完整、清晰,肝细胞呈条索状排列整齐,在中央静脉周围呈放射状分布,Tg组与rAAV组肝小叶排列整齐,仅可观察到肝细胞核增大,其中rAAV组存在少量炎细胞浸润,CCl4组、rAAV+CCl4组、Tg+CCl4组均出现大量肝实质细胞坏死,正常肝小叶结构消失,出现明显气球样变和脂肪变,汇管区大量炎性细胞浸润。天狼猩红染色结果显示,WT组肝组织未见明显胶原沉积,Tg组和rAAV组汇管区及小叶间出现少量胶原沉积,呈细线状,未见明显的桥接和假小叶,CCl4组、rAAV+CCl4组、Tg+CCl4组肝组织出现明显胶原纤维沉积,由汇管区向周围延伸,形成纤维间隔,其中Tg+CCl4组可见到明显的假小叶形成(图3A)。通过胶原半定量分析后发现;Tg+CCl4组胶原含量高于rAAV+CCl4组(P< 0.01)(图3B)。

注:**P< 0.01 vs WT,▲▲P< 0.01 vs rAAV+CCl4,n=5。图3 肝组织病理HE、天狼猩红染色与胶原半定量分析Note. **P< 0.01 vs WT,▲▲P< 0.01 vs rAAV+CCl4 ,n=5.Figure 3 Pathological changes (A) and semi-quantitative analysis of collagen content (B) in the mouse liver tissues
3 讨论
目前乙肝动物模型主要为:麻鸭乙型肝炎模型、转基因小鼠模型、树鼩模型等[4-5]。其中以小鼠乙肝模型为主流[6-7]。小鼠乙肝模型又可分为转基因型、高压水动力注射型与腺病毒转染[8]三种。其中利用肝衰竭小鼠移植人骨髓间充质干细胞(bone marrow mesenchymal stem cells)的人源化模型可有效模拟人体乙肝肝硬化发病过程[9],但是此类方法实验难度较高且成本较为昂贵。近年来,有研究者使用HBV转基因小鼠复合CCl4模型观察慢性乙肝肝纤维化过程中自然杀伤T细胞(natural killer T cells,NKT cells)的变化[10]。构建慢性乙肝肝纤维化动物模型需具备两个基本要素:首先是HBV基因的高水平表达,其次具有长期性的HBV感染及相应的纤维化的病理特征。rAAV采用携带1.3拷贝HBV基因组的重组8型腺相关病毒,依其对于肝亲嗜性特点,将HBV基因组高效导入肝细胞中[11]。HBV-Tg转基因小鼠则是1.28拷贝HBV病毒基因片段或全基因组导入小鼠单细胞受精卵的雄原核,再植入母体使其发育[12]。本实验室前期研究表明[13],单纯HBV-Tg小鼠在36周以上才会出现较为明显的自发性病理炎症和转氨酶升高。通过CCl4复合造模可以进一步缩短成模时间。CCl4模型在与肝纤维化发展相关的组织学、生化学、细胞和分子变化方面具有明显特点,通过诱导肝内III区坏死和肝细胞凋亡,使肝星状细胞活化导致纤维化产生[14-15]。
合理地选用小鼠慢性乙肝模型可以有效解决HBV在病毒感染、复制、免疫应答和药物评价方面的难题。本研究发现:Tg组与rAAV组在联合CCl4染毒12周后能够稳定成模。两者血清生化学差异并不明显,其差异主要体现在病毒学标志物方面。HBV-DNA结果可以看到:由于rAAV本身具有剧烈嗜肝性,注射机体后破坏肝细胞使大量HBV-DNA释放入血,并且肝组织中HBcAg大面积表达是其典型特征。而HBV-Tg病毒主要依靠小鼠不断表达HBV蛋白并且在肝中产生病毒颗粒[16],HBV-DNA的复制则相对缓慢。rAAV8注射后,机体自身免疫应答升高,血清中出现Anti-HBs,血清学转换发生,部分HBsAg被清除[17-18],导致血清与肝组织中HBsAg和HBeAg水平较HBV-Tg组偏低。纤维化进展方面;Tg+CCl4组则更为明显,其原因和自然杀伤T细胞加速并释放细胞因子IL-4和IL-13导致肝星状细胞(hepatic stellate cell,HSC)活化有关[19]。
综上所述,rAAV与HBV-Tg在建立慢性乙肝模型上具有一定优势,但是同时也存在一些局限性。首先两者无法有效在体内合成共价闭合环状DNA(covalently closed circular DNA, cccDNA)。并且由于CCl4造成的脂质过氧化损伤后部分肝实质细胞产生坏死,导致HBV的复制存在一定抑制[20],但rAAV+CCl4组与Tg+CCl4组病毒学指标仍要高于WT组。本次实验rAAV注射剂量为每只1E+10v.g.,增加病毒载量至5E+12v.g.时成模效率可能更高,并且rAAV由于其存在嗜肝性,需要一定的尾静脉注射技巧,处理不当可导致实验人员发生感染风险。而HBV-Tg相对风险性较小并且价格相对低廉。综上所述,本研究两种模型可以给慢性乙肝纤维化的药物评价提供一定思路和借鉴。如需探讨乙肝纤维化免疫机制等其他问题,则有待进一步研究挖掘。