受体相互作用蛋白激酶-3参与甲型流感病毒H1N1感染C57BL/6小鼠诱导特异性CD8+T细胞应答
2019-10-31秦波音王超刘洋谭丹方钟李顺周晓辉
秦波音,王超,刘洋,谭丹,方钟,李顺,周晓辉
(复旦大学附属公共卫生临床中心,上海 201508)
甲型流感病毒(IAV)是鸟类和哺乳动物流感的主要病原体,可引起反复流行,造成人类高发病率和死亡率[1]。1918年的H1N1流感大流行是有史以来最严重的流感大流行,造成全世界2 ~ 5千万人死亡[2]。而2009年墨西哥等国爆发的甲型H1N1型流感大流行,也造成了1万多人死亡[3-4]。甲型流感病毒的感染已严重危害人类生命健康,并造成了巨大的经济损失,深入研究甲型流感病毒的感染致病及免疫反应的机制,对研发流感病毒疫苗和抗病毒药物具有深远意义。
受体相互作用蛋白激酶-3(receptor-interacting protein 3, RIP3)是细胞程序性坏死(necroptosis)信号通路的关键分子。近年来发现,细胞坏死在特定条件下也受信号通路参与和调控,称为程序性坏死。调控细胞坏死的分子机制主要由受体相互作用蛋白激酶(receptor-interacting proteins, RIPs)参与,RIP3分子作为RIPs家族的重要成员和RIP1一起通过RHIM基序(RIP homotypic interaction motif)相互结合及相互磷酸化,从而对程序性坏死起关键调节作用[5-7]。本课题组前期研究发现,RIP3介导的程序性坏死信号通路在流感病毒H1N1 PR8感染中起到一定的炎症病理作用[8],但RIP3分子在诱生流感特异性T细胞应答中的作用尚不明确。本研究继续观察了RIP3敲除小鼠在感染流感后CD8+T细胞的变化,发现缺失RIP3分子会导致流感抗原特异性CD8+T细胞生成数量减少,且分泌效应性细胞因子的能力和表达颗粒酶的水平降低,报道了RIP3分子在参与流感抗原特异性CD8+T细胞诱导生成及其效应性应答功能中发挥作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级3月龄左右C57BL/6雌性小鼠10只,RIP3敲除(RIP3-/-)的雌性C57BL/6背景小鼠10只,体重约20 ~ 22 g。C57BL/6小鼠购于上海西普尔-必凯实验动物有限公司【SCXK(沪)2018-0016】,RIP3-/-小鼠由王晓东院士惠赠,经本实验动物部繁育扩群,两品系小鼠共同饲养于复旦大学附属公共卫生临床中心实验动物部二楼SPF实验区域【SYXK(沪)2015-0008】。在攻毒前1 d,实验小鼠从SPF区转移到动物生物安全二级实验室。所有操作均符合复旦大学附属公共卫生临床中心实验动物伦理要求(伦理审批号:IACUC2018-A044-02)。
1.1.2 病毒
甲型流感A/Puerto Rico/8/34 (H1N1)病毒株 (简称PR8),由上海兽医研究所李泽君教授赠予。病毒通过鸡胚及MDCK细胞培养并滴定后,分装于EP管中,-80℃冰箱冻存备用,涉及动物感染性实验均在复旦大学附属公共卫生临床中心实验动物部动物生物安全二级实验室(ABSL-2)内开展(实验室注册备案号:金字第022006005号)。
1.1.3 实验试剂
多聚甲醛固定液(武汉谷歌生物科技有限公司,163307),DMEM培养液(Gibco,1868707),异氟烷(上海雅培制药有限公司,B506),流式抗体(上海达科维生物技术有限公司,Biolegend),BD Cytofix/Cytoperm Plus固定破膜试剂盒(BD,555028),针对MHC-I类四聚体Flu.NP366[ASNENMETM, H-2D(b)](广州好芝生物科技有限公司,HG08T7030),Biolegend FITC Annexin Ⅴ Apoptosis Detection Kit with PI(上海达科维生物技术有限公司,640914)。
1.1.4 实验仪器
除了如崔光、刘芳一般自学为继,平齐民中还有家学的传授。“〔房〕灵宾,文藻不如兄灵建,而辩悟过之”,“兄弟俱入国,为平齐民”,“灵建子宣明,亦文学著称,雅有父风”。㊱房宣明的学问自然是由家学传授的。“清河房爱亲妻崔氏者,同郡崔元孙之女也”,“亲授子景伯、景先《九经》义,学行修明,并当世名士”。㊲房景伯、房景先兄弟生于平齐郡,少年丧父,学问由母亲传授。
生物安全柜(HR40-Ⅱ A2,Haier,青岛海尔特种电器有限公司,中国),冷冻离心机(Micro 17R,Thermo,美国),CO2培养箱(3111,Thermo,美国),流式细胞仪(LSR Fortessa,BD公司,美国),精密高温干燥箱(DHG-9070C,上海之信仪器有限公司,中国)。
1.2 方法
1.2.1 动物分组及小鼠攻毒
将小鼠随机分为4组:WT感染组(A组)和WT对照组(B组)、RIP3-/-感染组(C组)和RIP3-/-对照组(D组),每组小鼠各5只。将4组实验小鼠分别打耳孔标记并称重,使用异氟烷对小鼠进行麻醉,用100 μL移液枪吸取40 μL含0.7×103TCID50的PR8 DMEM病毒液从小鼠鼻部缓慢滴入进行攻毒,病毒液滴入鼻孔时需缓慢并顺应小鼠呼吸节奏,直至液体完全吸收,同时轻拍小鼠胸腹部,以保证攻毒剂量的准确。结束后将小鼠置于负压独立送风隔离笼具(IVC)系统内正常饲养。
1.2.2 样本采集
流感感染后第8天,分别处死A组和C组小鼠各5只,B组和D组小鼠各3只。解剖各组小鼠后取脾,置于无菌培养皿上研磨后进行脾单细胞制备。
1.2.3 流式细胞术(FACS)检测流感特异性CD8+T细胞
流感病毒感染小鼠后第8天,对小鼠解剖后取脾脏,制备脾单细胞。使用CD4-PB、CD8-FITC、CD44-APC-Cy7流式抗体和MHC-I类四聚体,4℃染色45 min,加150 μL染色buffer,4℃ 300 g 5 min离心,弃上清后使用200 μL染色buffer对细胞进行重悬,液体通过滤膜过滤后流式上机。实验数据通过Flowjo(V10)软件进行分析。
1.2.4 流式细胞术(FACS)检测细胞内因子表达
流感病毒感染小鼠后第8天,对小鼠解剖后取脾,制备脾单细胞。加入终浓度均为2.5 μg/mL的流感肽段NP366-374(ASNENMETM)和PA224-233(SSLENFRAYV)至脾细胞培养液,同时1∶1000加入高尔基体阻断剂,在恒温细胞培养箱中37℃放置5 h,使用CD4-PB、CD8-FITC、CD44-APC-Cy7、TNF-α-PE-Cy7、IFN-γ-PE、IL-2-BV605、Granzyme B-PB流式抗体和BD Cytofix/Cytoperm Plus固定破膜试剂,参考各自使用说明书进行细胞内因子染色,结束后200 μL染色buffer对细胞进行重悬,液体通过滤膜过滤后流式上机。实验数据通过Flowjo(V10)软件进行分析。
1.3 统计学分析
2 结果
2.1 RIP3对小鼠流感抗原特异性CD8+T细胞诱生能力的影响
各组小鼠感染后第8天,解剖取脾制备单细胞,从淋巴细胞中圈出CD8+T细胞群后,分析流感抗原特异性Tetramer阳性细胞群(图1)。在WT和RIP3-/-感染组小鼠中,流感感染后均能造成流感抗原特异性CD8+T细胞的增加。但在WT感染组增加更显著[WT对照组:(0.07 ± 0.03)%,WT感染组:(0.89 ± 0.52)%,P< 0.05];RIP3-/-组也有显著上调[RIP3-/-对照组:(0.12 ± 0.06)%,RIP3-/-感染组:(0.41 ± 0.17)%,P< 0.05]。流感感染后,WT感染组小鼠流感特异性Tetramer+T细胞比例是对照组的12.71倍,RIP3-/-感染组小鼠是对照组的3.42倍。WT感染组小鼠流感特异性Tetramer+T细胞比例是RIP3-/-感染组的百分比均值差异达到2.71倍。以上数据提示,PR8流感病毒感染小鼠后,RIP3分子可能参与流感抗原特异性CD8+T细胞的生成。
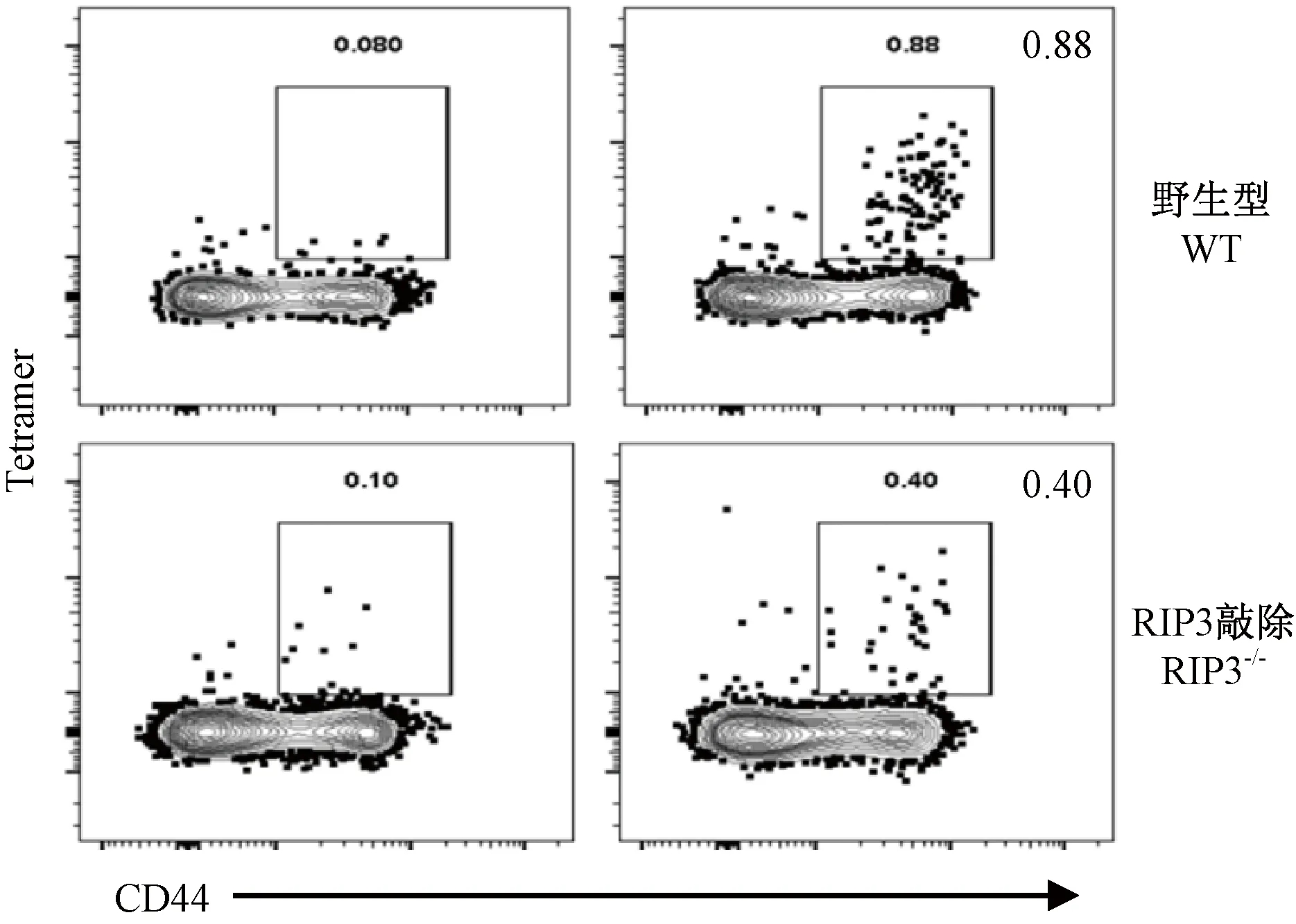
注:从脾细胞中圈出CD8+阳性细胞群,分析该群细胞中抗原特异性T细胞比例。图1 攻毒后小鼠流感抗原特异性CD8+T细胞比例Note. CD8 positive cells were gated from spleen cells and the proportion of antigen specific T cells was analyzed.Figure 1 The proportion changes of influenza antigen-specific CD8+T cells in the mice after challenge
2.2 RIP3对小鼠CD8+T细胞分泌内因子能力的影响

注:从脾细胞中圈出CD8+CD44high的细胞群,分析该群细胞分泌IFN-γ、TNF-α、IL-2的情况,WT感染组与RIP3-/-感染组相比差异极显著,**P< 0.01。图2 攻毒后小鼠细胞因子分泌情况Note. CD8+CD44high cell group was gated from spleen cells and the secretion of IFN-γ, TNF-α and IL-2 was analyzed. Significant difference between the groups WT and RIP3-/-mice,**P< 0.01.Figure 2 Secretion of cytokines in the mice after challenge
各组小鼠感染后第8天,解剖取脾制备单细胞,加入流感NP和PA的CD8表位肽段,体外刺激8 h后,运用流式细胞术对活化的CD8+T细胞(CD8+CD44High)亚群设门分析分泌IFN-γ、TNF-α、IL-2的比例(图2)。流感抗原特异性CD8+T细胞在分泌IFN-γ方面,WT感染组均值[(3.094 ± 1.49)%]显著高于RIP3-/-感染组均值[(0.712 ± 0.3778)%](P< 0.01);在分泌TNF-α方面,WT感染组均值[(1.522 ± 0.4462)%]显著高于RIP3-/-感染组均值[(0.686 ± 0.2939)%] (P< 0.01);在分泌IL-2方面,WT感染组均值[(1.698 ± 1.3734)%]显著高于RIP3-/-感染组均值[(0.71 ± 0.194)%] (P< 0.01)。以上结果提示,RIP3分子在流感抗原特异性CD8+T细胞分泌IFN-γ、TNF-α以及IL-2等效应性细胞因子功能的过程中发挥一定的作用,缺失该分子将导致抗原特异性CD8+T细胞分泌这些细胞因子的能力降低。
2.3 RIP3对小鼠CD8+T细胞分泌Granzyme B能力的影响
当流感病毒感染宿主后,病毒特异性CD8+T细胞在发挥免疫功能的过程中除了分泌效应性细胞因子外,还会通过释放granzyme B直接杀伤感染流感病毒的肺实质细胞。因此,在加入流感NP和PA的CD8+T细胞表位肽段体外刺激后,研究人员检测了活化的CD8+T细胞亚群(CD8+CD44high)表达granzyme B的情况(图3)。在WT和RIP3-/-感染组小鼠中,流感感染后均能显著提高granzyme B的分泌。但在WT感染组增加更显著[WT对照组:(1.597 ± 1.026)%,WT感染组:(6.878 ± 2.076)%,P< 0.01]; RIP3-/-组也有显著上调[RIP3-/-对照组:(0.96 ± 0.451)%,RIP3-/-感染组:(2.446 ± 0.584)%,P< 0.01]。流感感染后,WT感染组小鼠是对照组分泌granzyme B能力的4.34倍,而RIP3-/-组则为2.03倍,WT感染组小鼠分泌granzyme B的能力显著高于RIP3-/-感染组(P< 0.01)。该结果提示PR8流感病毒感染小鼠后,RIP3分子能够显著提高机体分泌granzyme B的能力。RIP3分子对流感抗原特异性CD8+T细胞发挥特异性杀伤功能有一定影响,缺失该分子将导致抗原特异性CD8+T细胞表达与杀伤功能有关的granzyme B水平降低。
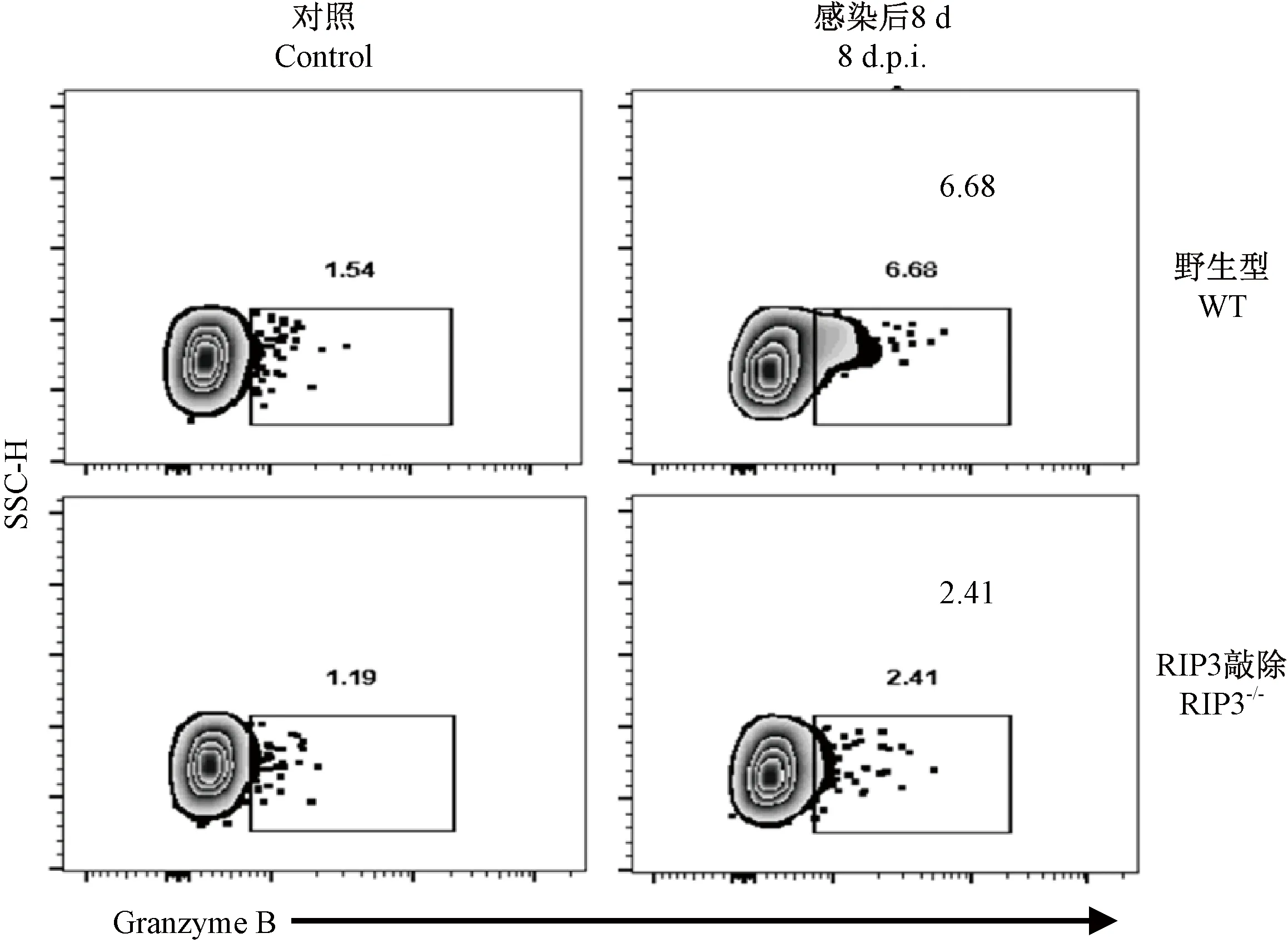
注:从脾细胞中圈出CD8+CD44high的细胞群,分析该群细胞分泌Granzyme B的情况,WT感染组与RIP3-/-感染组相比差异极显著,**P< 0.01。图3 攻毒后小鼠CD8+ CD44High亚群表达Granzyme B的情况Note. CD8+CD44high cell group was gated from spleen cells and the secretion of granzyme B was analyzed. Significant difference between the groups WT and RIP3-/-mice,**P< 0.01.Figure 3 Granzyme B expression of CD8+ CD44High subgroup in the mice after challenge
3 讨论
抗原特异性CD8+T细胞在病毒感染过程中发挥重要作用。研究发现,在感染流感病毒后人体的免疫系统会通过树突状细胞或巨噬细胞来激活流感NP/PA等抗原特异性的CD8+T细胞,后者可杀伤感染病毒的呼吸道上皮细胞和肺实质细胞[9-11],从而清除病毒。在感染流感病毒的小鼠中,NP/PA特异性的CD8+T细胞也发挥重要功能,可以迁移到气道和肺组织,进一步杀伤流感病毒感染的肺实质细胞以清除病毒,伴随局部病理炎症损伤的发生。
已知RIP3是细胞程序性坏死的关键分子。课题组之前的研究发现用H1N1 PR8(5.25×103TCID50)感染6~7月龄的RIP3-/-和野生型C57BL/6小鼠后,RIP3-/-组小鼠生存率显著高于野生型小鼠,并提示可能与RIP3介导的体内炎症病理作用有关[8]。但目前尚无研究表明RIP3的敲除可以直接影响流感抗原特异性的CD8+T细胞诱生及功能。
本研究使用流感病毒H1N1 PR8(0.7×103TCID50)感染3月龄左右的RIP3-/-和野生型C57BL/6小鼠,结果发现RIP3分子对于流感病毒感染后的抗原特异性CD8+T细胞的诱生,活化的CD8+T细胞分泌效应性细胞因子IFN-γ、TNF-α和IL-2能力,以及表达与杀伤功能有关的granzyme B水平等方面均有一定影响。
本研究发现,C57BL/6小鼠在感染流感病毒后,无论是否存在RIP3缺陷,NP抗原特异的CD8+T细胞数量均能显著增加,但在RIP3敲除鼠中NP抗原特异的CD8+T细胞生成能力较野生型小鼠弱,所诱生的流感抗原特异的CD8+T细胞较少。从流感病毒感染RIP3敲除以及野生型的C57BL/6小鼠分离脾淋巴细胞,并在体外用NP/PA的肽段进一步刺激其中的抗原特异性的CD8+T细胞,发现野生型小鼠感染流感后活化的CD8+T细胞分泌细胞因子IFN-γ、TNF-α和IL-2的能力显著高于感染流感的RIP3敲除鼠。
IFN-γ、TNF-α和IL-2这三种细胞因子是抗原特异性的CD8+T细胞发挥免疫效应的重要介质分子,在流感病毒感染过程中起到清除病毒的作用,也与免疫炎症反应有关。流感感染后,IFN-γ可以通过非杀伤的方式抑制胞内病毒复制[12],TNF-α与肺损伤密切相关[13],IL-2可以通过调节T细胞从而抑制病毒[14-15]。本研究结果表明RIP3可以调控抗原特异性CD8+T细胞分泌这些细胞因子的能力。
CD8+T细胞除了可以通过非杀伤性细胞因子IFN-γ、TNF-α和IL-2来帮助流感病毒的清除,也可以通过granzyme B来直接杀伤感染流感病毒的肺实质细胞[16]。本研究发现在RIP3敲除的CD8+T细胞上granzyme B的表达显著下降。这表明RIP3对CD8+T细胞功能的调节作用不仅限于细胞因子,也能直接影响其杀伤能力。
综上所述,本研究利用小鼠体内感染模型检测了RIP3敲除对CD8+T细胞应答的情况,首次报道了RIP3分子参与调节流感抗原特异性CD8+T细胞的生成,并影响CD8+T细胞的功能(分泌细胞因子的能力和表达granzyme B的水平)。研究结果有利于从新的角度理解流感病毒感染活化CD8+T细胞过程,但相关的分子机制目前尚待进一步阐明。推测可能是CD8+T细胞自身的RIP3的敲除影响了其诱生及活化过程,也可能是抗原递呈细胞中RIP3的缺失导致其无法有效帮助T细胞诱生和活化发挥功能,具体的机制值得下一步作深入的探究。此外,RIP3分子对于抗原特异的记忆性CD8+T细胞形成以及二次应答功能是否存在影响及可能的机制,也是值得继续深入研究的问题之一。