紫外分光光度法测定人乳腺癌细胞内外液中阿司匹林的含量
2019-10-30朱星枚高晨王川王国全王斌刘继平
朱星枚 高晨 王川 王国全 王斌 刘继平
[摘要] 目的 建立人乳腺癌细胞株MDA-MB-231细胞内、外液中阿司匹林含量测定的紫外分光光度法,动态监测细胞内、外液中阿司匹林含量。 方法 采用紫外分光光度法测定细胞内、外液阿司匹林含量,测定波长为276 nm。结果 在30~130 μg/mL范围内,人乳腺癌细胞株MDA-MB-231细胞内、外液中阿司匹林浓度与吸光度的线性关系良好,回归方程分别为Y=0.007X-0.021(r = 0.9995,n = 5);Y=0.006X+0.061(r = 0.9995,n = 5);平均回收率分别为96.6%(RSD = 1.0%)、98.4%(RSD = 0.8%);日内精密度RSD分别为2.3%和2.4%,日间精密度RSD分别为2.2%和2.3%。细胞内、外液定量限均为20 μg/mL,细胞内液检测限为10 μg/mL,细胞外液检测限为1.25 μg/mL。结论 该紫外分光光度法可用于测定MDA-MB-231细胞内、外液中阿司匹林的含量,且该法简便、易行,准确度高,重现性好。
[关键词] 阿司匹林;紫外分光光度法;MDA-MB-231细胞;细胞内液;细胞外液;含量测定
[中图分类号] R927.2 [文献标识码] A [文章编号] 1673-7210(2019)08(a)-0030-04
[Abstract] Objective To establish an ultraviolet spectrophotometric method for the determination of Aspirin in the intracellular and extracellular fluid of human breast cancer cell line MDA-MB-231 and to dynamically monitor the content of Aspirin in the intracellular and extracellular fluid. Methods The contents of Aspirin in intracellular and extracellular fluids were determined by ultraviolet spectrophotometry with a wavelength of 276 nm. Results In the range of 30~130 μg/mL, the linear relationship between Aspirin concentration and absorbance in the intracellular and extracellular fluid of human breast cancer cell line MDA-MB-231 were good. The regression equation were Y=0.007X-0.021 (r = 0.9995, n = 5); Y=0.006X+0.061 (r = 0.9995, n = 5); the average recoveries were 96.6% (RSD = 1.0%) and 98.4% (RSD = 0.8%), respectively; intraday precision RSD were 2.3% and 2.4%, daytime precision RSD were 2.2% and 2.3%, respectively. The limit of quantification of both intracellular and extracellular fluids was 20 μg/mL, the limit of detection of intracellular fluid was 10 μg/mL, and the limit of detection of extracellular fluid was 1.25 μg/mL. Conclusion Ultraviolet spectrophotometry can be used to determine the content of Aspirin in the intracellular and extracellular fluid of human breast cancer cell line MDA-MB-231. The method is simple, easy, accurate and reproducible.
[Key words] Aspirin; Ultraviolet spectrophotometry; MDA-MB-231 cells; Intracellular fluid; Extracellular fluid; Determination
乳腺癌是女性最常見的恶性肿瘤之一,每日低剂量服用阿司匹林可预防乳腺肿瘤发生,而长期大量服用阿司匹林会使黏膜受到损伤,引起胃肠道出血[1-7]。因此,探讨阿司匹林含量测定方法对促进应用阿司匹林防治乳腺肿瘤的安全性评价有着重要意义。
2015年版《中华人民共和国药典》[8]以下简称“《中国药典》”规定:阿司匹林含量测定使用酸碱中和滴定法,但实际操作繁琐且终点不易辨认,误差较大。紫外分光光度法相对误差通常在5%左右,是药学领域最常用的含量测定方法之一。阿司匹林具有紫外吸收特性,可用紫外分光光度法监测其动态浓度[9-13]。本研究建立紫外分光光度法测定人乳腺癌细胞株MDA-MB-231细胞内、外液阿司匹林浓度,并分析不同浓度阿司匹林处理后人乳腺癌细胞株MDA-MB-231细胞内、外液中其含量。
1 仪器与试药
1.1 仪器
紫外分光光度仪(UV1102,上海天美科学仪器有限公司)、细胞培养箱(411,赛默飞世尔科技中国有限公司)、离心机(5804R,Eppendorf),细胞粉碎机(60648,Parmer)、分析天平(BT25S,德国赛多利斯公司),六孔板(140675,Thermo)。
1.2 试药
乙酰水杨酸对照品(中国食品药品检定研究院,批号:100113-201706,纯度:99.8%);阿司匹林原料药(Sigma-Aldrich中国,批号:A6810,纯度:99%);三氯醋酸(天津市福晨化学试剂厂,批号:20170925);氢氧化钠(天津市天力化学试剂有限公司,批号:20160608);浓盐酸(天津市富宇精细化工有限公司,批号:201503 11);生理盐水(辰欣药业股份有限公司,批号:171222 2322);纯化水(陕西中医药大学);DMEM培养基(GIBCO,货号:1342937);小牛血清(杭州四季青生物工程材料有限公司,批号:170609)。
1.3 细胞系
人乳腺癌细胞株MDA-MB-231细胞(空军军医大学生物化学与分子生物学教研室馈赠)。
2 方法与结果
2.1 细胞培养
人乳腺癌细胞株MDA-MB-231细胞用含10%胎牛血清的DMEM细胞培养基在恒温恒湿培养箱(37℃,5%CO2)中培养。常规传代,2~3 d换液1次。
2.2 阿司匹林处理人乳腺癌细胞株MDA-MB-231细胞
MDA-MB-231细胞贴壁80%时,弃培养液,常规消化,800 r/min离心5 min,离心半径9.5 cm。将细胞重新种到6孔板中,分为空白对照组和加药实验组(包括高、中、低3个亚组),其中,高、中、低组阿司匹林浓度分别为1080、720、486 μg/mL。分别在37℃,5% CO2条件下避光孵育36 h。
2.3 对照品储备液制备
精密称取乙酰水杨酸对照品100 mg,置于100 mL容量瓶中,加入一定量的乙醇将其溶解,定容,于-20 ℃保存,备用。
2.4 样品处理
2.4.1 细胞内液处理
吸取细胞培养液的上清液,留作细胞外液测定,备用。贴壁细胞用胰酶消化,800 r/min离心5 min,离心半径9.5 cm,再加入0.30 mol/L的盐酸乙醇溶液10.0 mL,混匀震荡3 min,于-78℃快速冷冻,再于37℃迅速解冻后超声5 min(70 W)。重复进行3次冻融超声,然后5000 r/min离心10 min,取上清液备用。
2.4.2 细胞外液处理
取“2.4.1”项下的备用上清液10 mL,加入三氯醋酸1.63 g,混匀,沉淀蛋白,再加入2.0 mol/L氢氧化钠溶液800 μL,5000 r/min离心10 min,取適量上清液备用。
2.5 紫外分光光度法分析
2.5.1 测定波长的选择
取一定量的阿司匹林对照品储备液,加入乙醇稀释,制成含阿司匹林80 μg/mL的溶液,并于240~400 nm波长范围内进行紫外扫描,选择最大吸收波长276 nm作为阿司匹林含量测定的检测波长。
2.5.2 线性关系考察
2.5.2.1 标准曲线绘制 取“2.3”项下对照品储备液,精密吸取对照品储备液0.3、0.4、0.6、0.8、1.0、1.2、1.3 mL,置于10 mL量瓶中,分别以乙醇为溶剂稀释、定容,于276 nm波长处测定其吸光度,以浓度为横坐标(X),以吸光度为纵坐标(Y)绘制标准曲线:Y=0.006X+0.005(r = 0.9995,n=5)。
2.5.2.2 细胞外液制备及标准曲线绘制 将空白对照组细胞外液及加药实验组的高(1080 μg/mL)、中(720 μg/mL)、低(486 μg/mL)组的细胞外液分别稀释5倍,于276 nm波长处测得吸光度在0.2~0.9。分别吸取0.3、0.4、0.6、0.8、1.0、1.2、1.3 mL的对照品储备液,置于10 mL容量瓶中,并用稀释5倍的细胞外液定容。以稀释5倍的细胞外液为空白,于276 nm波长处测定吸收度,以浓度为横坐标(X),以相应的吸光度为纵坐标(Y)绘制标准曲线:Y=0.006X+0.061(r = 0.9995,n = 5),其在30~130 μg/mL范围内细胞外液阿司匹林浓度与吸光度线性良好。
2.5.2.3 细胞内液制备及标准曲线绘制 将空白对照组细胞内液及加药实验组的高(1080 μg/mL)、中(720 μg/mL)、低(486 μg/mL)组细胞内液,于276 nm波长处测定吸光度均在0.2~0.9。分别取0.3、0.4、0.6、0.8、1.0、1.2、1.3 mL的对照品储备液,置于10 mL容量瓶中,用细胞内液定容。以细胞内液为空白,在276 nm波长处测定吸收度,以浓度为横坐标(X),以相应的吸光度为纵坐标(Y)绘制标准曲线:Y=0.007X-0.021(r = 0.9995,n = 5),其在30~130 μg/mL范围内细胞内液阿司匹林浓度与吸光度线性良好。
2.5.3 精密度试验
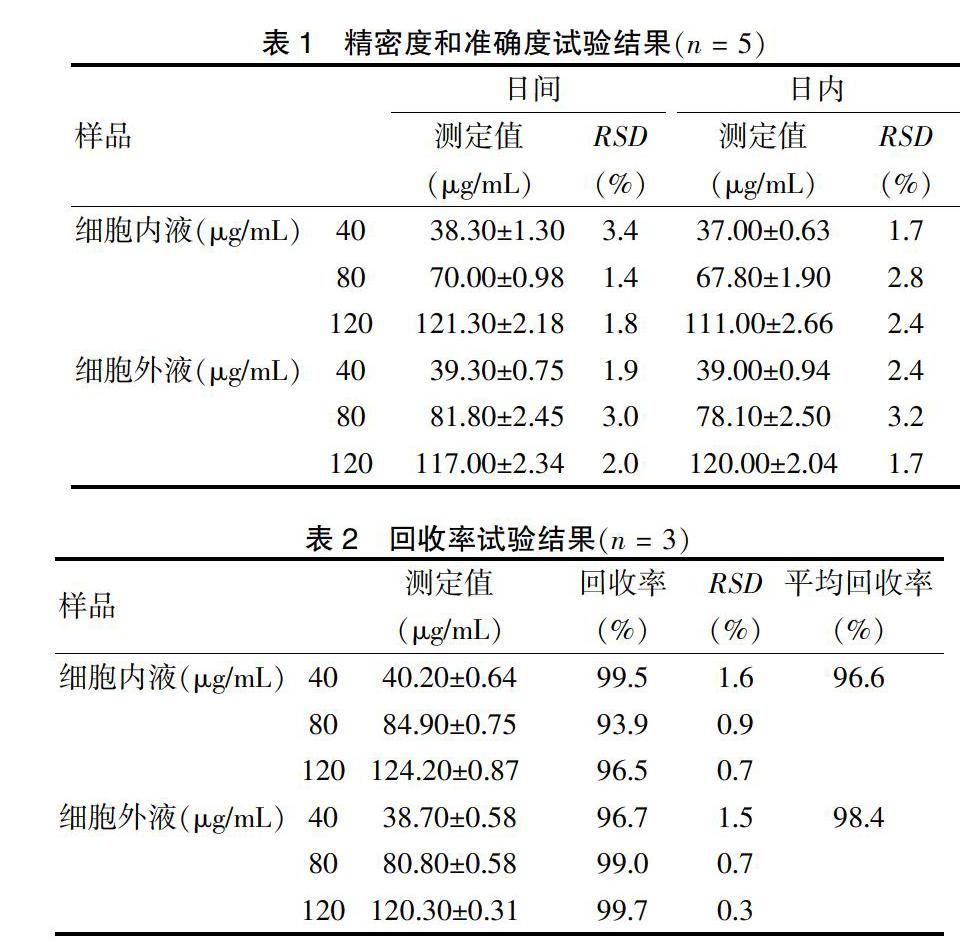
制备高(120 μg/mL)、中(80 μg/mL)、低(40 μg/mL)3种浓度的细胞内、外液样品,按“2.5.2.2”“2.5.2.3”项下的方法分别处理,采用1 d内测定5次,每2 h测定1次的方法考察乳腺癌细胞株MDA-MB-231细胞内、外液样品日内精密度。采用连续测定5 d,每天测定1次的方法得到人乳腺癌细胞株MDA-MB-231细胞内、外液日间精密度。细胞内、外液日内和日间精密度结果见表1。
2.5.4 重现性试验
取含阿司匹林的细胞内、外液,按“2.2”项下制备供试品溶液6份,按“2.5.2.2”“2.5.2.3”项下标准曲线分别进行测定,每份供试品测定3次,取均值,测得细胞内、外液RSD分别为1.72%、2.38%。表明该法重现性较好。
2.5.5 回收率试验
制备高(120 μg/mL)、中(80 μg/mL)、低(40 μg/mL)3种浓度的人乳腺癌细胞株MDA-MB-231细胞内、外液样品,按照“2.5.2.2”“2.5.2.3”项下的方法分析,计算回收率,得出人乳腺癌细胞株MDA-MB-231细胞内、外液的平均回收率。表2。
2.5.6 定量限和检测限
按照“2.5.2.2”“2.5.2.3”项下方法制备不同浓度的细胞内、外液样品,按定量限和检测限的要求分别进行测定。结果显示:细胞内、外液阿司匹林的定量限均为20 μg/mL,细胞内、外液检测限分别为10、1.25 μg/mL。
2.5.7 含量测定
将人乳腺癌细胞株MDA-MB-231细胞分别种于培养皿中(5×105/皿),分为空白对照组和加药实验组(包括高、中、低3个亚组),其中,高、中、低组阿司匹林浓度分别为1080、720、486 μg/mL。培养36 h后,分别测定各组细胞内、外液中阿司匹林含量。测得人乳腺癌细胞株MDA-MB-231细胞外液中样品浓度分别为562、350、148 μg/mL;人乳腺癌细胞株MDA-MB-231细胞内液中样品浓度分别为425、354、304 μg/mL。
3 讨论
阿司匹林预防乳腺癌的途径可能涉及血小板、炎症、环氧合酶2(COX2)、激素或磷脂酰肌醇-3激酶(PI3K)[14-19],且其作用机制、副作用均与阿司匹林的用量有一定关系。因此,有必要探索简便、可行的测定阿司匹林动态药物浓度的方法,为安全有效使用阿司匹林提供依据。
本研究建立的紫外分光光度法考察了不同药物浓度作用相同时间后细胞内、外的阿司匹林含量变化。结果显示,阿司匹林能够进入乳腺癌细胞MDA-MB-231细胞内液,随着阿司匹林处理浓度的增加,MDA-MB-231细胞内、外液中阿司匹林的含量均呈现增高的趋势,但是低剂量时细胞内、外液中阿司匹林的含量比最高。
2015版《中国药典》规定:阿司匹林含量测定使用酸碱中和滴定法,但其实际操作繁琐,需要分次研磨阿司匹林,终点不易辨认,误差较大。本法的测定对象涉及细胞内、外液,检测灵敏度要求更高。为提高细胞内液药物检测灵敏度,本研究采用反复冻融破碎细胞膜,加入三氯醋酸沉淀蛋白,不仅提高细胞外液药物检测灵敏度,而且缩短样品处理时间[20]。该法测定阿司匹林细胞内、外液含量简便、准确,可用于快速分析人乳腺癌细胞株MDA-MB-231细胞内、外液的药物浓度。
[参考文献]
[1] 蔡忠林,馬骥,王朝阳,等.阿司匹林预防肿瘤的研究进展[J].现代肿瘤医学,2017,25(8):1329-1332.
[2] Burn J,Sheth H. The role of aspirin in preventing colorectal cancer [J]. Br Med Bull,2016,119(1):17-24.
[3] Elwood PC,Morgan G,Pickering JE,et al. Aspirin in the treatment of cancer: reductions in metastatic spread and in mortality: a systematic review and meta analyses of published studies [J]. PLoS One,2016,11(4):e0152402.
[4] Huang XZ,Gao P,Sun JX,et al. Aspirin and nonsteroidal anti-inflammatory drugs after but not before diagnosis are associated with improved breast cancer survival:a meta-analysis [J]. Cancer Causes Control,2015,26(4):589-600.
[5] Zhong S,Zhang X,Chen L,et al. Association between aspirin use and mortality in breast cancer patients: a meta-analysis of observational studies [J]. Breast Cancer Res Treat, 2015,150(1):199-207.
[6] Holmes MD,Chen WY,Li L,et al. Aspirin intake and survival after breast Cancer [J]. J Clin Oncol,2010,28(9):1467-1472.
[7] 郑刚.阿司匹林预防肿瘤的研究进展[J].世界临床药物,2017,38(4):217-223.
[8] 国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2015:544-548.
[9] 梅文君,陈晓文,顾方.阿司匹林的质量检测手段和含量测定方法[J].上海医药,2011,32(9):453-454.
[10] 王晨霞,舒余琪.紫外分光光度法阿司匹林肠溶片中阿司匹林的含量测定[J].广东化工,2014,41(23):200-201.
[11] 何英梅,贺军权.小剂量阿司匹林肠溶片含量测定方法商榷[J].中国药事,2005,19(2):46-47.
[12] 李飞玲.HPLC与UV测定阿司匹林肠溶片中阿司匹林和水杨酸的含量[J].长治医学院学报,2011,25(1):11-13.
[13] 陈剑鸿,夏培元,王章阳,等.高效液相色谱法测定U87细胞内外液中的阿霉素含量[J].中国医院药学杂志,2010, 30(5):353-356.
[14] Ornelas A,Zacharias-Millward N,Menter DG.,et al. Beyond COX-1:the effects of aspirin on platelet biology and potential mechanisms of chemoprevention [J]. Cancer Metastasis Rev,2017,36(2):289-303.
[15] Lichtenberger L,Fang D,Bick RJ,et al. Unlocking aspirin chempreventive activity:role of irreversibly inhibiting platelet cyclooxygenase-1 [J]. Cancer Prev Res,2016,10(2):142-151.
[16] 冯鹏辉,薛步升,廖芷绮,等.阿司匹林的肿瘤免疫调节作用与机制[J].中国免疫学杂志,2017,33(9):1435-1440.
[17] Liu S,Tang Y,Yan M,et al. PIK3CA mutation sensitizes breast cancer cells to synergistic therapy of PI3K inhibition and AMPK activation [J]. Invest New Drugs,2018, 36(5):763-772.
[18] Henry WS,Laszewski T,Tsang T,et al. Aspirin Suppresses Growth in PI3K-Mutant Breast Cancer by Activating AMPK and Inhibiting mTORC1 Signaling [J]. Cancer Res,2017,77(3):790-801.
[19] 杨阳,杨南,刘玉翠,等.阿司匹林抗肿瘤作用机制的研究进展[J].吉林医药学院学报,2016,37(4):301-303.
[20] Ma J,Cai Z,Wei H,et al. The anti-tumor effect of aspirin: What we know and what we expect [J]. Biomed Pharmacother,2017,95(11),656-661.
(收稿日期:2018-11-30 本文編辑:王 蕾)
