参附注射液对脓毒症小鼠免疫调节及炎症因子的影响
2019-10-30赵锋利冼绍祥罗苑苑王澍欣徐运升林新峰
赵锋利 冼绍祥 罗苑苑 王澍欣 徐运升 林新峰
[摘要] 目的 探討参附注射液对脓毒症小鼠免疫调节及炎症因子的影响。 方法 选取120只10周龄SPF级雄性C57BL/6小鼠,按随机数字表法将其分为对照组、假手术组、脓毒症模型组、参附注射液治疗组,每组30只。采用盲肠结扎穿孔法制备脓毒症小鼠模型。对照组、假手术组和脓毒症模型组于术后第1天开始腹腔注射生理盐水[4 mL/(kg·BW),共3 d],参附注射液治疗组腹腔注射参附注射液[4 mL/(kg·BW),共3 d]。采用酶联免疫吸附实验检测各组小鼠T淋巴细胞亚群;采用苏木精-伊红染色法评价器官病理损伤及炎症细胞浸润情况。 结果 与对照组比较,假手术组白细胞介素-4(IL-4)、IL-17、γ干扰素(IFN-γ)、IL-10水平及IFN-γ/IL-4、IL-10/IL-17差异无统计学意义(P > 0.05)。与假手术组比较,脓毒症模型组IFN-γ、IL-10水平均显著降低,IL-4和IL-17水平显著升高,IFN-γ/IL-4、IL-10/IL-17均显著降低,差异均有统计学意义(P < 0.05);其心脏、肺、肾脏病理损伤严重,炎症细胞浸润均增加(P < 0.05);与脓毒症模型组比较,参附注射液治疗组IFN-γ、IL-10水平均升高,IL-4、IL-17水平均降低,IFN-γ/IL-4、IL-10/IL-17均升高,但低于对照组,差异均有统计学意义(均P < 0.05);其器官病理损伤明显缓解,炎症细胞浸润情况减轻(P < 0.05)。 结论 参附注射液能够调节脓毒症小鼠的免疫系统,抑制炎性反应,减轻器官损伤。
[关键词] 脓毒症;参附注射液;免疫调节;炎性反应
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2019)08(a)-0021-05
[Abstract] Objective To investigate the effects of Shenfu Injection on immuno regulation and inflammatory factors in septic mice. Methods A total of 120 10-week-old SPF male C57BL/6 mice were selected and divided into control group, sham operation group, septic model group and Shenfu Injection treatment group according to random number table method, with 30 rats in each group. A septic mice model was prepared by cecal ligation and perforation. The control group, sham-operated group and sepsis model group were given intraperitoneal injection of saline [4 mL/(kg·BW) for 3 days] respectively on the first day after operation, and Shenfu Injection group was given intraperitoneal injection of Shenfu Injection [4 mL/(kg·BW) for 3 days] at the same time. T lymphocyte subsets in each group were detected by enzyme-linked immunosorbent assay, hematoxylin-eosin staining was used to evaluate organ pathological damage and inflammatory cell infiltration. Results Compared with the control group, the levels of interleukin-4 (IL-4), IL-17, interferon γ (IFN-γ), IL-10 and IFN-γ/IL-4, IL-10/IL-17 in sham operation group had no significant difference (P > 0.05). Compared with sham-operated group, the levels of IFN-γ and IL-10 in sepsis model group were significantly decreased, IL-4 and IL-17 were significantly increased, and IFN-γ/IL-4 and IL-10/IL-17 were significantly decreased, the differences were statistically significant (P < 0.05), and its pathological damage of heart, lung and kidney was serious, and the infiltration of inflammatory cells was increased (P < 0.05). Compared with sepsis model group, the levels of IFN-γ and IL-10 increased, IL-4 and IL-17 decreased, IFN-γ/IL-4 and IL-10/IL-17 increased in Shenfu injection treatment group, but were lower than those in control group, the difference were statistically significant (P < 0.05), and its pathological damage of organs was relieved and the infiltration of inflammatory cells was alleviated (all P < 0.05). Conclusion Shenfu Injection can regulate the immune system of sepsis mice, inhibit inflammation and alleviate organ damage.
[Key words] Sepsis; Shenfu Injection; Immuno regulation; Inflammatory response
脓毒症是各种严重创伤、烧伤、缺血缺氧常见的并发症,是急危重患者死亡的主要原因之一[1]。据统计,全球每年每天约有14 000人死于脓毒症,并其速度仍在不断增长[2]。近年来,随着研究的不断深入,对脓毒症机制的认识取得了一定的进展,但其治疗效果仍差强人意[3-4]。因此,进一步寻求治疗脓毒症的有效方法具有十分重要的意义。目前,研究[5-6]认为T淋巴细胞介导的炎症平衡与脓毒症的发生、进展存在密切关系,部分中药可以调节此平衡,具有良好的疗效。本研究拟探讨参附注射液对脓毒症模型小鼠的免疫因子及炎症介质的影响,分析参附注射液对脓毒症器官的保护作用。
1 材料与方法
1.1 实验动物
实验动物雄性C57BL/6小鼠120只,健康状况良好,SPF级,10周龄,体质量30~35 g,购自广东省医学实验动物中心,合格证号:2017X119231-2。小鼠自由进食饮水,室内温度(22±2)℃,人工光暗周期12 h。所有实验均遵循喀什广东科学技术研究院动物伦理规范。
1.2 仪器与试剂
BIOPAC SYSTEMS生理系统记录仪、Anke TDL-5低温离心机、TB电子体温计、Olympus显微镜系统等实验所需仪器均由广州中医药大学第一附属医院中心实验室提供。
参附注射液购自华润三九药业有限公司(生产批号:2017042303);小鼠白细胞介素酶联免疫吸附试验检测试剂盒(生产批号:BY2016112398E)购自武汉碧云天生物科技有限公司;苏木精-伊红染色试剂盒(生产批号C0106-2)购自武汉谷歌生物科技有限公司。
1.3 脓毒症模型制备及分组
采用盲肠结扎穿孔法构建小鼠脓毒症模型:术前禁食禁水12 h,麻醉后剪毛,无菌条件下沿下腹部正中线切开,暴露盲肠,避免损伤血管,8号线结扎盲肠中部,用22号针穿刺盲肠2次,挤出少许肠内容物,缝合切口。盲肠结扎穿孔手术后立即腹腔注射生理盐水进行液体复苏。术后3 h开始药物处理[7]。
将盲肠结扎穿孔小鼠随机分为脓毒症模型组和参附注射液治疗组,每组30只。参附注射液治疗组小鼠腹腔注射参附注射液[4 mg/(kg·BW)],连续3 d。脓毒症模型组小鼠腹腔注射生理盐水[4 mg/(kg·BW)],连续3 d。假手术组小鼠30只,腹部切开再缝合,不处理肠道,给予腹腔注射生理盐水[4 mg/(kg·BW)],连续3 d。对照组小鼠30只,不做任何手术处理。于其他组给药同时给予腹腔注射生理盐水[4 mg/(kg·BW)],连续3 d。
1.4 小鼠组织病理学检测
给药完成后取各组小鼠左心室、左肺、左腎组织制作石蜡切片,采用二甲苯浸洗3次,再分别用梯度乙醇(100%、95%、90%、80%、65%)处理1次,染色,在光学高倍镜下观察器官组织病理学改变并拍照,对组织炎症细胞浸润程度进行半定量检测。
炎症细胞浸润半定量方法:在低倍显微镜下,对每一张切片随机取5个视野,然后在高倍显微镜拍照,使用Image J测量选择范围的面积并计数炎症细胞数量,取炎症细胞数量均值/面积(个/mm2)代表此张切片炎症细胞浸润情况。
1.5 酶联免疫吸附法检测炎性细胞因子水平
取各组小鼠外周血1 mL,在4℃条件下5000 r/min离心10 min,分离得到小鼠血清,采用酶联免疫吸附实验检测辅助性T细胞1(Th1)、Th2、调节性T细胞(Treg)和Th17细胞因子、白细胞介素-4(IL-4)、IL-17、γ干扰素(IFN-γ)、IL-10水平。
1.6 统计学方法
采用SPSS 12.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较比较采用单因素方差分析,两组间比较采用LSD检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 各组小鼠死亡率比较
对照组和假手术组小鼠在观察窗内无死亡;脓毒症模型组小鼠3 d存活10只(生存率:33.33%),参附注射液治疗组小鼠3 d存活19只(生存率:63.33%)。参附注射液治疗组小鼠的生存率明显高于脓毒症模型组,差异有统计学意义(P < 0.05)。
2.2 各组小鼠T淋巴细胞相关炎性细胞因子比较
与对照组比较,假手术组IL-4、IL-17、IFN-γ、IL-10水平及IFN-γ/IL-4、IL-10/IL-17差异无统计学意义(P > 0.05)。与假手术组比较,脓毒症模型组IFN-γ、IL-10水平均显著降低,IL-4和IL-17水平显著升高,IFN-γ/IL-4、IL-10/IL-17均显著降低,差异均有统计学意义(均P < 0.05);其心脏、肺、肾脏病理损伤严重,炎症细胞浸润均增加(P < 0.05)。与脓毒症模型组比较,参附注射液治疗组IFN-γ、IL-10水平均升高,IL-4、IL-17水平均降低,IFN-γ/IL-4、IL-10/IL-17均升高,但低于对照组,差异均有统计学意义(均P < 0.05)。见表1。
2.3 各组小鼠器官病理改变及炎症细胞浸润情况比较
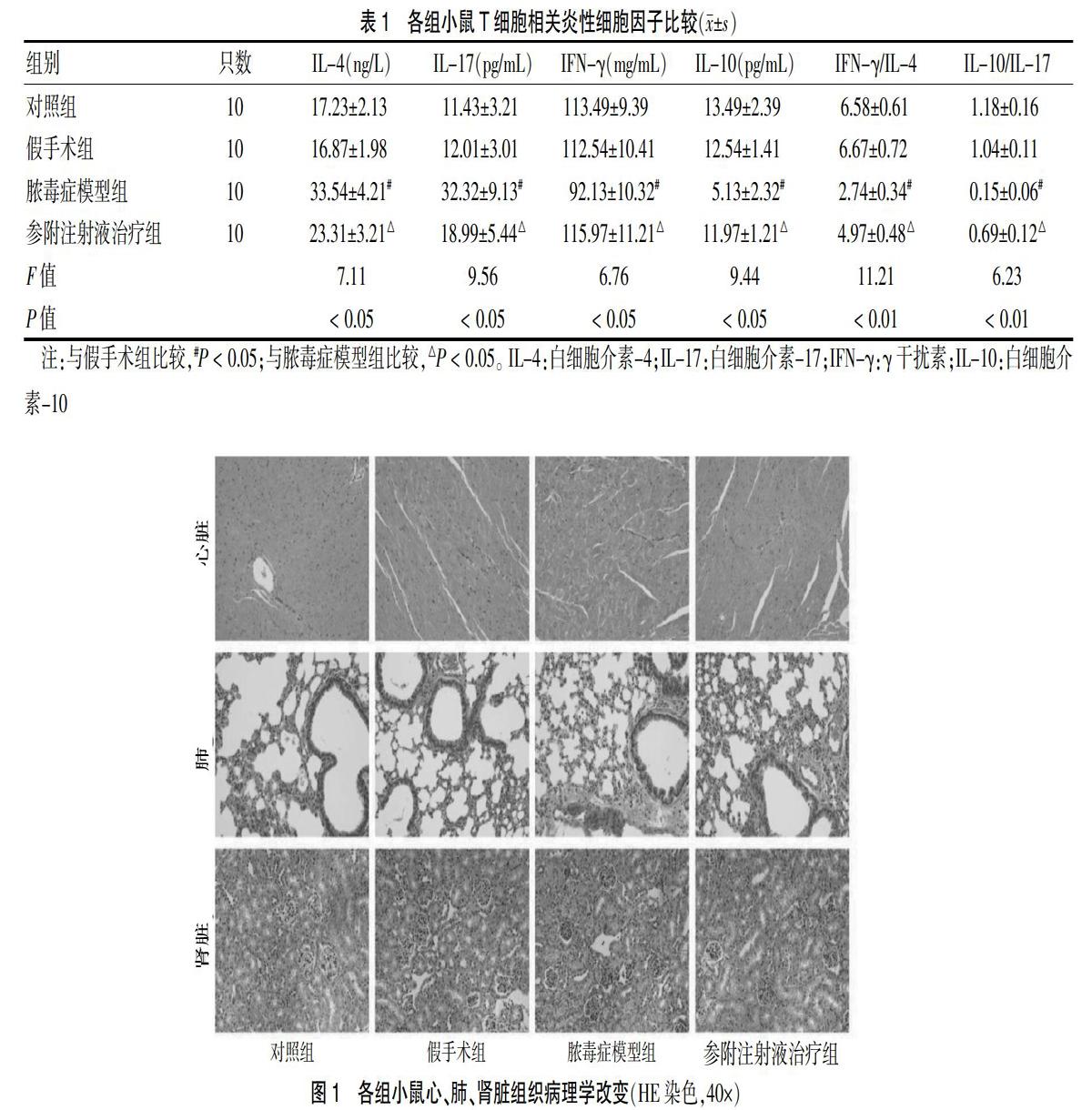
对照组及假手术组:小鼠心肌形态正常,细胞排列致密整齐,细胞无肿胀;肺泡结构完整,内皮细胞形态正常,肺泡内无渗液,炎症细胞浸润少;肾小球、肾小管正常,肾小管上皮细胞无变性、萎缩、坏死或炎症细胞浸润,管腔无扩张(图1)。
脓毒症模型组小鼠器官组织出现明显的病理变化:部分心肌细胞肿胀,排列紊乱,存在细胞核碎裂现象;气道上皮细胞肿胀、部分脱落,基底膜较厚,结构模糊,炎症细胞浸润显著增加,肺泡结构损伤,肺泡内大量渗出;肾近曲小管细胞肿胀,管腔消失,部分小管上皮坏死,炎症细胞浸润明显(图1)。
与脓毒症模型组比较,参附注射液治疗组小鼠上述器官组织病理学变化得到不同程度的缓解:心脏病理组织切片可见心肌结构尚存,心肌细胞排列较整齐,细胞无肿胀,未见明显碎裂细胞核;肺泡结构改善,肺泡内渗出明显减少,炎症细胞浸润减少;肾近曲小管细胞肿胀情况明显减轻,炎症细胞浸润减少(图1)。
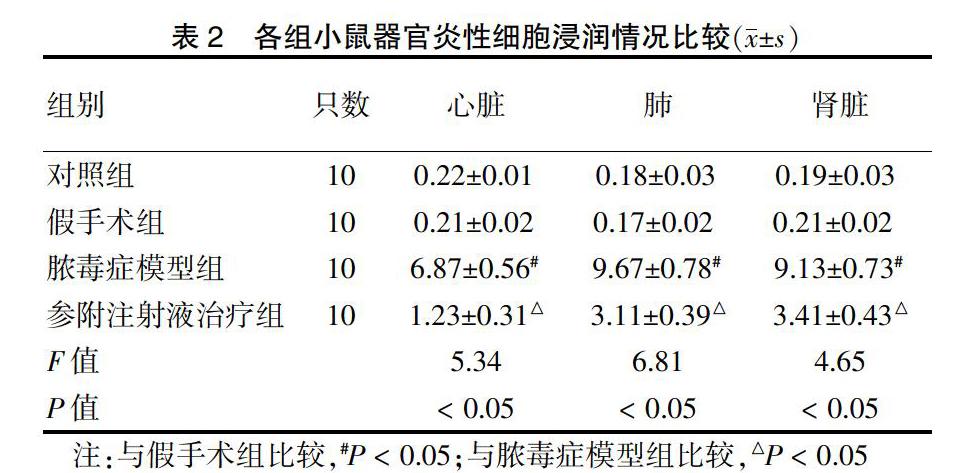
器官组织炎症细胞浸润情况的半定量分析结果显示:假手术组和对照组炎症细胞浸润比较,差异无统计学意义(P > 0.05);与假手术组比较,脓毒症模型组炎症细胞浸润显著增加(P < 0.05),提示脓毒症小鼠机体产生严重的炎性反应。与脓毒症模型组比较,参附注射液治疗组炎症细胞浸润减轻(P < 0.05),提示参附注射液能调节炎症因子从而降低脓毒症小鼠的炎性反应。见表2。
3 讨论
近年来,越来越多的研究[7]表明,脓毒症患者存在着免疫功能紊乱,若不能及时纠正,可能发展为免疫系统“麻痹”,诱发炎症瀑布级联反应,造成多器官功能损伤甚至衰竭。因此,深入探讨脓毒症免疫功能紊乱的病理生理基础,可为进一步其预防和治疗开拓新方法、新思路[9]。本研结果提示,参附注射液能够调节脓毒症小鼠Th1/Th2、Treg/Th17平衡,调节免疫,抑制炎性反应,减轻器官损伤。
T淋巴细胞具有重要的免疫调节功能。学界依据其表达细胞因子及功能的异同将其分为4类:①Th1通过产生IFN-γ等,阻断免疫球蛋白E合成,对速发型超敏反应有抑制作用,参与抵御细胞内致病因素;②Th2通过分泌IL-4,对B淋巴细胞免疫应答抗原表达起正调节作用,参与抵御细胞外致病因素;③Th17通过分泌IL-17等促炎因子刺激成纤维细胞、上皮细胞、内皮细胞产生多种细胞因子,如IL-6、IL-1、肿瘤坏死因子-α(TNF-α)、粒细胞-巨噬细胞刺激因子(GM-CSF)及细胞黏附分子1(CAM-1),诱发一系列传递信号而介导炎症、感染等的发生和发展;④Treg細胞是由外周幼稚T细胞发育而成,主要通过分泌IL-10等发挥免疫负调控作用,即抑制幼稚型和记忆型T淋巴细胞增殖反应,维持机体内环境稳定[10-11]。正常情况下,Th1、Th2、Th17和Treg细胞及其分泌的细胞因子处于动态平衡,维持机体正常的免疫功能。脓毒症病理生理过程中,Th1/Th2及Th17/Treg失衡被证实为重要的免疫机制[12]。研究[13]显示,脓毒症患者出现Th2介导的免疫反应增强而Th1介导的免疫反应减弱的征象,具体表现为患者外周血IL-4水平的高表达而炎症抑制因子IFN-γ活性的降低,免疫球蛋白E浓度增加及嗜酸性粒细胞过度聚集、浸润,导致多个器官损伤及功能下降。本研究结果显示,与假手术组比较,脓毒症模型组小鼠IFN-γ/IL-4显著降低,提示小鼠此时存在明显的Th1/Th2平衡失调。此外,脓毒症患者在受到外源性细菌、病毒等刺激处于超敏反应状态时,Th17/Treg的功能平衡也被打破,IL-17分泌显著增多,诱导大量炎症细胞尤其是中性粒细胞黏附、趋化,进一步加重器官的炎症级联反应和损伤[14]。与此同时,Treg细胞通过分泌IL-10和肿瘤坏死因子-β(TNF-β)等抑制嗜酸性粒细胞的活化,减少促炎因子的分泌从而缓解器官炎性反应,抑制甚至阻断炎症级联反应[15]。本研究脓毒症模型组IL-10/IL-17较对照组显著降低,进一步证实Th17/Treg平衡失调的结论。
参附注射液是临床常用的药物,源于宋代名医严永和《济生方》记载的“参附汤”,人参长于扶正补虚;附子善于回阳救逆,两药合用具有回阳救逆、益气固脱的作用。现代药理及分子生物研究[16]表明,参附注射液可有效降低休克大鼠外周血内毒素水平,减轻毛细管渗漏造成的血管和器官的损害,其抗炎作用还与增高机体糖皮质激素水平相关。参附注射液抑制脓毒血症性休克大鼠心肌组织核因子κB(NF-κB)信号通路的激活及其介导的促炎因子TNF-α等过度表达,促进抗炎因子IL-10等产生,恢复促炎/抗炎平衡,防止过度炎性反应和免疫抑制[17]。参附注射液通过抑制NF-κB核因子p65磷酸化,进而降低IL-6水平,在全身炎性反应中起保护作用[18]。体外研究[19-20]证实,参附注射液可以明显改善脓毒性休克患者的内皮细胞功能,限制炎性反应和继发器官损伤,同时还可以提高机体免疫力。本研究参附注射液组小鼠Th1/Th2及Th17/Treg的比值较脓毒症模型组均有明显升高,提示参附注射液能够恢复Th1/Th2及Th17/Treg平衡。
综上,本实验采用盲肠结扎穿孔方式复制脓毒症小鼠模型,脓毒症模型组小鼠出现明显的Th1/Th2及Th17/Treg功能失调。经参附注射液治疗后,可改善小鼠Th1/Th2及Th17/Treg平衡,抑制炎症因子对心脏、肺、肾脏组织的浸润损伤,实现保护器官的作用。
[参考文献]
[1] Singer M,Deutschman CS,Seymour CW,et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3) [J]. JAMA,2016,315(8):801-810.
[2] Martínez ML,Ferrer R,Torrents E,et al. Impact of Source Control in Patients With Severe Sepsis and Septic Shock [J]. Crit Care Med,2017,45(1):11-19.
[3] Miroslav V,Nevena G,Denis B,et al. The relationship between the immune system and oral manifestations of inflammatory and oral manifestations of inflammatory bowel disease [J]. Cent Eur J Immunol,2016,41(3):302-310.
[4] 陈如杰,张明,潘利伟,等.参附注射液对感染性体克患者炎症反应及免疫功能影响的临床对照研究[J].中华中医药学刊,2015,33(10):2461- 2464.
[5] Askim ?魡,Moser F,Gustad LT,et al. Poor performance of quick-SOFA (qSOFA) score in predicting severe sepsis and mortality - a prospective study of patients admitted with infection to the emergency department [J]. Scand J Trauma Resusc Emerg Med,2017,25(1):56.
[6] Dorsett M,Kroll M,Smith C S,et al. qSOFA Has Poor Sensitivity for Prehospital Identification of Severe Sepsis and Septic Shock [J]. Prehosp Emerg Care,2017,21(4):489-497.
[7] Caironi P,Masson S,Mauri T,et al. Pentraxin 3 in patients with severe sepsis or shock: the ALBIOS trial [J]. Euro J Clin Invest,2017,47(1):73-83.
[8] 姚詠明,盛志勇.Janus激酶/信号转导子和转录激活因子通路与创伤脓毒症的关系[J].解放军医学杂志,2004,29(1):27-29.
[9] Iskander KN,Osuchowski MF,Stearns-Kurosawa DJ,et al. Sepsis:multiple abnormalities,heterogeneous responses,and evolving understanding [J]. Physiol Rev,2013,93(3):1247-1288.
[10] 姚咏明,张立天,陆家齐,等.脓毒症大鼠肾组织高迁移率族蛋白对肿瘤坏死因子表达的影响[J].解放军医学杂志,2002,27:757-759.
[11] Wong HR,Cvijanovich NZ,Anas N,et al. Developing a clinically feasible personalized medicine approach to pediatric septic shock [J]. Am J Respir Crit Care Med. 2015, 191(3):309-315.
[12] 易凡,尚玉强,李炳,等.参附注射液对心肌缺血再灌注损伤模型大鼠的保护作用[J].中国老年学杂志,2017, 39(1): 58-61.
[13] 马建生,杨晓丽.参附注射液对脓毒性休克患者内皮细胞功能的影响[J].中国老年学杂志,2016,7(33):3244-3215.
[14] 陈如杰,张明,潘利伟,等.参附注射液对感染性休克患者炎症反应及免疫功能影响的临床对照研究[J].中华中医药学刊,2015,33(10):2161.
[15] 傅声武.参附注射液对脓毒症休克血流动力学的影响[J].医学临床与教育,2011,12(6):681-682.
[16] 黄梅青,朱燕华,赵世元.石仙桃多糖对肺炎支原体感染模型小鼠Th1/Th2细胞因子表达的影响[J]中国医药导报,2018,15(8):15-19.
[17] 文丽丹,杨海玉.Th17淋巴细胞与风湿免疫性疾病关系的研究进展[J]中国医药导报,2017,14(26):49-52.
[18] 程涛,伍伟玲,黄河.肺结核患者Th1/Th2/Treg/Th17免疫应答的临床研究[J]中国医药导报,2017,14(26):109-112.
[19] 曾清,陆海颂,程纬民,等.参萸补血方对再生障碍性贫血模型小鼠Th17细胞及其相关因子IL-6、IL-17及IL-23表达水平的影响[J].中国医药导报,2018,15(12):13-16.
[20] 孙淑荣,刘业清,王荣辉.参附注射液对严重脓毒血症和脓毒性休克早期复苏的干预研究[J].中国中医急症,2007,16(10):1214-1215.
(收稿日期:2018-12-25 本文编辑:王 蕾)
