高糖对肝脏胰高血糖素受体的表达及作用影响
2019-10-30刘梦丹冀琳琳叶阳祝超瑜肖元元高清歌魏丽
刘梦丹 冀琳琳 叶阳 祝超瑜 肖元元 高清歌 魏丽
[摘要] 目的 觀察db/db小鼠肝组织和高糖对待的肝癌细胞株HepG2细胞中胰高血糖素受体(GCGR)的表达及作用的变化。 方法 db/db小鼠和对照小鼠均进行腹腔注射葡萄糖耐量试验(IPGTT)和腹腔注射胰岛素耐量试验(IPITT),收集两组小鼠的血液进行生化指标检测;采用Western blot或免疫组化法检测两组小鼠肝脏中GCGR、蛋白激酶A(PKA)、磷酸化蛋白激酶A(p-PKA)的表达情况。采用Western blot法检测在无胰高血糖素(GLN)刺激下,不同糖浓度或不同时间梯度高糖(30 mmol/L)处理的HepG2细胞GCGR的表达情况,以及在GLN刺激下,不同时间梯度高糖处理的HepG2细胞GCGR、PKA、p-PKA蛋白的表达情况。 结果 与对照小鼠比较,db/db小鼠肝脏GCGR表达增加,而PKA磷酸化水平下降(P < 0.05或P < 0.01)。HepG2细胞的GCGR蛋白表达水平随葡萄糖浓度增加而升高,随高糖作用时间延长先下降后升高(均P < 0.01)。GLN刺激下,随着高糖对待时间的增加,GCGR蛋白表达水平逐渐升高(均P < 0.01);p-PKA/PKA水平则较对照组(0 h)降低(P < 0.05或P < 0.01)。 结论 慢性高糖可增加肝脏GCGR的表达,并导致肝脏胰高血糖素抵抗。
[关键词] 胰高血糖素受体;胰高血糖素抵抗;糖尿病;db/db小鼠;HepG2细胞
[中图分类号] R587 [文献标识码] A [文章编号] 1673-7210(2019)08(a)-0012-05
[Abstract] Objective To investigate the changes of the expression and function of glucagon receptor (GCGR) in db/db mice liver and hepatocellular carcinoma cell line HepG2 cells treated with high glucose. Methods Intraperitoneal glucose tolerance test (IPGTT) and intraperitoneal insulin tolerance test (IPITT) were performed in both db/db mice and control mice. The blood of mice in the two groups was collected for biochemical test; the expression of GCGR, protein kinase A (PKA) and phosphorylated protein kinase A (p-PKA) in the liver of the two groups were detected by Western blot or immunohistochemistry. The expression of GCGR in HepG2 cells treated with high glucose (30 mmol/L) in different glucose concentrations or different time gradients was detected by Western blot without stimulation of glucagon (GLN). Under GLN stimulation, the expression of GCGR, PKA and p-PKA proteins in HepG2 cells treated with high glucose at different time gradients was also detected by Western blot. Results Compared with control mice, the expressions of GCGR were markedly elevated in liver of db/db mice, but phosphorylated PKA levels were decreased (P < 0.05 or P < 0.01). GCGR protein expressions were increased following the growth of glucose concentrations in HepG2 cells, meanwhile, the expressions of GCGR protein were decreased at first, then increased with time extended (all P < 0.01). Under GLN stimulation, the GCGR protein levels were upregulated by high glucose in a time-dependent manner (P < 0.01). However, p-PKA/PKA levels were decreased compared with control group (0 h) (P < 0.05 or P < 0.01). Conclusion Chronic hyperglycemia can increase the expression of GCGR in the liver and lead to glucagon resistance in the liver.
[Key words] Glucagon receptor; Glucagon resistance; Diabetes mellitus; db/db mice; HepG2 cell
近年来对糖尿病发病机制的研究发现,胰高血糖素(GLN)分泌过多是造成糖尿病的重要原因之一[1-3]。GLN由胰岛α细胞分泌,主要通过与胰高血糖素受体(GCGR)结合来调节血糖[4]。在肝脏中,其可激活与糖异生有关的酶系,加速糖原分解和糖异生,增加肝糖输出[5]。GCGR是一个具有7次跨膜序列的G蛋白偶联受体,主要分布于肝脏中[6]。GCGR主要的生物学作用是与GLN结合后,通过PKA-cAMP途径和Gq-PLC/Ca2+两种途径发挥调节血糖的作用[7-9],在肝脏中,其主要是通过PKA-cAMP途径。
糖毒性作用可通过增加氧化应激、增加线粒体应激以及造成DNA损伤等多种途径导致胰腺、肝脏等多种脏器的损伤[10]。研究表明,在体内外葡萄糖均可增加GCGR和mRNA的表达[11-12]。慢性高糖对肝脏GCGR蛋白表达及GLN作用的影响目前鲜见报道。本研究以db/db小鼠和高糖对待的HepG2细胞为研究对象,旨在从动物及细胞分子水平探讨慢性高糖对肝脏GCGR的表达及GLN作用的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 HepG2细胞株取自上海交通大学附属第六人民医院(以下简称“我院”)糖尿病研究所。SPF级雄性8周龄小鼠共16只,db/db小鼠及同窝对照db/m小鼠各8只,均购于南京大学模式动物研究所,实验动物使用许可证号:SCXK(苏)2015-0001,合格证号:201803367。小鼠均饲养在20~25℃室温、湿度50%的动物房,普食喂养,自由饮食。本研究经我院动物实验福利伦理委员会审批同意。
1.1.2 试剂 GCGR抗体(Thermo Fisher,美国,货号:PA5-50668);HSP90(货号:4874)、蛋白激酶A(PKA,货号:5842S)、磷酸化蛋白激酶A(p-PKA,T197,货号:5661S)、辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗(货号:7074S)均购自Cell Signaling Technology(美国);羊抗兔二抗(DAKO,丹麦,货号:K5007);GLN(Millipore,美国,货号:05-23-2700);BCA定量试剂盒(上海碧云天生物技术有限公司,货号:P0010);三酰甘油测定试剂盒(南京建成生物工程研究所,货号:A110-1);小鼠胰岛素酶联免疫吸附测定(ELISA)试剂盒(Crystal Chem,美国,货号:90080)。
1.2 方法
1.2.1 动物实验 小鼠适应性喂养1周,进行腹腔注射葡萄糖耐量试验(IPGTT)。禁食16 h后,用2 g/kg D-葡萄糖溶液进行腹腔注射,检测0、15、30、60、90、120 min时小鼠的血糖水平。1周后,进行腹腔注射胰岛素耐量试验(IPITT)。禁食6 h后,腹腔注射胰岛素1.0 U/kg,同样在上述相同时间点测定小鼠的血糖水平。禁食12 h后,将小鼠处死,收集血液行生化指标测定,留取肝脏组织保存于-80℃冰箱。
1.2.2 细胞实验 将HepG2细胞用无糖无血清的培养基孵育2 h后,以不同浓度葡萄糖溶液(5.6、11.2、25、30、50 mmol/L)处理48 h,用甘露醇调节渗透压至50 mmol/L;以30 mmol/L葡萄糖溶液干预细胞不同时间(0、6、12、24、48 h),或在收细胞蛋白前用100 nmol/L的GLN对待细胞15 min,以观察高糖对GLN作用的影响。
1.2.3 Western blot分析 蛋白提取后,BCA法测定蛋白浓度,SDS-PAGE凝胶电泳,转膜、封闭,HSP90、PKA、p-PKA(1∶1000)及GCGR(l∶500)一抗4℃孵育过夜,二抗(1∶1000)室温孵育60 min,曝光。
1.2.4 免疫组化染色 石蜡组织切片脱蜡、脱水,EDTA(pH 9.0)抗原修复,3%双氧水孵育20 min,滴加山羊血清封闭,分别滴加一抗GCGR抗体(1∶50)和即用性羊抗兔二抗,二氨基联苯胺(DAB)显色,镜检拍片。
1.3 统计学方法
采用SPSS 25.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,两组间比较采用t检验,Western blot结果采用Image J分析软件,免疫组化结果采用Image pro plus分析软件,使用Graphpad Prism7做图,以P < 0.05为差异有统计学意义。
2 结果
2.1 两组小鼠的生化指标比较
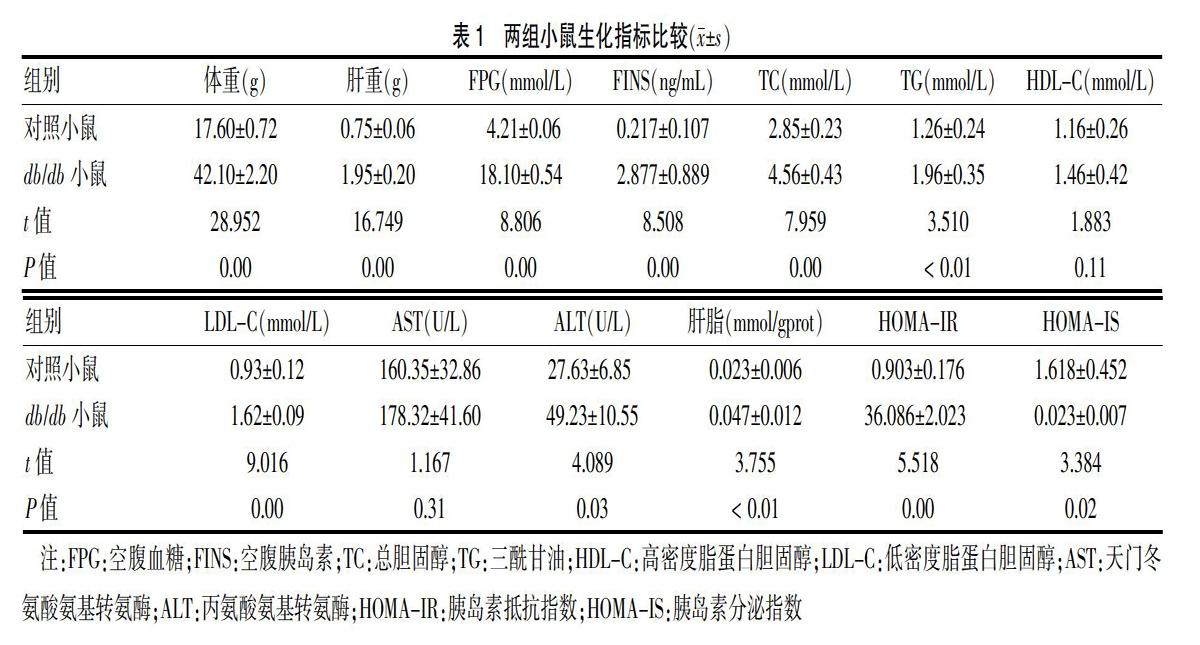
与对照小鼠相比,db/db小鼠体重、肝重、空腹血糖、空腹胰岛素、总胆固醇、三酰甘油、低密度脂蛋白胆固醇、丙氨酸转氨酶、肝脂及胰岛素抵抗指数升高,胰岛素分泌指数降低,差异有统计学意义(P < 0.05或P < 0.01)。见表1。db/db小鼠IPGTT、IPITT各时间点的血糖水平均较对照小鼠升高,差异有高度统计学意义(P < 0.01)。见图1。
2.2 两组小鼠肝脏组织GCGR蛋白表达水平比较
Western blot結果显示,与对照小鼠(0.43±0.02)比较,db/db小鼠GCGR蛋白表达(1.56±0.26)明显升高,差异有高度统计学意义(P < 0.01);免疫组化结果显示,与对照小鼠(1.86±0.34)比较,db/db小鼠肝脏中GCGR表达(14.84±0.31)也明显增加,差异有高度统计学意义(P < 0.01)。见图2(封四)。
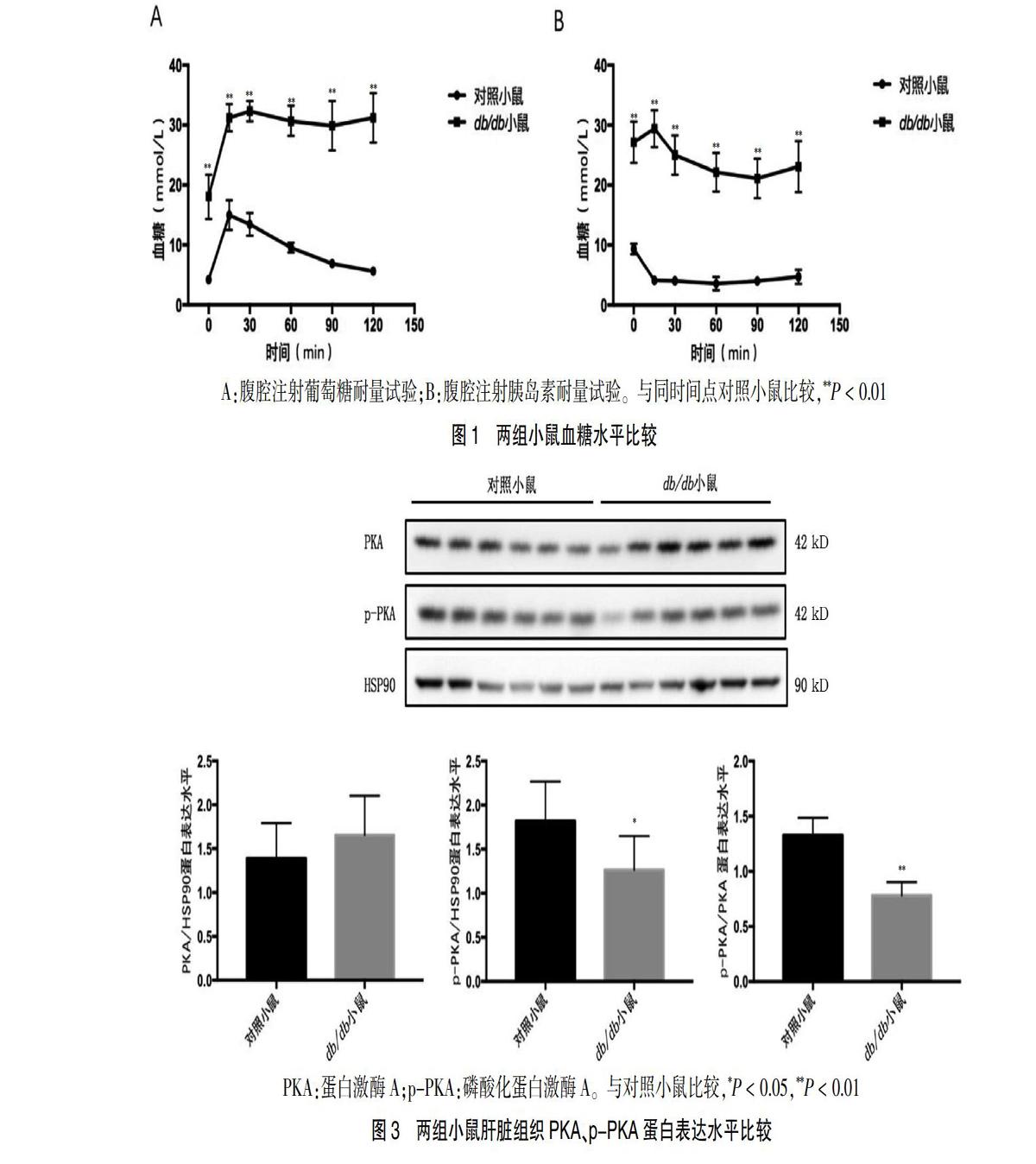
2.3 兩组小鼠肝脏组织PKA磷酸化水平比较
两组小鼠PKA蛋白表达水平比较,差异无统计学意义(P > 0.05)。与对照小鼠(1.82±0.07)比较,db/db小鼠p-PKA蛋白表达水平(1.12±0.08)降低,差异有统计学意义(P < 0.05)。与对照小鼠p-PKA/PKA水平(1.33±0.16)比较,db/db小鼠p-PKA/PKA水平(0.78±0.02)降低,差异有高度统计学意义(P < 0.01)。见图3。
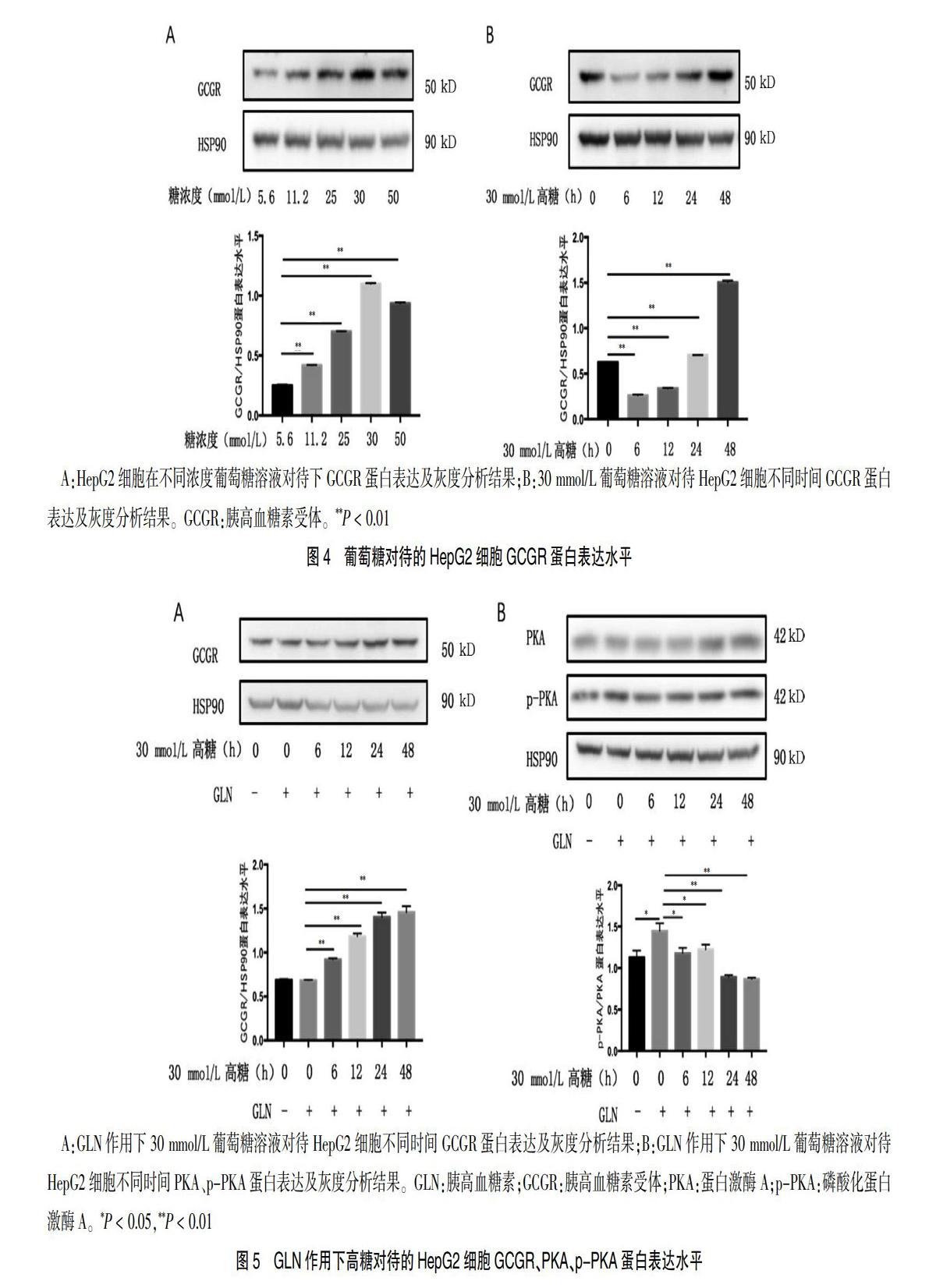
2.4 葡萄糖对无GLN刺激下HepG2细胞GCGR蛋白表达影响的浓度和时间效应
与5.6 mmol/L葡萄糖浓度的对照组比较,11.2~50 mmol/L葡萄糖浓度均可使HepG2细胞GCGR蛋白表达升高,差异有高度统计学意义(P < 0.01),其中30 mmol/L葡萄糖浓度组使HepG2细胞GCGR蛋白表达升高最为明显。与高糖(30 mmol/L)对照组比较,随着高糖作用时间的延长,HepG2细胞GCGR蛋白表达呈现先下降后逐渐升高的趋势,差异有高度统计学意义(P < 0.01),其中48 h时GCGR蛋白表达升高最为明显。见图4。
2.5 高糖对GLN刺激下的HepG2细胞GCGR、PKA、p-PKA表达的影响
在GLN刺激下,与高糖对照组(0 h)比较,随着高糖对待时间的增加,GCGR蛋白表达水平逐渐升高,差异有高度统计学意义(P < 0.01),而p-PKA/PKA水平则随着高糖对待时间的增加而降低,差异有统计学意义(P < 0.05或P < 0.01)。其中,24 h及48 h高糖组GCGR蛋白表达水平约是0 h高糖组的2倍,而24 h及48 h高糖组p-PKA/PKA水平较0 h组约下降40%。见图5。
3 讨论
40多年前,Unger和Orci便提出了“双激素异常”假说:绝对或相对的低胰岛素血症和绝对或相对的高胰高血糖素血症是糖尿病高血糖最核心的原因[13]。研究发现,即使完全破坏β细胞,GCGR小鼠也可不出现高血糖症状且葡萄糖耐量正常[9,14]。而恢复肝脏GCGR表达后小鼠很快表现出高血糖症状,说明GLN及其受体GCGR在糖代谢中发挥重要作用。
慢性高糖可引起胰岛素抵抗,并增加肝癌发病风险[15-16]。糖毒性对GLN作用的影响目前鲜见报道。本实验观察到db/db小鼠肝脏GCGR蛋白表达较对照小鼠显著升高,而GLN的主要信号通路PKA磷酸化水平却下降,说明db/db小鼠肝脏GCGR敏感性下降,存在胰高血糖素抵抗。GLN作用下,随着高糖作用时间的增加,HepG2细胞的GCGR蛋白表达水平逐渐增加,而p-PKA/PKA水平下降,与db/db小鼠的实验结果一致,这种结果将导致GLN刺激糖异生的作用减弱。慢性高糖可导致肝细胞胰高血糖素抵抗,这可能是糖毒性对肝细胞的另一种表现形式,这也可能是糖尿病患者耐受饥饿能力较差而且容易发生低血糖的原因之一。
GCGR的表达受多种因素影响。葡萄糖、糖异生底物甘油及二羟基丙酮、cAMP、肝脏脂肪变、锻炼、年龄、氧浓度等均可影响小鼠肝脏GCGR mRNA的表达[11-12,17-18]。其中葡萄糖对GCGR的表达影响尤其重要。在糖尿病、高糖钳夹下GCGR mRNA表达量均增加,但高糖被纠正后,上述效应便明显减弱[12]。db/db小鼠表现为明显高血糖,肝脏GCGR蛋白表达较对照小鼠明显升高。细胞实验也观察到慢性高糖增加GCGR蛋白表达。结果与既往研究结果基本一致[10,12]。不同的是本实验报道db/db小鼠GCGR蛋白表达变化,并且主要从蛋白水平上进行实验,而既往研究多在mRNA水平上进行。
目前关于慢性高糖引起肝脏GCGR表达升高的具体机制尚不明确。既往研究发现葡萄糖可激活转录因子糖类应答元件结合蛋白(ChREBP)[19-20]。ChREBP通过与GCGR启动子区的糖类反应元件(ChoRE)结合促进GCGR的翻译。GLN可通过作用于GCGR蛋白抑制ChREBP活性,从而降低GCGR的翻译表达[21],该过程形成了一个负反馈环路。结合本研究结果考虑,db/db小鼠肝脏GCGR表达升高的可能机制为高糖作用激活ChREBP导致GCGR表达升高。而长期高糖环境导致GCGR对GLN的作用不敏感,GLN对GCGR负反馈抑制作用减弱,进而db/db小鼠肝脏和慢性高糖作用下的HepG2细胞GCGR表达升高。
综上所述,慢性高糖在动物及细胞水平均增加肝脏GCGR的蛋白表达,使GLN下游信号p-PKA/PKA水平下降,导致肝脏胰高血糖素抵抗。本研究的不足在于db/db小鼠是一种存在多重代谢缺陷的小鼠,不仅存在高血糖一种异常,因而无法排除其他代谢因素的干扰作用。且本研究只是初步研究,今后会进一步探讨肝脏胰高血糖素抵抗对机体代谢紊乱的影响及慢性高糖引起肝脏GCGR表达升高的具体机制。
[参考文献]
[1] Edgerton DS,Cherrington AD. Glucagon as a critical factor in the pathology of diabetes [J]. Diabetes,2011,60(2):377-380.
[2] Briant LJB,Reinbothe TM,Spiliotis I,et al. δ-cells and β-cells are electrically coupled and regulate α-cell activity via somatostatin [J]. J Physiol,2018,596(2):197-215.
[3] Müller TD,Finan B,Clemmensen C,et al. The New Biology and Pharmacology of Glucagon [J]. Physiol Rev,2017, 97(2):721-766.
[4] Gylfe E,Gilon P. Glucose regulation of glucagon secretion [J]. Diabetes Res Clin Pract,2014,103(1):1-10.
[5] Kim T,Nason S,Holleman C,et al. Glucagon Receptor Signaling Regulates Energy Metabolism via Hepatic Farnesoid X Receptor and Fibroblast Growth Factor 21 [J]. Diabetes,2018,67(9):1773-1782.
[6] Zhang H,Qiao A,Yang D,et al. Structure of the full-length glucagon class B G-protein-coupled receptor [J]. Nature,2017,546(7657):259-264.
[7] Li XC,Carretero OA,Shao Y,et al. Glucagon receptor-mediated extracellular signal-regulated kinase 1/2 phosphorylation in rat mesangial cells:role of protein kinase A and phospholipase C [J]. Hypertension,2006,47(3):580-585.
[8] Kim K,Ryu D,Dongiovanni P,et al. Degradation of PHLPP2 by KCTD17,via a Glucagon-Dependent Pathway,Promotes Hepatic Steatosis [J]. Gastroenterology,2017,153(6):1568-1580. e10.
[9] Conarello SL,Jiang G,Mu J,et al. Glucagon receptor knockout mice are resistant to diet-induced obesity and streptozotocin-mediated beta cell loss and hyperglycaemia [J]. Diabetologia,2007,50(1):142-150.
[10] Giri B,Dey S,Das T,et al. Chronic hyperglycemia mediated physiological alteration and metabolic distortion leads to organ dysfunction,infection,cancer progression and other pathophysiological consequences:An update on glucose toxicity [J]. Biomed Pharmacother,2018,107:306-328.
[11] Abrahamsen N,Lundgren K,Nishimura E. Regulation of glucagon receptor mRNA in cultured primary rat hepatocytes by glucose and cAMP [J]. J Biol Chem,1995,270(26):15 853-15 857.
[12] Burcelin R,Mrejen C,Decaux JF,et al. In vivo and in vitro regulation of hepatic glucagon receptor mRNA concentration by glucose metabolism [J]. J Biol Chem,1998, 273(14):8088-8093.
[13] Unger RH,Orci L. The essential role of glucagon in the pathogenesis of diabetes mellitus [J]. Lancet,1975,1(7897):14-16.
[14] Girard J. Glucagon,a key factor in the pathophysiology of type 2 diabetes [J]. Biochimie,2017,143:33-36.
[15] Garcia-Compean D,Jaquez-Quintana JO,Gonzalez-Gonzalez JA,et al. Liver cirrhosis and diabetes:risk factors,pathophysiology,clinical implications and management [J]. World J Gastroenterol,2009,15(3):280-288.
[16] Kim K,Choi S,Park SM. Association of fasting serum glucose level and type 2 diabetes with hepatocellular carcinoma in men with chronic hepatitis B infection:A large cohort study [J]. Eur J Cancer,2018,102:103-113.
[17] 王倩倩,肖元元,祝超瑜,等.肝脏脂肪变对胰高血糖素受体的表达影响[J].医学研究杂志,2016,45(9):33-38.
[18] Melancon A,Gagnon V,Milot M,et al. Liver glucagon receptors(GluR):effect of exercise and fasting on binding characteristics,GluR-mRNA,and GluR protein content in rats [J]. Horm Metab Res,2013,45(10):716-721.
[19] Wang H,Dolezal JM,Kulkarni S,et al. Myc and ChREBP transcription factors cooperatively regulate normal and neoplastic hepatocyte proliferation in mice [J]. J Biol Chem,2018,293(38):14 740-14 757.
[20] Iizuka K. The transcription factor carbohydrate-response element-binding protein(ChREBP):A possible link between metabolic disease and cancer [J]. BBA-Mol Basis Dis,2017,1863(2):474-485.
[21] Iizuka K,Tomita R,Takeda J,et al. Rat glucagon receptor mRNA is directly regulated by glucose through transactivation of the carbohydrate response element binding protein [J]. Biochem Biophys Res Commun,2012,417(4):1107-1112. doi:10.1016/j.bbrc.2011.12.042
(收稿日期:2019-01-28 本文編辑:张瑜杰)
