温敏多柔比星纳米凝胶栓塞微球的评价与处方优化*
2019-10-30陈艳谢委肖政
陈艳,谢委,肖政
(1.武汉市第四医院,华中科技大学同济医学院附属普爱医院消化内科,武汉 430035;2.华中科技大学同济医学院附属同济医院药学部,武汉 430030;3.武汉市第四医院,华中科技大学同济医学院附属普爱医院急诊科,武汉 430035)
以经导管动脉化学治疗(化疗)栓塞(transcatheter arterial chemoembolization,TACE)为代表的介入治疗是20世纪80年代发展起来的一种非手术肿瘤治疗方法,其操作简单易行、安全可靠,对患者创伤小,治疗费用较低,近期疗效显著,已经被公认为中晚期肝癌非手术疗法的首选方案,是肝癌患者姑息治疗及术前、术后辅助治疗的有效手段[1]。栓塞材料是决定治疗效果的关键因素,传统栓塞剂如明胶海绵、淀粉微球、聚乙烯醇(polyving akohol,PVA)等大小不等,形状不一,不易达到末梢栓塞的目的,一定程度上影响了介入治疗的效果[2]。而药物缓释微球(drug-eluting beads,DEB)栓塞剂具有标准的外形尺寸及局部缓释药物优势,能够栓塞末梢小动脉,维持时间较长,不易形成侧支循环;栓塞后能够在数天甚至数周内以较高浓度将药物缓慢释放到肿瘤血管内,用于肝癌的栓塞化疗取得很好的效果,因此受到越来越多的关注[3-4]。笔者在本实验中根据聚N-异丙基丙烯酰胺纳米凝胶的理化性质特点[5-6],构建温敏纳米凝胶载药栓塞微球,通过温度诱导的相变形成栓塞,能够填充各种形状的血管,栓塞效果好,适用于末端血管栓塞,有望成为一种理想的载药栓塞微球。
1 仪器与试药
1.1仪器 AUW 220D型双量程分析天平(日本Shimadzu公司,感量:0.1 mg/0.01 mg);DF-101S集热式恒温加热磁力搅拌器(河南予华仪器有限公司);GXZ-9240 MBE型鼓风干燥箱(上海博迅实业有限公司医疗设备厂);科伟数显电热恒温水浴锅;美国Labconco公司FreeZone 6L型台式冻干机;英国Malvern公司Nano-ZS 90型激光粒度仪;荷兰FEI公司Tecnai G220型透射电子显微镜(TEM);日本Hitachi公司F-4500型荧光分光光度计;美国Millipore公司Milli-Q超纯水系统。
1.2试药N-异丙基丙烯酰胺(N-isopropy-lacrylamide,NIPAM)和N,N′-亚甲基双丙烯酰胺(N,N′-methylene bisacrylamide,MBA)均购自梯希爱(上海)化成工业发展有限公司,批号:I0401,E1086,使用前用环己烷和甲醇重结晶;丙烯酸(acrylic acid,AA)购自国药集团化学试剂有限公司,批号:20170323,使用前重蒸;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸钾(potassium persulfate,KPS)等使用前未做进一步纯化。多柔比星(doxorubicin,DOX)购自浙江海正药业股份有限公司,批号:170401,含量≥99.5%。实验用水均为Milli-Q超纯水。
2 方法与结果
2.1聚(N-异丙基丙烯酰胺-co-丙烯酸)纳米凝胶的制备 称取共聚单体NIPAM 1.13 g、AA 0.08 g、交联剂MBA 0.08 g、乳化剂SDS 0.06 g于500 mL四口烧瓶,加水190 mL,搅拌使溶解。通氮气(N2)至液面以下,驱尽烧瓶内空气后升温至70 ℃。加入2 mg· mL-1引发剂KPS溶液10 mL,在N2氛围下反应5 h,得P(NIPAM-co-AA)纳米凝胶(记为PNA),透析除去未反应的单体和其他小分子物质,冻干。
2.2纳米凝胶的形貌 取PNA纳米凝胶粉末适量,加水溶解并稀释制成0.1 mg·mL-1溶液,摇匀,取2滴于碳膜覆盖的400目铜网上,10 mg·mL-1磷钨酸染色后室温下晾干,透射电子显微镜观察,加速电压200 kV,结果见图1。凝胶颗粒形貌近似较均一微球,粒径约100 nm。
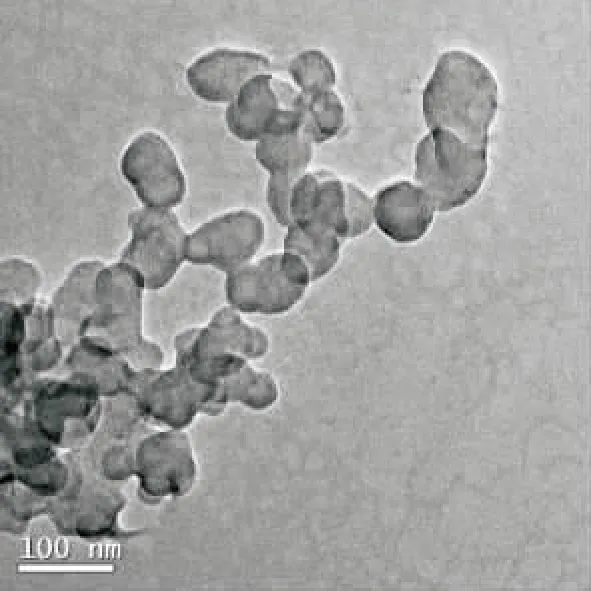
图1 PNA纳米凝胶的TEM图
2.3纳米凝胶微球的温敏性 取PNA纳米凝胶粉末约50 mg,加水10 mL使溶解,置于25~40 ℃恒温水浴,参照“粒度和粒度分布测定法”(《中华人民共和国药典》2015年版通则0982第三法),使检测器遮光率8%~20%,测定不同温度下溶液中纳米凝胶微球的粒径,每个测量温度下样品至少平衡5 min,结果见图2。PNA纳米凝胶微球具有明显温敏性,25 ℃时粒径约150 nm,高于TEM测定的结果。随着温度升高,微球粒径逐步降低,35 ℃后基本稳定,约50 nm。
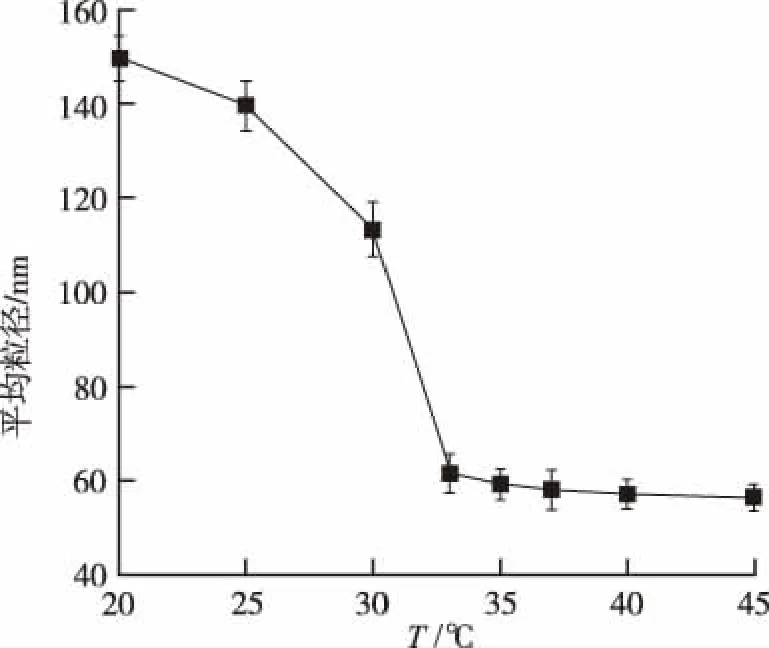
图2 不同温度下纳米凝胶微球的粒径(n=3)
Fig.2Particlesizeofnanogelsmicrospheresatdifferenttemperature(n=3)
2.4温敏纳米凝胶微球的载药 吸取上述PNA溶液4 mL于透析袋(截留相对分子质量=14 000),扎紧袋口,放入装有0.5 mg·mL-1DOX溶液40 mL的锥形瓶,避光搅拌24 h。PNA纳米凝胶含羧基,可以通过离子键与DOX中氨基结合,即通过静电吸附作用负载药物。该过程可以自发完成,见图3,载药前DOX主要位于透析袋外溶液,载药完成后,透析袋内充满溶液,且颜色显著深于袋外,表明透析袋外DOX基本被袋内PNA吸附。将透析袋取出,置纯化水中透析1周,除去未吸附的游离DOX,冻干。

图3 温敏纳米凝胶微球载药照片
Fig.3Photographsofdrug-loadingtemperaturesensitivenanogelsmicrospheres
2.5温敏纳米凝胶微球载药量的测定
2.5.1DOX标准曲线的绘制 精密称取DOX适量,用0.2 mg· mL-1纳米凝胶溶液溶解并定量稀释,制成40 μg·mL-1溶液,摇匀;精密移取1 mL于100 mL量瓶,0.2 mg· mL-1纳米凝胶溶液稀释至刻度,摇匀,作为DOX贮备液。分别精密移取DOX贮备液1.0,2.5,5.0,7.5 mL于10 mL量瓶,用0.2 mg· mL-1纳米凝胶溶液稀释至刻度,摇匀,参照“荧光分光光度法”(《中华人民共和国药典》2015年版通则0405),在激发波长505 nm、发射波长558 mn处测定供试品溶液的荧光强度[7]。以荧光强度(A)对浓度(C)线性回归,得标准曲线方程C=23.84A-26.15(r=0.999 2),表明DOX纳米凝胶溶液在0.04~0.4 μg· mL-1范围内线性关系良好。
2.5.2测定法 精密称取温敏纳米凝胶载药微球(W纳米凝胶)约5 mg置于25 mL量瓶,加水溶解并稀释至刻度,摇匀。精密量取1 mL置于100 mL量瓶,加水稀释至刻度,摇匀,作为供试品溶液。同法测定供试品溶液的荧光强度,用DOX标准曲线回归方程计算供试品溶液浓度(C供),则温敏纳米凝胶微球的载药量按公式(1)计算[8]。

2.5.3重复性实验 按“2.5.2”项方法平行制备6份供试品溶液,依法测定并计算温敏纳米凝胶微球载药量。结果显示,载药量9.21%,6份供试品溶液日内精密度RSD为0.79%(n=6),日间精密度RSD为1.34%(n=6),均符合方法学要求。
2.5.4准确度实验 精密移取“2.5.3”项已准确测得载药量的供试品溶液10 mL于20 mL量瓶,分别加入DOX贮备液4,5,6 mL,加0.2 mg· mL-1纳米凝胶溶液稀释至刻度,摇匀,每个浓度平行配制3份。分别依法测定荧光强度,用DOX标准曲线的回归方程计算低、中、高浓度回收率,结果分别为(98.31±2.14)%,(101.11±2.61)%和(100.03±1.65)%,RSD分别为1.85%(n=3)、0.91%(n=3)和1.04%(n=3),均满足方法学要求。
2.6温敏纳米凝胶载药微球的相变行为 取温敏纳米凝胶载药微球20 mg于样品瓶中,加水1 mL,搅拌过夜使凝胶完全溶解。将样品瓶放入25~37 ℃恒温水浴,观察不同温度下溶液相变情况,见图4。室温下,溶液流动相较好,但随着温度升高,溶液黏度增大,流动性变差,直至从可流动的溶液状态变成不可流动的凝胶状态。该性质是温敏纳米凝胶载药微球可作为栓塞材料的基础,当载药微球溶液注射进入体内后,由于温度升高,溶液在血管内发生相变,转变为不可流动的凝胶状态,形成栓塞[9]。发生溶胶-凝胶转变时的温度,即为温敏纳米凝胶载药微球的相变温度。

图4 温敏纳米凝胶载药微球溶液的相变行为
Fig.4Phasetransitionbehaviorofdrug-loadedtemperaturesensitivenanogelsmicrospheres
2.7温敏纳米凝胶载药栓塞微球的处方优化
2.7.1正交设计实验 温敏纳米凝胶载药栓塞微球的载药量与相变温度是影响其栓塞性能和治疗效果的关键因素,与其处方密切相关。本研究固定NIPAM的投料量为1.13 g,以AA、MBA和SDS的用量为考察因素(分别记为A、B、C),每个因素选取3个水平,如表1所示,进行L9(34)正交实验优化纳米凝胶的处方。
表1 温敏纳米凝胶载药栓塞微球的处方优化因素水平
Tab.1Factorsandlevelsofformulationoptimizationforembolizationmicrospheresofdrug-loadedtemperaturesensitivenanogelsg

因素水平AA用量(A)MBA用量(B)SDS用量(C)10.080.040.0420.160.080.0630.320.120.08
2.7.2正交实验结果 以温敏纳米凝胶载药栓塞微球的载药量与相变温度为考察指标,数据处理采用“归一化法”,将每个指均转化为0~100%之间的“归一值”,并计算几何平均数,得总评归一值(overall desirability,OD)。计算公式如下,结果见表2。
D=(Vn-Vmin)/(Vmax-Vmin)②
OD=(D1×D2)1/2③
其中Vn为实测值,Vmin和Vmax分别指该指标在所有实验中测得的最小值和最大值。
由正交实验直观分析结果可知,以综合评分为优化指标,各考察因素影响的重要性顺序为AA用量>MBA用量>SDS用量,以正交设计助手Ⅱ软件对实验结果进行方差分析,结果见表3。
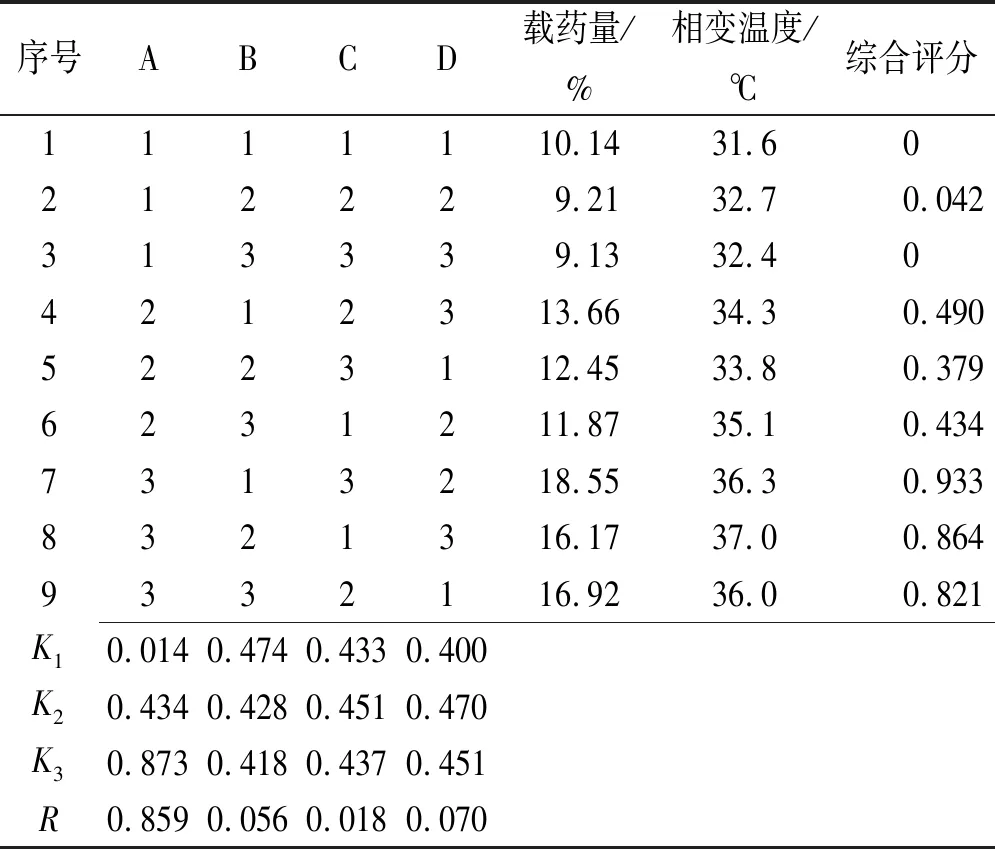
表2 正交实验结果
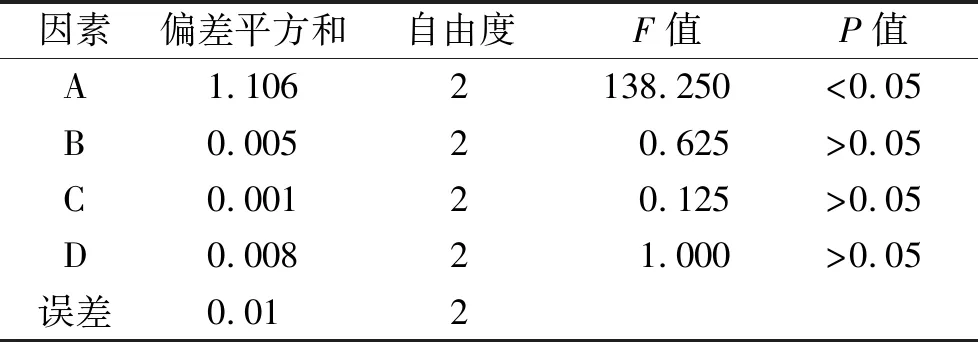
表3 综合评分方差分析
F0.05(2,2)=19.000
空列D为误差项,方差分析结果表明,AA用量对温敏纳米凝胶载药栓塞微球的载药量与相变温度具有显著影响,而MBA用量和SDS用量对载药量与相变温度的影响不显著。经优化后,最佳处方为A3B1C2,即AA用量为0.32 g,MBA用量为0.04 g,SDS用量为0.06 g。
2.7.3优化处方的验证 按正交设计实验筛选的最佳处方,制备3批温敏纳米凝胶载药栓塞微球,并对其载药量和相变温度进行测定。结果表明,采用优选处方制备的3批栓塞微球载药量为(19.01±0.82)%,相变温度为(36.6±2)℃,表明正交设计实验优化的处方可靠,制备的温敏纳米凝胶载药栓塞微球具有较高的载药量和较高的相变温度,有望作为TACE的栓塞载药材料。
3 讨论
3.1温敏纳米凝胶的栓塞机制 由于NIPAM结构同时含有亲水的酰胺基和疏水的异丙基,低于相变温度时,分子内氢键占主导,凝胶微球处于溶胀状态,体积较大。随着温度的升高,氢键被破坏,分子内疏水作用占主导,导致凝胶微球收缩,体积变小[10]。但是当温敏凝胶用于栓塞时,并不是通过微球本身完成栓塞,而是通过微球之间的疏水作用,形成宏观上的凝胶阻塞血管。因此可以避免小颗粒的温敏纳米凝胶载药栓塞微球通过肿瘤血窦或动静脉吻合口,使化疗药更多的进入人体循环,甚至通过肝血管床,在肺部及其他器官形成致命性误栓,导致肢体麻木、瘫痪、脑卒中、死亡等严重后果。
3.2正交实验的数据处理 当指标较多时,每个指标优选的条件可能相互矛盾,对某一效应有利的条件可能对其他效应不利,如载药量和相变温度,前者要求越高越好,后者则不然。因此各效应间应达成妥协,使所有指标综合为一个可反映总体效应结果。本文采用Hassan“归一化”法,将每个指标数学转换,均标准化为0~1的总评“归一值”[11]。
温敏纳米凝胶载药微球具有液体栓塞剂的优点,流动性好,不需要高压注入,能避免栓塞剂反流或异位栓塞的发生,对不同形状、部位均能实现栓塞。而通过溶胶-凝胶转变实现栓塞,又具有颗粒栓塞剂的优点,粘度低,剪切变稀显著,相变行为丰富,具有较大强度。且以温度作为调控因素,避免有机溶剂和交联剂的使用,使用也更为安全,更适合用于血管栓塞[12]。
纳米凝胶处方中AA用量是决定其载药量和相变温度的关键,随着AA用量增加,凝胶亲水性增加,因此颗粒体积增大,相变温度升高[13]。由于DOX是通过羧基的静电吸附作用负载于微球中,所以载药量随着AA的用量的增加而增大。该载药方式制备过程简单,可自发进行,特别适合负载带电荷药物[14]。根据最终优化的处方,NIPAM、AA、MBA和SDS的用量分别为1.13,0.32,0.04和0.06 g,制备的3批栓塞微球载药量为(19.01±0.82)%,相变温度为(36.6±2)℃,有望以优秀的负载DOX栓塞材料用于TACE的治疗。
